- Adamus, P. R. (1987). Atlas of Breeding Birds in Maine, 1978–1983. Maine Department of Inland Fisheries and Wildlife, Augusta, ME, USA. (enlace)
- Administración de Parques Nacionales. Sistema de Información de Biodiversidad (SIB); Ficha: Coccyzus americanus; Recuperado en noviembre 2025 de https://sib.gob.ar/especies/coccyzus-americanus
- Alcorn, J. R. (1988). The Birds of Nevada. Fairview West Publishing, Fallon, NV, USA. (enlace)
- Amos, E. J. R. (1991). A Guide to the Birds of Bermuda. Corncrake, Warwick, Bermuda. 206 pp.
- Anderson, B. W. & S. A. Laymon (1989). Creating habitat for the Yellow-billed Cuckoo (Coccyzus americanus). USDA Forestry Service, USA. (enlace)
- Antelo, C. M. & Z. J. B. Fernández (2013). Las aves no passeriformes de Tucumán, Argentina. Miscelánea, 132. Fundación Miguel Lillo, Argentina. (enlace)
- Andrews, P. & R. Righter (1992). Colorado Birds. Denver Museum of Natural History, Denver, CO, USA. 442 pp.
- Avibase. Ficha: Cuclillo piquigualdo (Coccyzus americanus, Linnaeus, 1758); Recuperado en noviembre 2025 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=0CF12F8155708DC8
- Bancroft, G. T., A. M. Strong & M. Carrington (1995). Deforestation and its effects on forest-nesting birds in the Florida Keys. Conservation Biology, 9: 835–844. (enlace)
- Banks, R. C. (1988). Geographic variation in the Yellow-billed Cuckoo. Condor, 90: 473–477. (enlace)
- Banks, R. C., Cicero, C., Dunn, J. L., Kratter, A. W., Rasmussen, P. C., Remsen Jr, J. V., … & D. F. Stotz (2006). Forty-seventh supplement to the American Ornithologists’ Union check-list of North American birds. The Auk, 123 (3): 926-936. (enlace)
- Barber, N. A., R. J. Marquis & W. P. Tori (2008). Invasive prey impacts the abundance and distribution of native predators. Ecology, 89 (10): 2678–2683.
- Barnett, J. M. & M. Pearman (2001). Lista comentada de las Aves Argentinas. Lynx Edicions, Barcelona, Spain. 164 pp. ISBN 84-87334-32-6
- Beal, F. E. L. (1898). Cuckoos and shrikes and their relation to agriculture. U.S. Department of Agriculture Biological Survey Bulletin 9, USA. (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1: Rheidae through Furnariidae. Bulletin of the American Museum of Natural History, 178: 369–636. (enlace)
- Bender, R. O. (1961). Food competition among closely related sympatric species. Wilson Bulletin, 73: 214. (enlace)
- Bent, A. C. (1940). Life histories of North American cuckoos, goatsuckers, hummingbirds, and their allies. United States National Museum Bulletin, 176. (enlace)
- Bernstein, L. (1965). Fossil birds from the Dominican Republic. Quarterly Journal of the Florida Academy of Sciences, 28: 271–284. (enlace)
- Binford, L. C. (1989). A distributional survey of the birds of the Mexican state of Oaxaca. Ornithological Monographs, 43. American Ornithologists’ Union, Washington, DC, USA. (enlace)
- BirdLife International (2021). Species factsheet: Yellow-billed Cuckoo Coccyzus americanus. Downloaded from https://datazone.birdlife.org/species/factsheet/yellow-billed-cuckoo-coccyzus-americanus on 21/11/2025
- Bodrati, A., K. Cockle, J. M. Segovia, I. Roesler, J. I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A. & S. A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Historia Natural. Tercera Serie, Volumen 5 (1): 77-89. (enlace)
- Bosque, C. & M. Lentino (1987). The passage of North American migratory land birds through xerophytic habitats on the western coast of Venezuela. Biotropica, 19: 267–273. (enlace)
- Brandán, Z. J. (2005). Avifauna de un sector del Bosque de transición Tucumano, en diferentes condiciones de uso. Acta Zoológica Lilloana, 49 (1-2): 3-8. (enlace)
- Brandán, Z. J. & C. I. Navarro (2009). Lista actualizada de las aves de la provincia de Tucumán. Fundación Lillo. Tucumán (enlace)
- Buden, D. W. (1987). The birds of the southern Bahamas, British Ornithology Club Check-list. Nº 8. British Ornithology Club, London, UK. (enlace)
- Burgos, F. G., J. L. Baldo & F. M. Cornell (2009). Lista de las aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. S. S. de Jujuy. (enlace)
- Campbell, R. W., N. K. Dawe, I. McTaggart-Cowan, J. M. Cooper, G. W. Kaiser & M. C. E. McNall (1990). The Birds of British Columbia, Volume 2. Diurnal Birds of Prey Through Woodpeckers. Royal British Columbia Museum, Victoria, Canada.
- Camperi, A. R., Darrieu, C. A. & M. Juárez (2008). Avifauna de la provincia de La Rioja (Argentina): lista comentada de especies. Acta zoológica lilloana, 76-97. (enlace)
- Carma, M. I. (2007). Relevamiento de aves de la provincia de Catamarca. Consejo Federal de Inversiones. 1º Ed., Buenos Aires. 500 pp. ISBN 978-987-510-081-7 (enlace)
- Carothers, S. W., R. R. Johnson & S. W. Aitchison (1974). Populations structure and social organization of southwestern riparian birds. American Zoology, 14: 97–108. (enlace)
- Chébez, J. C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5.; 320 pp. Ed. L.O.L.A. (Literature of Latin America). Buenos Aires. ISBN 950-9725-20-X
- Clark, K. B., B. Procsal & M. Dodero (2014). Recent trends in Yellow-billed Cuckoo occurrences in southern California, with observations of a foraging cuckoo in San Diego County. Western Birds, 45 (2): 141–150. (enlace)
- Clay, M. B. (1929). The Yellow-billed Cuckoo. Bird-Lore, Vol. 31 (3): 189–190. (enlace)
- Clotfelter, E. D. & T. Brush (1995). Unusual parasitism by the Bronzed Cowbird. Cóndor, 97 (3): 814–815. (enlace)
- Coconier, E. G. (ed.) (2007). Las aves silvestres de Acambuco, provincia de Salta, Argentina. Relevamiento de un AICA prioritaria de la selva Pedemontana. Temas de Naturaleza y Conservación, 6: 1-127. Aves Argentinas/AOP, Buenos Aires (enlace)
- Codesido, M. & D. Bilenca (2004). Variación Estacional de un Ensamble de Aves en un Bosque Subtropical Semiárido del Chaco Argentine. Biotropica, 36 (4): 544-554.
- Contino, F. N. (1980). Aves del noroeste argentino. Universidad Nacional de Salta, Secretaría de Estado de Asuntos Agrarios, Dirección General de Recursos Naturales Renovables. 136 pp.
- Contreras, J. R. (1981). Lista preliminar de la avifauna correntina. I. No Passeriformes. Historia Natural, 2: 21-28.
- Contreras, J. R. (1987). Lista preliminar de la avifauna de la provincia de Formosa, República Argentina. Historia Natural, VII (4): 33-52.
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti & E. E. Utges (1990). Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Volume 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1. 164 pp.
- Contreras, J. R., F. Agnolin, Y. E. Davies, I. Godoy, A. Giacchino & E. Ríos (2014). Atlas ornito-geográfico de la provincia de Formosa, República Argentina. 1º Ed. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 pp. (enlace)
- Coria, O. R., Quiroga, O. B., Navarro, J. L., Heredia, J., Torres, R. & J. Lima (2021). Lista actualizada de las aves de Santiago del Estero, Argentina. Acta Zoológica Lilloana: 42:143. (enlace)
- Cracraft, J. (1964). Observations on sun-bathing in the Yellow-billed Cuckoo. Wilson Bulletin, 76: 187. (enlace)
- Cramp, S. (1985). The Birds of the Western Palearctic, Volume 4: Terns to Woodpeckers. Oxford University Press, Oxford, UK.
- Crawford, R. L. & H. M. Stevenson (1984). Patterns of spring and fall migration in northwest Florida. Journal of Field Ornithology, 55 (2): 196–203. (enlace)
- Darrieu, C. A., Camperi, A. R., Piloni, G. & N. R. Bogado (2013). Lista actualizada de las aves de la provincia de Buenos Aires. (1º Ed.) Fundación de Historia Natural» Félix de Azara». 56 pp. ISBN 978-987-29251-1-6 (enlace)
- De Casenave, J. L., Pelotto, J. P., Caziani, S. M., Mermoz, M. & J. Protomastro (1998). Responses of avian assemblages to a natural edge in a Chaco semiarid forest in Argentina. The Auk, 115 (2): 425-435. (enlace)
- de la Peña M. R. (1999). Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 18; 244 pp. Buenos Aires. ISSN 0-328-1620
- de la Peña, M. R. (2006). Lista y distribución de las aves de Santa Fe y Entre Ríos. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 15; 138 pp. Buenos Aires. ISSN 0-328-1620
- de la Peña, M. R., Laene Silva, R., Capuccio, G. & L. M. Bonin (2009) Aves del Río Uruguay. Guía Ilustrada de Especies del Bajo Uruguay y el Embalse de Salto Grande. (CARU). Comisión Administradora del Río Uruguay
- de la Peña, M. R. (2011). Atlas ornitogeográfico de la provincia de Santa Fe. Serie Naturaleza y Conservación No 4. Pág. 1-500.
- de la Peña, M. R. (2013) Citas, observaciones y distribución de aves argentinas: Edición ampliada. Serie Naturaleza, Conservación y Sociedad N° 7, Ediciones Biológica, 786 pp.
- de la Peña, M. R. (2015). Aves Argentinas. Incluye nidos y huevos. 1º Ed. Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña, M. R. (2016). Aves Argentinas: descripción, comportamiento, reproducción y distribución. Charadriidae a Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie). Vol. 20 (1): 1-627.
- de la Peña, M. R. (2020). Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución (actualización). Cuculidae, Tytonidae, Strigidae, Nyctibiidae, Caprimulgidae, Apodidae, Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) N° 6: 1-348. ISSN 0325-3856
- del Hoyo, J. de. (2020). All the Birds of the World. Lynx Edicions, Barcelona. ISBN 978-84-16728-37-4
- Di Giácomo, A. G. (2005). Aves de la Reserva El Bagual. Pp 203-465 en Historia natural y paisaje de la Reserva El Bagual, Provincia de Formosa, Argentina (A. G. Di Giácomo and S. F. Krapovickas, Editores). Temas de Naturaleza y Conservación N°4. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires, Argentina. (enlace)
- Dobkin, D. S. (1994). Conservation and Management of Neotropical Migrant Land Birds in the Northern Rockies and Great Plains. University of Idaho Press, Moscow, ID, USA. (enlace)
- Downer, A. & R. Sutton (1990). Birds of Jamaica: A Photographic Field Guide. Cambridge University Press, Cambridge, UK. (enlace)
- Duquette, G. (2019). “Yellow-billed cuckoo”, pp. 172-173 in Second Atlas of the Breeding Birds of Southern Québec. Regroupement (M. Robert, M.-H. Hachey, D. Lepage and A.R. Couturier, eds.). Regroupement QuébecOiseaux, Canadian Wildlife Service (Environment and Climate Change Canada) and Bird Studies Canada, Montréal, xxv + 694 p. Downloaded on 15 January 2024 https://www.atlas-oiseaux.qc.ca/telechargement_en.jsp
- Eastman, J. (1991). Yellow-billed Cuckoo. In The Atlas of Breeding Birds of Michigan (R. Brewer, G. A. McPeek, and R. J. Adams Jr., Editors). Michigan State University Press East Lansing, MI, USA. pp. 234–245.
- Eaton, S. W. (1979). Notes on the reproductive behavior of the Yellow-billed Cuckoo. Wilson Bulletin, 91: 154–155. (enlace)
- Eaton, S. W. (1988). Yellow-billed Cuckoo. In The Atlas of Breeding Birds in New York State (R. F. Andrle and J. R. Carroll, Editors). Cornell University Press, Ithaca, NY, USA. pp. 198–199 (enlace)
- eBird. Ficha: Cuclillo piquigualdo (Coccyzus americanus). Recuperado en noviembre 2025 de https://ebird.org/species/yebcuc
- Echevarría, A. L., N. L. Marigliano & J. M. Chani (1998). Composición y variaciones anuales de la diversidad de aves de una localidad de Bosque chaqueño serrano (Ticucho, El Cadillal, Tucumán, Argentina). Acta Zoológica Lilloana, 44 (1): 207-217.
- Echevarría, A. L. & J. M. Chani (1999). Lista de aves del embalse El Cadillal, provincia de Tucumán. Acta Zoológica Lilloana, 45 (1): 141-145.
- Echevarría, A. L. & J. M. Chani (2000). Estructura de las comunidades de aves acuáticas del embalse El Cadillal, Tucumán, Argentina. Acta Zoológica Lilloana, 45 (2): 219-232. (enlace)
- Echevarría, A. L. & J. M. Chani (2006). Aves migratorias, la importancia del embalse El Cadillal, (Tucumán, Argentina) como sitio de tránsito e invernada. Acta Zoológica Lilloana, 50 (1-2): 97-108 (enlace)
- Echevarría, A. L., J. M. Chani, R. Lobo Allende, M. D. Juri, J. Torres Dowsall, E. Martín & E. Tribulo (2007). Aves del Jardín Botánico de la Fundación Miguel Lillo, Fundación Miguel Lillo, Tucumán, Argentina, 1º Ed.. 136 pp.
- Echevarría, A. L., L. R. Lobo Allende, M. D. Juri, J. M. Chani, J. Torres Dowsall & E. Martín (2011). Composición, estructura y variación estacional de la comunidad de aves del Jardín Botánico de la Fundación Miguel Lillo, Tucumán, Argentina. Acta. Zool. Lilloana, 55: 123-136.
- EcoRegistros (2025). Ficha: Cuclillo pico amarillo (Coccyzus americanus, Linnaeus 1758); Recuperado en noviembre 2025 de https://www.ecoregistros.org/ficha/Coccyzus-americanus
- Ehrlich, P. R., D. S. Dobkin & D. Wheye (1992). Birds in Jeopardy: The Imperiled and Extinct Birds of the United States and Canada, Including Hawaii and Puerto Rico. Stanford University Press, Stanford, CA, USA. (enlace)
- Esteban, J. G. (1953). Nuevas localidades para aves argentinas. Acta Zool. Lilloana, 13: 349-362.
- Evans, P. G. H. (1990). Birds of the Eastern Caribbean. Macmillan Press, Ltd., London, United Kingdom. (enlace)
- Fanjul, M. E. (2010). El papel de las plantaciones de limones (Citrus lemon) para la avifauna en Tucumán, Argentina. Tesis de Maestría, Universidad Nacional de Córdoba. Programa de Postgrado en Manejo de Vida Silvestre, Córdoba, Argentina.
- Farrell, L. L. (2014). Examining the genetic distinctiveness of the western subspecies of Yellow-billed Cuckoo Coccyzus americanus occidentalis. Ardea, 101 (2): 165–170. (enlace)
- Fernández Guaraz, J. L. (2013). Nuevo registro de Cuclillo pico amarillo (Coccyzus americanus) para la provincia de Entre Ríos, Argentina. Ecoregistros Revista, 3 (8): 33-35. (enlace)
- Ffrench, R. (1991). A Guide to the Birds of Trinidad and Tobago. Revised edition. Cornell University Press, Ithaca, NY, USA.
- Fleischer, R. C., M. T. Murphy & L. E. Hunt (1985). Clutch size increase and intraspecific brood parasitism in the Yellow-billed Cuckoo. Wilson Bulletin, 97: 125–127. (enlace)
- Fraga, R. M. (1997). Sección III, Aves. La Categorización de las aves argentines en F.U.C.E.M.A., A.O.P., S.A.R.E.M. y A.P.N. Libro Rojo de Mamíferos y Aves Amenazados de la Argentina. 157-219 pp. (enlace)
- Franzreb, K. E. & S. A. Laymon (1993). A reassessment of the taxonomic status of the Yellow-billed Cuckoo. Western Birds, 24: 17–28.
- Friedmann, H. (1971). Further information on the host relations of the parasitic cowbirds. Auk, 88: 239–255. (enlace)
- Friedmann, H., L. Griscom & R. Moore (1950). Distributional checklist of the birds of Mexico, Part I. Pacific Coast Avifauna 29. (enlace)
- Gaines, D. (1974). Review of the status of the Yellow-billed Cuckoo in California: Sacramento Valley populations. Condor, 76: 204–209. (enlace)
- Gaines, D. & S. A. Laymon (1984). Decline, status, and preservation of the Yellow-billed Cuckoo in California. Western Birds, 15: 49–80. (enlace)
- Giacomelli, E. (1907). Catálogo sistemático de la avifauna riojana. Anales de la Sociedad Científica Argentina, 63: 66-84.
- Giacomelli, E. (1923). Catálogo sistemático de las aves útiles y nocivas de la provincia de La Rioja. Hornero, 3: 66-84. (enlace)
- Giai, A. G. (1950). Notas de viajes. Por el norte occidental de Santa Fe y por el norte de Misiones. Hornero, 9 (2): 121-164. (enlace)
- Giraudo, A. R., Bortoluzzi, A. & V. Arzamendia (2006). Vertebrados tetrápodos de la Reserva y Sitio Ramsar “Esteros del Iberá” (Corrientes, Argentina): Análisis de su composición y nuevos registros para especies amenazadas. Natura Neotropicalis, 37 (1-2): 1-20. (enlace)
- Grocki, D. R. J. & D. W. Johnston (1974). Chlorinated hydrocarbon pesticides in North American cuckoos. Auk, 91: 186–188. (enlace)
- Groschupf, K. (1987). Status of the Yellow-billed Cuckoo (Coccyzus americanus occidentalis) in Arizona and west Texas. USFW Service, Phoenix, AZ.
- Halterman, M. D. (2009). Sexual dimorphism, home range, detection probability, and parental care in the Yellow-billed Cuckoo. Ph.D. dissertation, University of Nevada, Reno, NV, USA. (enlace)
- Halterman, M. D., Johnson, M. J., Holmes, J. A. & S. A. Laymon (2015). A natural history summary and survey protocol for the western distinct population segment of the Yellow-billed Cuckoo. Sacramento, CA: US Fish and Wildlife Service. (enlace)
- Hamilton III, W. J. & M. E. Hamilton (1965). Breeding characteristics of Yellow-billed Cuckoos in Arizona. Proceedings of the California Academy of Science, 32: 405–432. (enlace)
- Hanna, W. C. (1937). California Cuckoo in the San Bernardino Valley, California. Cóndor, 39: 57–59. (enlace)
- Harrison, C. J. O. (1979). A Field Guide to the Nests, Eggs and Nestlings of North American Birds. Collins, New York. (enlace)
- Haverschmidt, F., & G. F. Mees (1968). Birds of Suriname. Paramaribo, Suriname: VACO N.V. (enlace)
- Hayes, F. E. (1995). Status, Distribution, and Biogeography of the Birds of Paraguay. American Birding Association, Colorado Springs, Colorado, USA.
- Hayes, F. E., S. M. Goodman, J. A. Fox, T. G. Tamayo & N. E. López (1990). North American bird migrants in Paraguay. Condor, 92: 947–960. (enlace)
- Hendricks, D. P. (1975). Copulatory behavior of a pair of Yellow-billed Cuckoos. Auk, 92: 151. (enlace)
- Hilty, S. L. (2002). Birds of Venezuela. (2º Ed.). Princeton University Press, 41 William Street, Princeton, New Jersey 08540. 878 pp. ISBN: 0691021317
- Hilty, S. L. & W. L. Brown (1986). A Guide to the Birds of Colombia. Princeton University Press, Princeton, NJ, USA.
- Howe, W. H. (1986). Status of the Yellow-billed Cuckoo (Coccyzus americanus) in New Mexico. New Mexico Department Game Fish, Santa Fe, NM, USA.
- Howell, J. C., A. R. Laskey & J. T. Tanner (1954). Bird mortality at airport ceilometers. Wilson Bulletin, 66: 207–215. (enlace)
- Howell, S. N. G. & S. Webb (1995). A Guide to the Birds of Mexico and Northern Central America. Oxford University Press, New York, NY, USA.
- Hughes, J. M. (1996). Phylogenetic analysis of the Cuculidae (Aves, Cuculiformes) using behavioral and ecological characters. The Auk, 113 (1): 10-22. (enlace)
- Hughes, J. M. (1997). Taxonomic significance of host-egg mimicry by facultative brood parasites of the avian genus Coccyzus (Cuculidae). Canadian Journal of Zoology, 75: 1380–1386.
- Hughes, J. M. (2006). Phylogeny of the cuckoo genus Coccyzus (Aves: Cuculidae): a test of monophyly. Systematics and Biodiversity, 4 (4): 483-488. (enlace)
- Hughes, J. M. (2020). Yellow-billed Cuckoo (Coccyzus americanus), version 1.0. In Birds of the World (P. G. Rodewald, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.yebcuc.01
- Johnsgard, P. A. (1979). Birds of the Great Plains: Breeding Species and their Distribution. University of Nebraska Press, Lincoln, NE, USA. (enlace)
- Johnston, D. W. (1975). Ecological analysis of the Cayman Island avifauna. Bulletin of the Florida State Museum Biological Sciences, 19: 235–295. (enlace)
- Kepler, C. B. & A. K. Kepler (1978). Status and nesting of the Yellow-billed Cuckoo in Puerto Rico. Auk, 95: 417–419. (enlace)
- Klimaitis, J. F. (1975). Lista sistemática de aves del partido de Berisso (Bs. As.): parte I: no Passeriformes. Hornero, 11 (04): (enlace)
- Klimaitis, J. F. & F. N. Moschione (1987). Aves de la Reserva Integral de Selva Marginal de Punta Lara y sus Alrededores. Dirección de Servicios Generales del Ministerio de Economía de la Provincia de Buenos Aires, Argentina.
- Lack, D. (1976). Island Biology, Illustrated by the Land Birds of Jamaica. Volume 3. University of California Press, Berkeley, CA. USA.
- Laubmann, A. (1930). Vögel en Wissenschaftliche Ergebnisse der Deutschen Gran Chaco-Expedition. Verlag von Strecker und Schröder, Stuttgart.
- Laymon, S. A. (1980). Feeding and nesting behavior of the Yellow-billed Cuckoo in the Sacramento Valley. Sacramento: Calif. Dept. Fish and Wildlife. (enlace)
- Laymon, S. A. & M. D. Halterman (1987). Can the western subspecies of Yellow-billed Cuckoo be saved from extinction? Western Birds, 18: 19–25. (enlace)
- Laymon, S. A. & M. D. Halterman (1989). A proposed habitat management plan for Yellow-billed Cuckoos in California. US Department of Agriculture, Forest Service, Pacific Southwest Forest and Range Experiment Station, 110: 272–277. (enlace)
- Laymon, S. A., P. L. Williams & M. D. Halterman (1997). Breeding status of the Yellow-billed Cuckoo in the South Fork Kern River Valley, Kern County, California: Summary report 1985? 1996. In Challenge Cost-Share Grant: Admin. Rep. USDA Forest Service, Sequoia National Forest, Cannell Meadow Ranger District. (enlace)
- Lucero, M. M. (1983). Lista y distribución de aves y mamíferos de la provincia de Tucumán. Miscelánea Nº 75. Fund. M. Lillo. Tucumán. 61 pp. (enlace)
- Lucero, M. M., J. M. Chani, Z. J. Brandán, A. L. Echevarría & M. D. Juri (2002). Lista de aves de San Miguel de Tucumán y Yerba Buena. Acta Zool. Lilloana, 46 (1 y 2): 131-135 (enlace)
- Lucero, M. M., Z. J. Brandán & J. M. Chani (2005). Composición y variación anual de la avifauna de los tres grandes parques urbanos de San Miguel de Tucumán (Tucumán, Argentina). Acta Zool. Lilloana, 49 (1 y 2): 43-48.
- Manassero, M., H. Luna & L. Acquaviva (2007). Jaaukanigás. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 433-434. Temas de Naturaleza y Conservación 5. CD-ROM. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires.
- McNeil, S. E., D. Tracy, J. R. Stanek & J. E. Stanek (2012). Yellow-billed Cuckoo distribution, abundance and habitat use on the lower Colorado River and tributaries, 2011 annual report. Boulder City: Lower Colorado River Multi-species Conservation Program, Bureau of Reclamation. (enlace)
- Mengel, R. M. (1965). The Birds of Kentucky. Ornithological Monographs 3. American Ornithologists’ Union, Washington, DC, USA. (enlace)
- Meyer de Schauensee, R. (1982). A Guide to the Birds of South America. Livingston Publishing Company, Wynnewood, PA, USA. (enlace)
- Meyer de Schauensee, R. & W. H. Phelps (1978). A Guide to the Birds of Venezuela. Princeton University Press, Princeton, NJ, USA. (enlace)
- Miatello, R., Baldo, J., Biancucci, L. & V. Cobos (2003). Nuevos registros de aves poco citadas para Córdoba, Argentina. Nuestras Aves, (45): 15-21. (enlace)
- Monroe, B. L., Jr. (1968). A distributional survey of the birds of Honduras. Ornithological Monographs, 7. American Ornithologists’ Union, Washington, D.C., USA. (enlace)
- Morici, A. (2012). Las aves del área Natural Protegida “Dique Roggero” (Buenos Aires, Argentina). Biológica, 15: 24-36. (enlace)
- Moschione, F. & L. Bishels (2004). Listado de las aves del Parque Provincial Loro Hablador, provincia del Chaco. Informe Técnico. Proyecto Elé/DFS. Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F. N. & J. Segovia (2005). Listado de las aves de la Reserva Natural Las Lancitas, Santa Bárbara, Jujuy. (Informe Téc.) Proy. Elé/DFS.
- Moschione, F., O. Spitznagel & M. González (2014). Lista de aves de Salta. Gobierno de la Provincia de Salta. (enlace)
- Narosky, T. & A. G. Di Giacomo (1993). Las aves de la provincia de Buenos Aires, distribución y estatus. Asoc. Orn. del Plata. Vazquez Mazzini Editores, L.O.L.A., Buenos Aires. 127 pp. ISBN: 950-99063-6-0
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. ISBN 950-99063-6-0
- Naturalis Biodversity Center (2017). Dutch Caribbean Species Register, www.dutchcaribbeanspecies.org. Accessed on ocubre 2025. (enlace)
- Navarro, C. I., Z. J. Brandán & N. L. Marigliano (2007). Lista comentada de las aves de un fragmento de la Reserva Provincial La Florida, Tucumán, Argentina. Acta Zool. Lilloana, 51: 142-150. (enlace)
- Nolan, Jr., V. (1975). External differences between newly hatched cuckoos (Coccyzus americanus and C. erythropthalmus). Cóndor, 77: 431. (enlace)
- Nolan, Jr., V. & C. F. Thompson (1975). The occurrence and significance of anomalous reproductive activities in two North American nonparasitic cuckoos Coccyzus spp. Ibis, 117: 496–503. (enlace)
- Nolan, V., Jr. (1963). Reproductive success of birds in a deciduous scrub habitat. Ecology, 44: 305–313. (enlace)
- Nores, M. A., D. Yzurieta & S. A. Salvador (1991). Lista y Distribución de las Aves de Santiago del Estero, Argentina. Bol. Acad. Nac. Cienc. Córdoba, 59: 157-196 (enlace)
- Nores, M. (1996). Avifauna de la provincia de Córdoba. Fauna, 1: 255-337.
- Oberholser, H. C. (1974). The Bird Life of Texas. Vol 1. University of Texas Press, Austin, TX, USA. (enlace)
- Olrog, C. Ch. (1979). Nueva Lista de la Avifauna Argentina. Ópera Lilloana XXVII. Ministerio de Cultura y Educación. Fundación Miguel Lillo. Tucumán, Argentina. 324 pp. ISSN 0078-5245
- Olrog, C. Ch. (1984). Las aves argentinas. Una guía de campo. Ad. Parques Nacionales. 352 pp. (enlace)
- Ortiz, D. & C. Ruiz (2011). Migración y estacionalidad de aves en el arroyo Mista, Tucumán, Argentina. Nuestras Aves, 56: 16-18. (enlace)
- Ortiz, D. & R. Aráoz (2014). Aves de la Sierra de San Javier. Universidad Nacional de Tucumán. ISBN 978-987-33-4376-6 (enlace)
- Pagano, L. G., Jordan, E. A. & J. I. Areta (2012). Aves de la Reserva Natural de Punta Lara. In book: Inventario de los Vertebrados de la Reserva Natural Punta Lara, provincia de Buenos Aires, Argentina.Edition: Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 8.Publisher: Aves Argentinas. Editors: Gabriela Agostini, Ignacio Roesler. (enlace)
- Parker T. A., III, S. A. Parker & M. A. Plenge (1982). An Annotated Checklist of Peruvian Birds. Buteo Books, Vermillion, South Dakota, USA. (enlace)
- Payne, R. B., Editor (2005). The Cuckoos. Oxford University Press, New York, NY, USA.
- Peck, G. K. & R. D. James (1983). Breeding Birds of Ontario: Nidiology and Distribution. Volume 1: Nonpasserines. Royal Ontario Museum, Toronto, ON, Canada. (enlace)
- Pereyra, J. A. (1938). Aves de la zona ribereña nordeste de la provincia de Buenos Aires. Memorias del Jardín Zoológico. La Plata. Tomo 9, parte 2: 1-304.
- Peterjohn, B. G. (1989). The Birds of Ohio. Indiana University Press, Bloomington, IN, USA. (enlace)
- Planqué, R., Vellinga, W. P., Pieterse, S., Jongsma J. & R. de By (Xeno-canto Foundation). Ficha: Cuclillo piquigualdo (Coccyzus americanus, Linnaeus 1758); recuperado en noviembre 2025 de https://xeno-canto.org/species/Coccyzus-americanus
- Potter, E. F. (1980). Notes on nesting Yellow-billed Cuckoos. Journal of Field Ornithology, 51: 17–29. (enlace)
- Potter, E. F. (1981). Effects of cool weather on nesting behavior and development in the Yellow-billed Cuckoo. Chat, 45:15–16. (enlace)
- Preble, N. A. (1957). Nesting habits of the Yellow-billed Cuckoo. American Midland Naturalist, 57: 474–482. (enlace)
- Pruett, C.L., Gibson, D.D. & K. Winker (2001). Molecular “cuckoo clock” suggests listing of western Yellow-billed Cuckoos may be warranted. Wilson Bull., 113 (2): 228–231. (enlace)
- Pugnali, G. & P. Chamorro (2008). Lista de aves de la Reserva Costanera Sur. Aves Argentinas. Buenos Aires. (enlace)
- Pulich, W. M. (1988). The Birds of North Central Texas. Texas A & M University Press, College Station, Texas, USA. 439 pp. ISBN 9780890963227
- Pyle, P. (1995). Incomplete flight feather molt and age in certain North American non-passerines. North American Bird Bander, 20: 15–26. (enlace)
- Quiroga, O. B., W. S. Aveldaño, J. C. Mamaní, E. Martínez Pastur & T. Moreno Ten (2020). Notas sobre veintidós especies de aves del noroeste argentino. Nótulas Faunísticas. Segunda Serie, 285: 1-7. (enlace)
- Raffaele, H., J. Wiley, O. Garrido, A. Keith & J. Raffaele (2003). Birds of the West Indies. Princeton University Press, Princeton, NJ, USA. ISBN 0-691-11319
- Rappole, J. H., E. S. Morton, T. E. Lovejoy III & J. S. Rous (1983). Nearctic Avian Migrants in the Neotropics. U.S. Fish and Wildlife Service, Washington, DC, USA. (enlace)
- Remsen, Jr., J. V., M. A. Traylor, Jr. & K. C. Parkes (1986). Range extensions for some Bolivian birds, 2 (Columbidae to Rhinocryptidae). Bulletin of the British Ornithologists’ Club, 106: 22–32. (enlace)
- RHJV (Riparian Habitat Joint Venture) (2004). The riparian bird conservation plan: a strategy for reversing the decline of riparian associated birds in California. California Partners in Flight. (enlace)
- Ridgely, R. S. & J. A. Gwynne (1989). A Guide to the Birds of Panama with Costa Rica, Nicaragua, and Honduras. 2nd edition. Princeton University Press, Princeton, NJ, USA.
- Ridgway, R. (1916). The Birds of North and Middle America. Part 7. United States National Museum Bulletin 50. (enlace)
- Rohwer, S., K. A. Hobson & V. G. Rohwer (2009). Migratory double breeding in Neotropical migrant birds. Proceedings of the National Academy of Sciences of the United States of America, 106 (45): 19050-19055. (enlace)
- Rohwer, S. & C. S. Wood (2013). Abundant early-summer breeding in Sinaloa does not suggest post-migration breeding in three potential double breeders. Wilson Journal of Ornithology, 125 (2): 243-250.
- Rohwer, S., V. G. Rohwer, A. T. Peterson, A. G. Navarro-Sigüenza & P. English (2012). Assessing migratory double breeding through complementary specimen densities and breeding records. Cóndor, 114 (1): 1–14. (enlace)
- Saibene, C. A., Castelino, M. A., Rey, N. R., Herrera, J. & J. Calo (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina. Monografía N.º 9. (1º Ed.). Editorial L.O.L.A. (Literature of Latin America). Buenos Aires, Argentina. 70 pp. ISSN 0328-1620
- Salvador, S. A., Salvador, L. A., Ferrari, C. & S. Vitale (2016). Listado de las aves de la Provincia de Córdoba, Argentina. Argentina Birds Checklist. (enlace)
- Salvador, S. A., L. A. Salvador & C. Ferrari (2017). Aves de la provincia de Córdoba. Distribución e Historia Natural. Ed. DP. Argentina. SA.
- Sauer, J. R., J. E. Hines & J. Fallon (2008). El censo de aves reproductoras de América del Norte: resultados y análisis 1966-2007. Versión 5.15.2008. Centro de Investigación de Vida Silvestre Patuxent del USGS.Laurel, MD.
- Schönwetter, M. (1967). Handbuch der Oologie, Volume 1: Nonpasseres. Akademie-Verlag, Berlin, Germany. (enlace)
- Schulenberg, T. S. (2010). Birds of Peru: revised and updated edition (Vol. 63). Princeton University Press.
- Sferco, G. D. & M. Nores (2003). Lista comentada de las aves de la Reserva Natural Chancaní, Córdoba, Argentina. Hornero, 18 (1): 21-29. (enlace)
- Shire, G. G., K. Brown & G. Winegrad (2000). Communication towers: a deadly hazard to birds. A report compiled by the American Bird Conservancy documenting the killing of 230 bird species. American Bird Conservancy, Washington, DC, USA. (enlace)
- Short, L. L. (1974). Nesting of southern Sonoran birds during the summer rainy season. Cóndor, 76 (1):21–32. (enlace)
- Sibley, C. G. & B. L. Monroe (1990). Distribution and taxonomy of birds of the world. Yale University Press, Connecticut. ISBN 0-300-04969-2 (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Uma Introdução. Universidad de Brasília, Brasília, Brazil. 912 pp. ISBN 85-209-0816-0
- Slud, P. (1964). The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History, 128. (enlace)
- Stevenson, H. M. & B. H. Anderson (1994). The Birdlife of Florida. University Press of Florida, Gainesville, FL, USA. (enlace)
- Stiles, F. G. & A. F. Skutch (1989). A Guide to the Birds of Costa Rica. Cornell University Press, Ithaca, NY, USA. (enlace)
- Stockton De Dod, A. (1978). Aves de la República Dominicana. Santo Domingo: Museo Nacional de Historia Natural. (enlace)
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker III & D. K. Moskovits (1996). Neotropical birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA.
- Stotz, D. F., R. O. Bierregaard, M. Cohn-Haft, P. Peterman & J. Smith (1992). The status of North American migrants in central Amazonian Brazil. Cóndor, 94: 608–621. (enlace)
- Sutton, G. M., R. B. Lea & E. P. Edwards (1950). Notes on the ranges and breeding habits of certain Mexican birds. Bird-Banding, 21 (2): 45–59. (enlace)
- Sutton, G. M. (1967). Oklahoma Birds, Their Ecology and Distribution with Comments on the Avifauna of the Southern Great Plains. University of Oklahoma Press, Norman, OK, USA.
- Vega, J. H. & J. H. Rappole (1994). Composition and phenology of an avian community in the Rio Grande Plain of Texas. Wilson Bulletin, 106: 366–380. (enlace)
- Vides-Almonacid, R. (1991). La alteración del bosque de Yungas en Tucumán, Argentina y el uso de las aves como indicadores ecológicos para el diseño de zonas de amortiguamiento en áreas protegidas. Tesis Maestría Sc., Programa de Maestría en Manejo de Vida Silvestre para Mesoamérica y el Caribe, Universidad de Costa Rica, 210 pp.
- Vides Almonacid, R. (1993). Estudio comparativo de las taxocenosis de aves de los bosques montanos de la Sierra de San Javier, Tucumán, Argentina: Bases para su manejo y conservación. Tesis doctoral, Facultad de Cs. Naturales, Universidad Nacional de Tucumán, Argentina, 347 pp.
- Wallace, G. J. W. P. Nickell, & R. F. Bernard (1961). Bird mortality in the Dutch elm disease program in Michigan. Cranbrook Institute of Science Bulletin 41. (enlace)
- Wallace, C. S. A., M. L. Villarreal & C. van Riper III (2013). Influence of monsoon-related riparian phenology on Yellow-billed Cuckoo habitat selection in Arizona. Journal of Biogeography, 40 (11):2094–2107. (enlace)
- Wenger, T. (2013). En Michigan Breeding Bird Atlas II. Ed. Chartier, A. T., Baldy, J. J. & J. Brenneman. Kalamazoo Nature Center, Michigan. ISBN 978-0-615-77004-8 (enlace)
- Wetmore, A. (1968). Additions to the list of birds recorded from Colombia. Wilson Bulletin, 80: 325–326. (enlace)
- Wilson, J. K. (2000). Additional observations on precopulatory behavior of Yellow-billed Cuckoos. Southwestern Naturalist, 45 (4): 535–536. (enlace)
- Woods, R. W. (2006). Checklist of Falkland Islands Birds
- Yasukawa, K. (2010). Yellow-billed Cuckoo hatched and fed by a Red-winged Blackbird. Wilson Journal of Ornithology, 122 (2): 402–405. (enlace)
- Yzurieta, D. (1995). Manual de reconocimiento y evaluación ecológica de las aves de Córdoba. Ministerio de Agricultura, Ganadería y Recursos Renovables. Córdoba.
- Zotta, A. R. (1934). Sobre el contenido estomacal de algunas aves. Hornero, 5 (3): 376-383. (enlace)
- Zotta, A. R. (1944). Lista sistemática de las aves Argentinas. Mus. Argen. Cienc. Nat. Buenos Aires.
-
-
Cuclillo pico amarillo | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR.La especie presenta un rango de distribución extremadamente amplio y, en consecuencia, no se aproxima a los umbrales de la categoría Vulnerable según los criterios de extensión de ocurrencia (<20.000 km²), reducción del área de ocupación o fragmentación severa. Aunque existen evidencias de un declive poblacional, este no alcanza el umbral exigido por la UICN para considerar la especie como Vulnerable (disminuciones >30 % en diez años o tres generaciones). Su población global es muy numerosa y supera ampliamente el límite crítico de 10.000 individuos maduros, sin indicios de un declive acelerado que permita clasificarla en una categoría de mayor riesgo. Por estas razones, la especie se evalúa como de “Preocupación Menor”. No obstante, se ha registrado un descenso significativo promedio del 1,6 % anual entre 1970 y 2017 (Partners in Flight 2019) y una reducción del 7 % en Norteamérica durante la última década (Pardieck et al. 2018).
El cuclillo pico amarillo (Coccyzus americanus) es un migrante neotropical que se reproduce en Norteamérica y México y pasa el invierno en Sudamérica (Halterman, 2009:1; Hughes, 2020). Aunque común en el este del continente, sus poblaciones occidentales han experimentado declives severos asociados a la pérdida histórica de más del 95 % del hábitat ribereño (Gaines & Laymon, 1984:49), en un patrón similar al de otras especies ribereñas obligadas del oeste (Hughes, 2020; Laymon & Halterman, 1989:273). Este deterioro ha impulsado acciones de conservación que culminaron en su designación como “amenazada” bajo la «Endangered Species Act».
La especie depende de vegetación ribereña nativa, como álamos y sauces; sin embargo, la pérdida de hábitat alcanza entre 90–99 % en Arizona, Nuevo México y California. Entre los factores principales se encuentran represas, desvíos de agua, ganadería, canalización de ríos y expansión de vegetación exótica como Tamarix y Russian olive, agravados por el cambio climático y la sequía (USFWS 2013; Hughes, 2020).
Las designaciones estatales han variado en función de revisiones taxonómicas (Banks 1988a; Ehrlich et al., 1992). La población occidental fue finalmente incluida como “amenazada” a nivel federal en 2014 (USFWS 2014b), pero persisten categorías divergentes entre estados, desde “en peligro crítico” en Nevada hasta “especie sensible” o “de preocupación” en otros estados del oeste (USFWS 2013, 2014b).
Entre las amenazas antrópicas destacan los efectos de pesticidas (mortalidad directa, adelgazamiento de cáscaras y bioacumulación de DDT) (Laymon, 1980:11; Wallace et al., 1961:31; Grocki & Johnston, 1974:186), así como colisiones con torres y edificios durante la migración nocturna (Howell et al., 1954:212; Shire et al., 2000:8). La degradación y fragmentación del hábitat reduce las características del entorno reproductivo, con requerimientos mínimos de 40–80 ha de bosque ribereño continuo en California (Laymon & Halterman, 1989:274). Las obras hidráulicas, la agricultura, el pastoreo y la expansión de Tamarix han contribuido significativamente a estos declives (Dobkin, 1994:B24; Groschupf, 1987).
Adicionalmente, la especie enfrenta perturbaciones acústicas en zonas urbanas (Goodwin & Shriver, 2011), fluctuaciones climáticas asociadas a la Oscilación del Atlántico Norte y El Niño (Anders & Post, 2006), depredación por aves rapaces y mamíferos, y parasitismo ocasional por Molothrus spp. (Hughes, 1999). El descenso anual de 1,7 % entre 1966 y 2007 (Sauer et al., 2008) refleja una tendencia negativa marcada, en especial en regiones occidentales.
Las estrategias de conservación recomiendan mantener rodales ribereños de álamos y sauces de 10–15 m en el oeste (Anderson & Laymon, 1989) y bosques abiertos con sotobosque denso en el este, junto con la restauración del hábitat y la eliminación del uso de pesticidas en zonas cercanas. Aunque la población global se estima en 9.200.000 individuos y se clasifica como de “preocupación menor” (Rich et al., 2003), la población occidental continúa en declive debido a la destrucción del hábitat, alteraciones hidrológicas, expansión de vegetación no nativa, sequías prolongadas y efectos del cambio climático (Halterman et al., 2015:8).
En Argentina:
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010. -
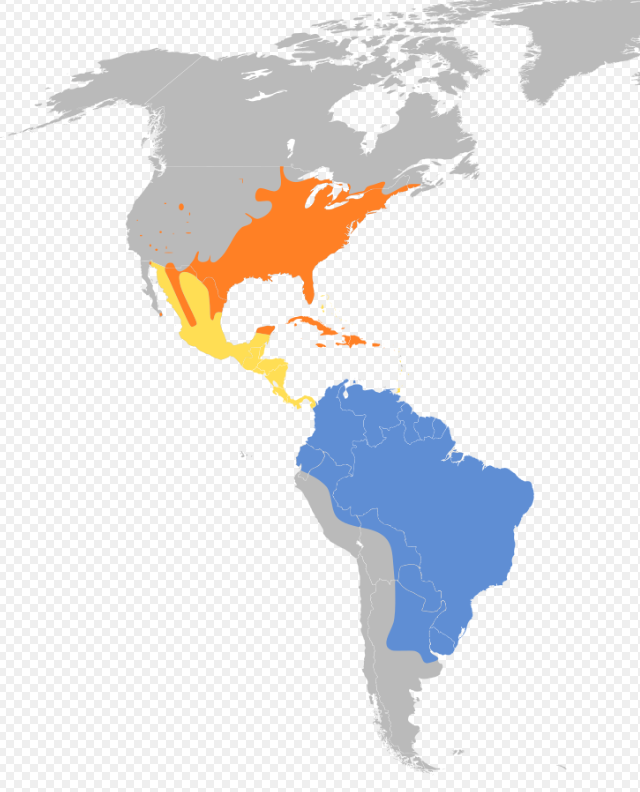
Cuclillo pico amarillo | Distribución
By Ulrich prokop – Hughes, Janice M. 1999. Yellow-billed Cuckoo (Coccyzus americanus), The Birds of North America Online (A. Poole, Ed.). Ithaca: Cornell Lab of Ornithology; Retrieved from the Birds of North America Online: http://bna.birds.cornell.edu/bna/species/418 doi:10.2173/bna.418, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=20627251  Reproducción
Reproducción Migración
Migración Invernada
InvernadaEl Cuclillo pico amarillo presenta un área de reproducción muy amplia que abarca la Norteamérica templada hasta México y las Antillas Mayores (Hughes, 2020), con posibles núcleos reproductivos en América Central y el noroeste de Sudamérica. Su distribución puede confundirse debido a la presencia de adultos no reproductores fuera de los rangos conocidos durante la época reproductiva. Según Bent (1940:54), junto con su subespecie occidental, ocupa prácticamente todo Estados Unidos y parte del sur de Canadá, siendo más común en los estados australes.
El área de invernada se concentra casi totalmente en Sudamérica al este de los Andes, con la mayoría de registros invernales (diciembre–febrero) en el sur del continente, particularmente en este de Bolivia, centro y este de Brasil, Bolivia, Paraguay, Uruguay y norte de Argentina, pero no en Chile (Stotz et al., 1992:614; Remsen et al., 1986:24; Hayes et al., 1990:955; Meyer de Schauensee, 1982:111; Rappole et al., 1983:245). Se reporta en Colombia entre septiembre y mayo (Hilty & Brown, 1986:217) y en Venezuela es de común a frecuente pero muy localizada, transitoria y rara residente invernal del norte, registrada principalmente entre finales de agosto y principios de mayo, desde el nivel del mar hasta 1.400 m, alcanzando 4.200 m al cruzar pasos montañosos (Hilty, 2002:349; Meyer de Schauensee & Phelps, 1978:111; Hilty, 2002:349). Es localmente común en Surinam (Haverschmidt & Mees, 1994:150), rara en Guyana (Tostain et al., 1992) y transitoria y muy rara en Ecuador (Ridgely & Greenfield, 2010:181). En Perú es un migrante boreal poco común entre octubre y mayo (Schulenberg et al., 2010:182). Sick (1997:387) documenta su presencia regular en Brasil durante el invierno boreal. En las Antillas Mayores se reproduce de forma poco común entre mayo y agosto y migra principalmente entre septiembre–octubre y marzo–abril (Raffaele et al., 2003:98; Buden, 1987:71).
En su hábitat reproductivo, la especie prefiere bosques abiertos con claros y vegetación baja y densa, asociados frecuentemente a cursos de agua, evitando áreas urbanas extensas (Eaton, 1988:198). En el noreste y centro de Estados Unidos y sur de Canadá utiliza bosques, tierras de labranza abandonadas, huertos cubiertos de maleza y matorrales ribereños (Johnsgard, 1979:189; Peck & James, 1983:227; Eaton, 1988:198). En el medio oeste ocupa humedales de sauces y cornejos, así como bosques sucesionales densos (Nolan, 1963:305). En el suroeste de EE.UU. selecciona bosques ribereños desérticos con sauces, álamos, alisos, nogales y mezquites (Hamilton III & Hamilton, 1965:407; Gaines, 1974:206), prefiriendo parches >81 ha (Laymon & Halterman, 1989:19). En el Caribe utiliza bosques costeros secos, ribereños y semicaducifolios (Lack, 1976; Stockton De Dod, 1978:166; Kepler & Kepler, 1978:417). En México se asocia principalmente a hábitats ribereños pero también a bosques secos arbustivos (Short, 1974:24; Howell & Webb, 1995). Binford (1989:127) lo describe como migrante transitorio en gran parte de Oaxaca.
Durante la migración, ocupa matorrales costeros, vegetación secundaria, setos, bordes de bosques y bosques húmedos de tierras bajas desde el nivel del mar hasta 2.500 m (Stiles & Skutch, 1989:184; Howell & Webb, 1995). En el noroeste de Venezuela utiliza estratos arbóreos de 5–6 m dominados por arbustos espinosos y cactus (Bosque & Lentino, 1987:268). En el oeste, sigue corredores ribereños reverdecidos tras los monzones (Wallace et al., 2013:2094).
En las áreas de invernada, prefiere vegetación leñosa cercana al agua dulce, matorrales densos, bosques caducifolios y bosques de galería hasta 1.500 m (Rappole et al., 1983:245; Stotz et al., 1996:168). En Centroamérica ocupa bosques abiertos, bosques de galería, matorrales y manglares (Ridgely & Gwynne, 1989:181; Stiles & Skutch, 1989:184). En Surinam y Guyana se asocia a manglares y hábitats ribereños (Tostain et al., 1992; Haverschmidt & Mees, 1994:150). En Venezuela se encuentra desde tierras bajas hasta zonas de páramo, con registros incluso a 4.200 m (Meyer de Schauensee & Phelps, 1978:111). En Argentina ocupa bosques, sabanas y montes (de la Peña, 2020:96).
Migra usualmente en grupos pequeños y silenciosos (Stiles & Skutch, 1989:184), aunque puede observarse en gran número en Centro y Sudamérica (Wetmore, 1968:325; Hilty & Brown, 1986:217). La migración es predominantemente nocturna (Crawford & Stevenson, 1984:202), con pérdidas corporales superiores al 50% tras travesías oceánicas. Existen indicios de nomadismo posmigratorio asociado a brotes de orugas (Hamilton & Hamilton, 1965:419; Nolan & Thompson, 1975:496; Barber et al., 2008:2678) y tras huracanes en el noreste de EE.UU. (Veit & Petersen, 1993). Los migrantes orientales llegan a las zonas de cría a finales de abril–principios de mayo, mientras que los occidentales lo hacen 4–8 semanas más tarde, desde mediados hasta finales de mayo (Franzreb & Laymon, 1993:24). En otoño, los orientales parten entre finales de septiembre y principios de octubre, y los occidentales entre finales de agosto y mediados de septiembre (Potter, 1980:25). Las poblaciones orientales migran a Sudamérica vía Centroamérica y el Caribe, siendo más frecuentes en otoño que en primavera. La ruta de los occidentales es menos conocida, aunque probablemente siga la vertiente Pacífica de México y Centroamérica hasta el noroeste de Sudamérica (Friedmann et al., 1950:132; Monroe, 1968:328). La especie migra regularmente por el sur de Estados Unidos, Centroamérica y las Antillas, con registros en Puerto Rico, Jamaica y Costa Rica (Kepler & Kepler, 1978:418; Lack, 1976; Stiles & Skutch, 1989:184). En California llega a inicios de junio.
Distribución geográfica en Argentina (de la Peña, 1999:83; de la Peña, 2020:96; de la Peña, 2016:336; de la Peña et al., 2009:106; de la Peña, 2015:302).
Coccyzus americanus (Linnaeus, 1758) migratorio de Norteamérica. Llega hasta las provincias de Buenos Aires, Catamarca, Chaco, Córdoba, Corrientes, Entre Ríos, Formosa, Jujuy, Misiones, Salta, La Rioja, Santa Fe, Santiago del Estero, Tucumán y es visitante ocasional (errante) en las Islas Malvinas.Ecorregiones: Chaco Húmedo, Chaco Seco, Espinal, Selva de Yungas, Selva Paranaense.
-
Cuclillo pico amarillo | Comportamiento
La especie exhibe un comportamiento reservado y es difícil de observar cuando está posada, evitando deliberadamente el movimiento en presencia de observadores, especialmente durante el periodo reproductivo. Suele adoptar una postura con la espalda arqueada y el cuerpo agachado, lo que le permite ocultar las partes inferiores blancas (Hamilton III & Hamilton, 1965:408). Se desplaza de manera silenciosa entre las ramas y se interna rápidamente en el follaje cuando es perturbada. Además, puede mostrar fidelidad a un punto específico de percha, al cual retorna repetidamente después de ser molestada (Slud, 1964:124). De acuerdo con de la Peña (2020:96), la especie mantiene hábitos predominantemente solitarios.
Alas largas y puntiagudas, con un batido profundo que contribuye a un vuelo rápido, directo y predominantemente horizontal, aunque este puede aparentar cierto esfuerzo. El estilo de vuelo, ágil y grácil, recuerda en parte al de los Apodidae. Durante el desplazamiento entre las ramas, el ave gira la cabeza de un lado a otro de manera frecuente, facilitando la exploración visual del entorno (Bent, 1940:62; Stiles & Skutch, 1989:184).
Se desliza silenciosamente mediante un vuelo aerodinámico, dejando ver en ocasiones sus partes inferiores blancas y las marcas blancas de la cola. Su larga cola ondula hacia atrás mientras avanza. En sus refugios sombreados mantiene un comportamiento sumamente discreto: rara vez se posa en lugares expuestos, permaneciendo inmóvil durante largos períodos dentro del follaje denso, o bien desplazándose con sigilo en busca de alimento (Bent, 1940:62).
La especie se acicala con frecuencia en perchas expuestas, actividad que también realiza durante la incubación en días cálidos (Hamilton III & Hamilton, 1965:410; Potter, 1980:19). Ha sido observada tomando el sol en mañanas estivales, a temperaturas aproximadas de 26 °C, mientras se mantiene posada en la vegetación a cierta altura. Durante esta conducta adopta una postura característica: alas extendidas y caídas, cola extendida y desviada lateralmente unos 80° respecto al eje corporal, plumas sin esponjar y pico cerrado. Puede permanecer inmóvil varios minutos o bien realizar ligeros movimientos de cabeza (Cracraft, 1964:187). Asimismo, es capaz de alternar la exposición del plumaje ventral y dorsal durante la termorregulación por insolación (Potter, 1980:19).
La especie responde al peligro adoptando una conducta críptica: suele permanecer inmóvil y luego desplazarse silenciosamente hacia la vegetación densa, orientando la espalda —cromáticamente más discreta— hacia el observador y ocultando el vientre y la garganta blancos (Hamilton III & Hamilton, 1965:408). Ambos adultos participan activamente en la defensa del nido y su entorno inmediato, incluido el árbol que lo sostiene y el suelo circundante. Frente a depredadores pequeños, como el Arrendajo azul (Cyanocitta cristata), pueden emitir llamadas fuertes tipo “Kowlp” y realizar exhibiciones de distracción (Potter, 1980:22).La respuesta defensiva varía según el tipo y número de intrusos. Ante la aproximación de un depredador grande —por ejemplo, Halcón de cola roja (Buteo jamaicensis) o víbora ratonera (Elaphe obsoleta), el adulto que incuba permanece en el nido, mientras que la pareja puede volar hacia una percha visible, bajar las alas y elevar la cola sobre el dorso como señal distractora, o bien mantenerse tranquila en las proximidades (Potter, 1980:22).
En copas cerradas, esta exhibición consiste en un descenso lento y aleteante por el árbol de nidificación, con las alas elevadas y abiertas sobre el dorso para exhibir el rufo brillante de las primarias y la cola parcialmente extendida. Tras finalizar, el adulto suele posarse a menos de 45 m del nido y emitir llamadas “Kowlp” (Hamilton III & Hamilton, 1965:415).
En hábitats de nidificación abiertos, la exhibición adopta la forma de un vuelo lento, errático y vacilante, a aproximadamente un metro del suelo, alejándose del nido mientras hace destellar las manchas blancas de la cola y las manchas rufo de las alas. Esta conducta puede tener la función de inducir al depredador a perseguir al adulto y alejarse así del nido (Hamilton III & Hamilton, 1965:415).VOCALIZACIONES(Hughes, 2020)
Las vocalizaciones son útiles para diferenciar a los cucos simpátricos. En comparación con el Coccyzus minor, la llamada más frecuente del Cuclillo pico amarillo es más aguda, menos gutural y finaliza en “kow-kow-kow” o “kowp-kowp-kowp” (Evans, 1990:79). Es también más fuerte y de mayor duración que la del Cuclillo de pico negro. A diferencia de ambos, ni el Cozzyzus minor ni el Cuclillo de pico negro (Coccyzus erythrophtalmus) terminan con un enfático “kowlp-kowlp-kowlp-kowlp”. Las llamadas del Cuclillo pico amarillo y del cuclillo de vientre blanco (Coccyzus euleri) presentan similitudes, especialmente en las sílabas finales, aunque el Cuclillo pico amarillo suele ser silencioso en sus áreas de hibernación (Hilty & Brown, 1986:217) y durante la migración.La intensidad vocal aumenta durante la formación de pareja y construcción del nido (abril–junio), continúa durante la nidificación (julio–agosto) y disminuye considerablemente tras el volantón de la última cría (Potter, 1980:24).
Las vocalizaciones —Kowlp, Knocker y Coo— pueden emitirse desde perchas altas (hasta 12 m; Hamilton III & Hamilton, 1965:409), en vuelo o al aterrizar (Bent, 1940:63).
Ya el primer día el polluelo produce un zumbido continuo de chasquidos cortos («qua-a-a-a»), similar al sonido de insectos cuando vocalizan varios pichones a la vez; es audible hasta 1,5 m. Este zumbido permanece hasta que crece el volantón, intensificándose a los 2–3 días (Hamilton III & Hamilton, 1965:417).
Demandan alimentos con un “cuk-cuk-cuk-cur-r-r-rrr”, seguido de un breve “curr” o “cuk-currrrr” tras alimentarse (Bent, 1940:58).
El pichón mayor produce un “croar” semejante al de la rana arbórea gris (Hyla versicolor).
Un día antes del emplumamiento, los pichones emiten entre 1 y 9 llamadas por minuto, tipo graznido, hasta el anochecer y nuevamente al amanecer (Potter, 1980:23).
También emiten llamadas de socorro, persistentes y ásperas «skwa-skwa-skwa-skwa-skwa» (Hughes, 2020).Se reconocen al menos seis vocalizaciones principales (Bent, 1940:63; Hamilton III & Hamilton, 1965:409; Potter, 1980:18, 23; Clark et al., 2014:142; Hughes, 2020)
1. Llamada Kowlp
Secuencia de 8–12 notas guturales similares al golpeteo de madera: “ka-ka-ka-ka-kow-kow-kowlp-kowlp-kowlp-kowlp”. Las sílabas ka son más rápidas; las kowlp, más marcadas y espaciadas. Audible a 150–200 m; algo más fuerte y gutural que la del Cuclillo de pico negro (Coccyzus erythrophtalmus). Generalmente atribuida al macho, emitida durante la búsqueda de alimento, interacciones territoriales y cortejo. Puede funcionar como mecanismo de distanciamiento entre individuos o para atraer a la hembra.2. Llamada de aldaba (Knocker Call)
Serie rápida y áspera de “kow-kow-kow-kow-kow”, similar a una aldaba metálica. Audible hasta 40 m; emitida por ambos sexos, especialmente desde el nido y perchas cercanas. Parece coordinar las actividades parentales y atraer al individuo ausente hacia la pareja.3. Llamada de arrullo (Coo Call)
Secuencias suaves de 5–11 notas repetidas durante 3–7 s, con intervalos de 7–10 s. La región gular se infla con cada nota; el pico permanece cerrado (Lámina en Hamilton III & Hamilton, 1965:413). Emitida desde perchas expuestas, incluso lejos del hábitat de nidificación. La hembra produce una “versión suave” durante el cortejo, la cual puede inducir la cópula (Wilson, 2000:535).4. Cuk-cuk Call
Rápido “cuk-cuk” emitido por el adulto al polluelo al eclosionar o al regresar al nido con alimento (Preble, 1957:476).5. Llamada Mew
Vocalización quejumbrosa emitida durante exhibiciones de distracción frente a depredadores; se intercala con llamadas de aldaba.6. Llamada de alarma
Sonido grave, similar al golpeteo de madera, sostenido mientras persista la amenaza. Común en las inmediaciones del nido o ante polluelos.ALIMENTACIÓNLa dieta consiste principalmente en insectos grandes (orugas, cigarras, saltamontes y grillos) (Nolan & Thompson, 1975:496; Laymon, 1998:4), aunque ocasionalmente incluye pequeñas ranas arborícolas (Hamilton III & Hamilton, 1965:419), así como huevos y crías de aves (Beal, 1898:11; Bent, 1940:61). El consumo de frutos y semillas es escaso durante el verano (Bent, 1940:60), pero aumenta en las áreas de invernada (Rappole et al., 1983:15). También se han registrado presas específicas como orugas “gata peluda” (Hylesia nigricans) (Zotta, 1934:383; de la Peña, 2020:96), termitas en el Chaco (Bodrati & Salvador, 2015:82) e insectos de Lepidoptera y Orthoptera (Salvador et al., 2017:47). Durante la invernada consume además invertebrados terrestres y arbóreos, como chinches asesinas (Reduviidae) y saltamontes (Tettigoniidae) (Haverschmidt & Mees, 1968:150).
En la temporada reproductiva, las áreas de alimentación de las parejas pueden solaparse. El ave se posa discretamente mientras examina la vegetación (Stiles & Skutch, 1989:184) y frecuentemente espera a que el movimiento revele a la presa (Hamilton III & Hamilton, 1965:408). Obtiene alimento principalmente espigando insectos de hojas y tallos, por lo general desde una percha, aunque también puede revolotear de forma estacionaria. Es capaz de saltar hacia ramas inferiores para luego elevarse torpemente y capturar orugas agregadas, o bien caminar por las ramas hasta alcanzarlas mediante un estiramiento (Bender, 1961:214). Asimismo, captura insectos voladores, persigue presas desde el nido, e incluso utiliza las alas para rozar el follaje y desalojar insectos; rara vez caza saltamontes desde el suelo (Laymon, 1998:3). También persigue ranas y lagartijas tanto en árboles como a nivel del suelo, picoteándolas repetidamente hasta darles muerte (Clay, 1929:190). Ocasionalmente consume huevos y polluelos de aves (Beal, 1898:11).
En verano y otoño puede ingerir frutos silvestres, moras (Rubus spp.), saúcos (Sambucus canadensis), y uvas silvestres (Vitis spp.) (Bent, 1940:60). Los recursos alimentarios varían considerablemente interanualmente, afectando el éxito reproductivo (Laymon et al., 1997). En estudios sobre provisión de alimento a crías se identificaron 2.420 presas: orugas verdes (44,9%), saltamontes (21,8%), ranas arbóreas (23,8%) y saltamontes adicionales (8,7%), además de cigarras, libélulas, mariposas, escarabajos y arañas (Laymon, 1998:3). La dieta suministrada se compone de presas enteras salvo en las primeras horas pos-eclosión, cuando se utiliza alimento regurgitado. La composición de la dieta se correlaciona con el número de huevos y con la productividad reproductiva: un tiempo de captura más corto se relaciona con un mayor número de volantones (Laymon et al., 1997). Las orugas y los saltamontes constituyen las presas preferidas, mientras que ranas y saltamontes permiten respuestas rápidas al reclamo de las crías.
Se ha observado que dos especies del género (Coccyzus americanus y C. erythropthalmus) emplean técnicas similares para capturar orugas peludas, con comportamientos agresivos principalmente por parte del Cuclillo de pico negro (Bender, 1961:214). La especie probablemente no requiere agua potable (Laymon, 1998:3). En general, los cucos se alimentan de una amplia variedad de presas, y la disponibilidad de ciertos recursos puede influir notablemente en la dinámica poblacional y el éxito reproductivo (Clay, 1929:189; Bent, 1940:59; Preble, 1957:476; Hamilton & Hamilton, 1965:419; Nolan & Thompson, 1975:496; Laymon, 1980:11; Halterman, 2009; McNeil et al., 2012:141; Halterman et al., 2015:7).
REPRODUCCIÓNLa especie presenta una larga temporada reproductiva, con variación geográfica marcada. Abarca el oeste y centro-sur de Norteamérica, extendiéndose hacia México y las Antillas Mayores (AOU 1998; Raffaele et al., 2003:98), con mayor abundancia en el centro-sur de EE. UU. (Sauer et al., 2008). Durante la temporada no reproductiva se desplaza hasta el norte de Sudamérica.
En EE. UU. comienza entre abril y agosto, retrasándose hasta junio en el norte (Hamilton III & Hamilton, 1965:427) y posponiéndose 2–12 semanas en poblaciones occidentales respecto de las orientales a igual latitud (Franzreb & Laymon, 1993:25). El inicio de la reproducción parece responder a la abundancia local de alimento (Nolan & Thompson, 1975:500) o a picos de pluviosidad (Hamilton III & Hamilton, 1965:428). En Canadá y el noreste de EE. UU., el pico reproductivo ocurre entre junio y julio, con fechas extremas de puesta que van de finales de mayo a mediados de agosto según región (Bent, 1940:66; Peck & James, 1983:227; Wenger, 2013:272; Peterjohn, 1989:104; Nolan & Thompson, 1975:498). En el centro de EE. UU. la reproducción abarca de marzo a octubre en casos excepcionales (Johnsgard, 1979:189; Pulich, 1988), mientras que en Florida y las Antillas la actividad se concentra entre abril y julio (Bent, 1940:66; Raffaele et al., 2003:98). En México se registran hembras con huevos entre mayo y julio (Sutton et al., 1950:47; Short, 1974:24).En el oeste de EE. UU., la cría se desarrolla principalmente entre junio y agosto, con picos a mediados de julio–principios de agosto; las fechas extremas de puesta varían entre mediados de mayo y finales de agosto según región (Bent, 1940:66; Howe, 1986; Groschupf, 1987; USFWS, 2013).
Puede tener “doble nidada” que ocurre en el centro y este de EE. UU., con segundas puestas iniciadas en agosto o septiembre (Sutton, 1967; Potter, 1980:25; Mengel, 1965:271). Aunque existen nidos tardíos en diversas zonas, no siempre se asocian a segundas nidadas. Algunas poblaciones occidentales parecen tener una sola puesta debido a temporadas reproductivas más cortas (Hamilton III & Hamilton, 1965:427; Laymon et al., 1997:11), mientras que en el sureste de Arizona se documentan dos e incluso tres nidadas bajo condiciones favorables (Halterman, 2009). La hipótesis de doble cría posmigratoria en el noroeste de México ha sido descartada tras análisis del estado de la placa incubatriz (Rohwer et al., 2009:19053; 2012:5; Rowher & Wood, 2013).
La formación de parejas está pobremente documentada, pero se estima que ocurre entre mayo y junio en el este y centro de EE. UU. (Johnsgard, 1979:189; Vega & Rappole, 1994:374). Se han registrado cópulas el 20 de mayo (Eaton, 1979:154), entre el 28 y el 30 de mayo (Hughes, 2020) y el 12 de junio en Puerto Rico (Kepler & Kepler, 1978:418). En poblaciones occidentales, el emparejamiento tiene lugar desde mediados de junio o más tarde (Hamilton III & Hamilton, 1965:424). Wilson (2000:535) observa “el cuclillo de pico amarillo emite vocalizaciones distintivas (“coo”) en el momento del apareamiento. Ademas, incorporan palitos al nido (entregrados por el macho durante el apareamiento). Creo que estos comportamientos sirven para fortalezer la unión de la pareja”
En cuanto a los sitios de nidificación, las parejas visitan repetidamente ubicaciones potenciales antes de iniciar la construcción (Hamilton III & Hamilton, 1965:411; Wilson, 2000:535). El microhábitat típico consiste en arboledas de frondosas caducifolias con sotobosque denso a menos de 10 m del suelo (Laymon, 1980:11). En áreas áridas, la especie se restringe a ambientes húmedos como fondos de ríos, estanques y matorrales riparios, mientras que en bosques orientales no requiere proximidad al agua debido a la humedad estival constante (Gaines & Laymon, 1984:49). En el centro y este de EE. UU. y el sur de Canadá, los nidos se asocian principalmente a robles, hayas, olmos, cornejos, espinos y fresnos, y con menor frecuencia a coníferas (Bent, 1940:55–56; Preble, 1957:476; Eaton, 1979:155).
En el oeste de EE. UU. se utilizan sauces, álamos de Fremont, mezquites, almezes, jaboneros, alisos y árboles frutales (Hanna, 1937:57; Laymon, 1980:11; Hughes, 2020). Las especies de sauce preferidas incluyen Salix gooddingii, S. laevigata y S. exigua. En el Caribe se han registrado nidos en manglares y cashaw en Jamaica (Downer & Sutton, 1990:68) y en Adelia ricinella en Puerto Rico (Kepler & Kepler, 1978:418). Los nidos pueden quedar ocultos por musgo, muérdago, roble venenoso o parras de uva (Bent, 1940:56; Hanna, 1937:57).
El cuclillo piquigualdo construye nidos desde finales de mayo hasta agosto según la región (Tejas: Hughes, 2020; Puerto Rico: Kepler & Kepler, 1978:418; Tamaulipas: Sutton et al., 1950:47).El nido, elaborado por ambos adultos, consiste en una plataforma laxa de ramitas secas y escasas fibras, ubicada típicamente en ramas horizontales o bifurcaciones a 1–6 m del suelo, aunque con variación latitudinal significativa (por ejemplo, Arkansas: 4,9–8,2 m; Ontario: 1–2 m; Peck & James, 1983:227; Arizona: hasta 13 m). Los materiales se recogen a corta distancia (≤10 m) y la construcción puede extenderse tras la puesta (Eaton, 1979:155; Bent, 1940:57). Las dimensiones del nido son variables (diámetro interior ∼12,3 cm; exterior ∼20,9 cm; Bent, 1940:57; Hamilton III & Hamilton, 1965:420; Potter, 1980:18; Hughes, 2020). Los emplazamientos presentan microclimas más frescos y húmedos que el entorno (McNeil et al., 2012:141). La reutilización intraestacional es ocasional, y se registran usos esporádicos de nidos de otras especies (Sutton, 1967; McNeil et al., 2012:109).
Pueden trabajaeen la construcción durante 1-2 h seguidas hasta completar el nido (Bent, 1940:57). La construcción continúa durante varios días tras la puesta del primer huevo. Una vez iniciada la incubación, el macho es más propenso que la hembra a añadir o reorganizar los materiales del nido (Potter, 1980:18; el adulto suele llevar ramitas cuando regresa al nido para relevar al ave incubadora (Halterman, 2009).Los huevos, elípticos a subelípticos, miden ≈30,4–31,1 × 23,0–23,4 mm (Bent, 1940:57; Schönwetter, 1967; Fleischer et al., 1985; WFVZ 2025), presentan color verde azulado pálido y cáscara delgada. El tamaño de nidada es de 1–5 huevos, generalmente 2–3 (Potter, 1980:20). La puesta ocurre cada 1–5 días y la incubación comienza con el primer huevo, durando 9–11 días (Hamilton III & Hamilton, 1965:414; Potter, 1980:20). Ambos padres incuban, con predominio nocturno del macho. Los cambios son frecuentes y suelen incluir la adición de material (Halterman, 2009).
Las crías, altriciales pero activas poco después de la eclosión, muestran un desarrollo extremadamente rápido: volantones a los 7–9 días (Potter, 1980:23; Preble, 1957). Ganan ≈4,5–4,9 g/día y rompen las vainas de las plumas hacia los 6–7 días (Preble, 1957:476; Halterman, 2009). Ambos padres alimentan; la dieta se compone principalmente de orugas e insectos, con ocasionales vertebrados pequeños (Laymon, 1980:7; Halterman, 2009). La frecuencia de alimentación aumenta con la edad del pichón, pero los últimos en eclosionar pueden recibir menos alimento y ser retirados del nido (Laymon, 1980:8).
Se registra ayuda cooperativa ocasional, con individuos adicionales incubando o alimentando (Laymon et al., 1997; Halterman, 2009). El parasitismo de nidada es principalmente intraespecífico, asociado a puestas grandes e intervalos irregulares; el parasitismo interespecífico es raro pero documentado en diversas especies (Hughes, 1997; Yasukawa, 2010:404). Los volantones se dispersan rápidamente y reciben atención parental (principalmente del macho) durante los primeros días fuera del nido (Halterman, 2009; Potter, 1980:24).
-
Cuclillo pico amarillo | Descripción

© Alan Schmierer. Yellow-billed cuckoo. Patagonia Lake, Arizona. Junio 2012. Algunos derechos reservados 
© Melissa McMasters. Yellow-billed cuckoo. Junio 2015. Algunos derechos reservados Especie sexual y estacionalmente monomórfica en el plumaje, aunque la hembra presenta un tamaño ligeramente mayor que el macho. Los individuos juveniles son similares a los adultos, pero exhiben cubiertas alares teñidas de marrón canela y un patrón caudal inferior menos definido (de la Peña, 2020:96; Ridgway, 1916:12; Bent, 1940:58; Oberholser, 1974:435; Nolan, 1975:341; Potter, 1980:18; Payne, 2005:339; Pyle, 1995:19; Hughes, 2020).
La coloración dorsal comprende corona, auriculares superiores, nuca, espalda, rabadilla y supracaudales en tonos de marrón claro con un débil lustre oliváceo; la frente y los lores son marrón grisáceo a glaucos. Las regiones suborbital y malar, junto con auriculares inferiores, garganta, pecho, vientre, flancos y subcaudales, muestran un blanco apagado suavemente sombreado de gris azulado pálido, ocasionalmente con matices beige; las cubiertas infraalares van de blanco ante a beige rosado pálido.
El pico, moderadamente largo y decurvado, presenta una punta ganchuda: la mandíbula superior es negra y la inferior amarilla a amarillo anaranjado en la base, con punta oscura. En el pichón, ambas mandíbulas son azul pizarra claro, con la punta superior blanca y la inferior negra (Preble, 1957:476). En el volantón, la mandíbula superior se torna gris oscuro, mientras que la inferior es mayormente gris claro, oscurecida hacia la punta; el patrón adulto de amarillo y negro se adquiere hacia los 60 días (Potter, 1980:24). Además, el interior del pico es rojo con matices rosados en los márgenes. La especie presenta un complejo patrón palatal formado por diversas estructuras blancas, incluyendo un disco medial en la base apical de la lengua y un par de almohadillas lenticulares provistas de espinas dirigidas posteriormente, las cuales aumentan en tamaño y número con la madurez (Preble, 1957:476).
El anillo ocular es amarillo y el iris pardo. El dorso exhibe un gris pardusco, mientras que las partes inferiores son blanco opaco, débilmente matizadas de gris azulado o beige. Las alas muestran un marrón grisáceo suave con brillo oliváceo; las remeras primarias combinan secciones externas de rufo canela apagado con puntas marrones y secciones internas de rufo brillante, configurando una extensa mancha alar rufo visible en vuelo.
La cola, larga y graduada, presenta manchas blancas prominentes: las timoneras centrales (t1) son pardas en el dorso y marrón oliva ventralmente, con puntillado oscuro; las timoneras laterales (t2–t5) son negras con brillo verdoso, tornándose marrón grisáceo hacia la base y ampliamente punteadas de blanco. Las áreas terminales blancas disminuyen progresivamente desde t5 a t2, generando seis grandes manchas ventrales visibles cuando la cola está cerrada.
Patas, zigodáctilas, azul pizarra claro en el pichón (Preble, 1957:476) y gris pizarra o plomizo en los adultos, con garras de tonalidad negro pardusca.Las poblaciones reproductoras ubicadas al oeste de la divisoria continental presentan, en promedio, un tamaño mayor que aquellas situadas al este (Ridgway, 1916:12). Además, las aves occidentales suelen exhibir una tonalidad dorsal ligeramente más grisácea, especialmente en la corona (Wetmore, 1968:325), y con mayor frecuencia muestran matices anaranjados en la porción amarilla de la mandíbula inferior (Franzreb & Laymon, 1993:26). Aunque el ADN mitocondrial difiere poco entre las poblaciones orientales y occidentales, sí se observan variaciones genéticas entre poblaciones del oeste que se encuentran geográficamente aisladas (Pruett et al., 2001:230; Farrell, 2014:169).
En términos morfológicos, se reconoce fácilmente por su silueta alargada y esbelta, así como por su distintiva cola larga, de color marrón oliva en la superficie dorsal y blanca en la zona ventral (Bent, 1940:63–64). No obstante, las dos especies del grupo presentan gran similitud, y su diferenciación requiere observar rasgos diagnósticos específicos. La mandíbula inferior amarilla solo es perceptible a corta distancia, mientras que el tono rufo de las plumas alares resulta evidente en vuelo. Asimismo, las plumas laterales de la cola, negras con amplias áreas terminales blancas, se distinguen claramente a muy poca distancia, al igual que los párpados amarillos característicos de la especie.
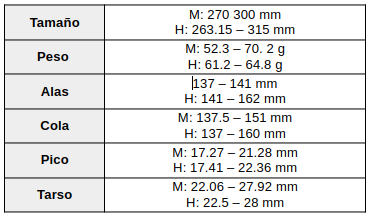
Medidas (Haverschmidt, 1968:150; Mengel, 1965:272; Grocki & Johnston, 1974:187; Hughes, 2020; del Hoyo, 2020:169).
Datos procedentes de especímenes del Museo Real de Ontario, del Museo de Zoología de la Universidad de Michigan, del Museo Bell de Historia Natural y de Ridgway (Ridgway, 1916:12). La hembra puede ser ligeramente mayor que el macho. Sin embargo, se ha observado un solapamiento sustancial en las medidas corporales entre machos y hembras; por lo tanto, el tamaño no se considera un medio fiable para diferenciar entre sexos (Halterman, 2009:7).
-
Cuclillo pico amarillo | Taxonomía
Monotípico (del Hoyo, 2020:169)
La monofilia del orden Cuculiformes se encuentra sólidamente respaldada. Este orden, relativamente poco diverso, comprende una única familia, Cuculidae, que a su vez se subdivide en cinco subfamilias (Sorenson & Payne, 1997:91; Hughes, 2020): Cuculinae (cucos típicos y malkohas), Neomorphinae (cucos terrestres del Nuevo Mundo), Crotophaginae (anis), Centropodinae (coucales) y Couinae (couas y cucos terrestres asiáticos). Dentro de esta estructura taxonómica, el género Coccyzus, que agrupa a los “cucos americanos” típicos, se integra plenamente en la subfamilia Cuculinae (Payne, 1997:91; Sorenson & Payne, 2005:91).
Dentro del género Coccyzus, compuesto por 13 especies (Banks et al., 2006:927; Hughes, 2006:483), el C. americanus se identifica como especie hermana del C. euleri (Cuclillo ceniciento) según evidencias tanto osteológicas (Hughes, 2020) como derivadas de secuencias de ADN mitocondrial (Hughes, 2006:485). Las similitudes en plumaje y morfología entre ambas especies fueron consideradas por Ridgway (1916:12) como suficientes para clasificar al C. euleri como una subespecie del C. americanus. Asimismo, el C. minor, cuya distribución abarca desde el sur de Florida y el norte de México hasta Sudamérica a través de las Antillas, constituye el linaje hermano del clado C. americanus + C. euleri (Hughes, 2006:486). -
Cuclillo pico amarillo (Coccyzus americanus)

Iconographia zoologica. Special collections University of Amsterdam. (Coccyzus americanus) Nombres comunes: Cuclillo pico amarillo (Argentina, Perú, Uruguay, Venezuela), Cuco americano (Colombia), Cuclillo piquigualdo (Costa Rica, Nicaragua), Primavera de pico amarillo (Cuba), Pájaro bobo pico amarillo (República Dominicana), Cucu pico amarillo (Honduras), Cuclillo alas rojizas (Paraguay); Ahogado, Tuyá-pucá; En guaraní: “Toutou” (de la Peña, 2020:96).
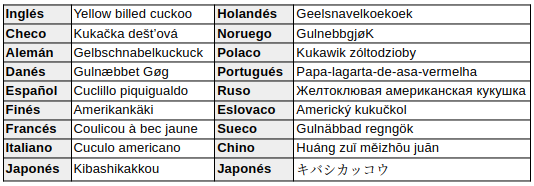
En otros idiomas:
Breves apuntes históricos:
- Histoire naturelle de la Caroline, la Floride, & les Isles Bahama. Catesby, Mark. Printed at the expence of the author in Hoxton, MDCCXXXI-MDCCXLIII [i.e. 1729-1747] Vol I: Ilustración 9 (Cuculus caroliniensis)
- Méthode contenant la division des oiseaux en ordres, sections, genres, especes & leurs variétés. Brisson, Mathurin-Jacques, Martinet, François Nicolas. Parisiis: Ad Ripam Augustinorum, apud Cl. Joannem-Baptistam Bauche, bibliopolam, ad Insigne S. Genovesae, & S. Joannis in Deserto, 1760. Vol IV: 110; Lámina IX (Coucou de S. Domingue)
- Planches enluminées d’histoire naturelle. Martinet, F.N, Buffon, G.L.L, Daubenton, Edme-Louis. Paris?: s.n.,1765-1783? Vol IX: lámina 816 (Coucou de la Caroline)
- Tableau méthodique des ordres, sous-ordres, familles, tribus, genres, sous-genres et races d’oiseaux. Lesson, R. P. , Prêtre, J. G. Bruxelles: Chez F.G. Levrault; 1831. Vol I: 142 (Piaya americana)
- Zur Ornithologie Brasiliens: Resultate von Johann Natterers Reisen in den Jahren, 1817 bis 1835. Pelzeln, August von, Natterer, Johann. Wien: A. Pichler’s Witwe & Sohn, 1871: 273 (Coccyzus bairdi)
- Tableau encyclopédique et méthodique des trois règnes de la nature. Ornithologie. Bonnaterre, abbé, Bénard, Robert, Vieillot, L. P. A Paris: Chez Mme. veuve Agasse …, 1823. pt 3:1343; Lámina CCXX (Fig.2) (Le coucou de la Caroline)
- On the natural history and classification of birds. Swainson, William. London: John Taylor, 1836-1837. Vol II: 322 (Erythrophrys carolinensis)
- Birds of America: from drawings made in the United States and their territories. Audubon, John James, Bowen, John T. New York: J. B. Chevalier, 1840-1844. Vol IV: 293-299; Ilustración 275 (Coccyzus americanus)
- The genera of birds: comprising their generic characters, a notice of the habits of each genus, and an extensive list of species referred to their several genera. Gray, George Robert, Hullmandel, Charles Joseph, Mitchell, D. W. , Hullmandel & Walton. London: Longman, Brown, Green, and Longmans, 1849. Vol II: Ilustración 115 (Fig.2) (Coccyzus americanus)
- Conspectus generum avium. Bonaparte, Ch.L. Lugduni Batavorum: Apud E. J. Brill, 1850-1857. Vol I: 112 (Coccyzus dominicus)
- Museum ornithologicum Heineanum. Cabanis, Jean Louis, Heine, Ferdinand. Halbertstadt: In Commission bei R. Frantz, 1850-1863. Vol IV: pt.1: 75 (Coccygus americanus)
- The birds of North America: the descriptions of species based chiefly on the collections in the Museum of the Smithsonian Institution. Baird, Spencer Fullerton Cassin, John, Lawrence, George N. Philadelphia :J.B. Lippincott & Co., 1860: 76-77 (Coccygus americanus)
- American ornithology. Wilson, Alexander, Baird, Spencer Fullerton, Bonaparte, Charles Lucian. Philadelphia: Porter & Coates, [1871] Atlas v1-2: lámina 28 (Fig.1) (Carolina Cuckoo)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London, 1874-98. Shelley G.E. Vol XIX: 308-309 (Coccyzus americanus)
- Argentine ornithology. A descriptive catalogue of the birds of the Argentine Republic. Sclater, P.L, Hudson, W. H. London: R. H. Porter, 1888-89. Vol II: 37 (Coccyzus americanus)