Más tranquilo que otras especies (Chébez, 2008)
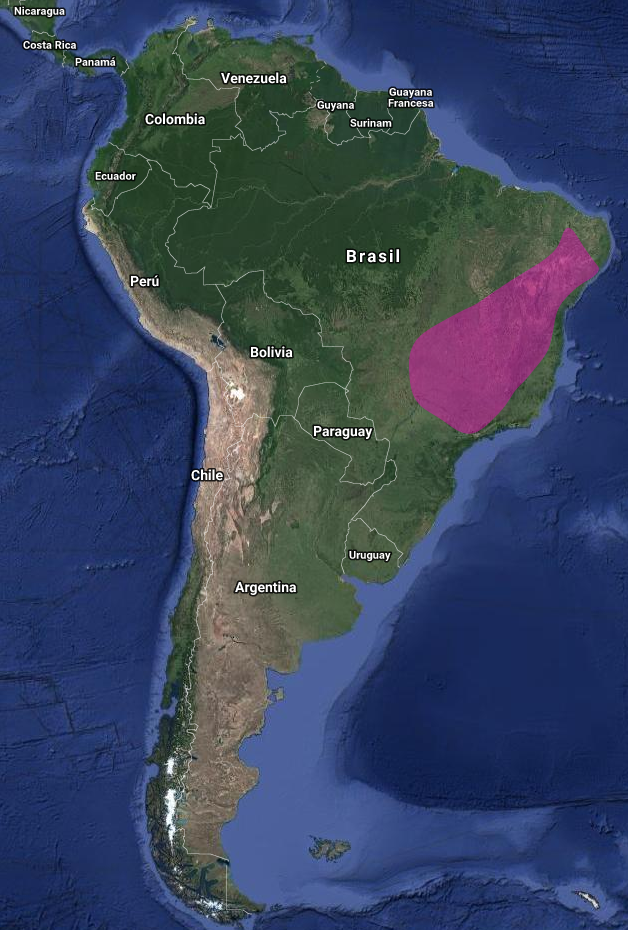
Es probable que sea principalmente sedentario con alguna dispersión local, se supone que asociada a la búsqueda de áreas más ricas en recursos florales durante periodos de escasez y a factores reproductivos (Las-Casas, Azevedo Jr. & Dias-Filho, 2012). Por ejemplo, en Chapada Diamantina, Bahía (Brasil), al C. amethystina solo se lo ve en enero-julio. La especie también se considera que es muy local y probablemente estacional al norte del Orinoco en Venezuela, con registros en Guárico únicamente desde agosto, octubre y diciembre hasta enero. Según Ruschi (1973) se estima que las poblaciones de Calliphlox amethystina que habitan el centro y nordeste de Brasil son de residencia permanente, mientras que aquellas que viven en el sudeste de ese mismo país, serían proclives a efectuar algún tipo de desplazamiento local como lo señala Ruschi (1973), aunque poco conocido como destaca Del Hoyo et al. (1999) (citado en en Castillo, Güller & Veiga, 2012: 3-4)
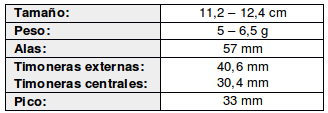
El macho tiene el batido más rápido de las alas registrado para un picaflor (cerca de 80 aleteos/s), así como como el mayor consumo metabólico conocido en vertebrados (Mobbs, 1975; Chébez, 2008)
VOCALIZACIONES
Canto: casi inaudible
Llamada: emite un extraño zumbido » Zzzzzzz» emitido al batir las alas en señal de alarma y agresión (Sick, 1997; Chébez, 2008)
ALIMENTACIÓN
Se alimenta desde el sotobosque hasta el dosel (Stotz et al., 1996). Toma néctar de una gran variedad de flores (nicho muy amplio de alimentación): Anacardium, Bowdichia, Calliandra, Canna, Cítricos, Cnidoscolus, Convolvulus, Cuphea, Delphinium, Duranta, Erythrina, Fucsia, Genipa, Grevillea, Helicteres, Hohenbergia, Humiria, Inga, Lantana, Leonurus, Mabea, Maranta, Nicotiana, Oenothera, Palicourea, Passiflora, Pavonia, Plectranthus, Psychotria, Saranthe, Stachytarpheta, Struthantus, Tacinga, Vochysia y árboles de Eucalipto introducidos. Probablemente en esta especie el néctar de especies no-ornitófilas puede funcionar como un suplemento importante en los periodos de escasez de recursos florales, sobre todo para los picaflores residentes. Al ser menos hábiles en la utilización de recursos no-ornitófilos y menos agresivos en la demarcación de sus territorios dejan el área en busca de localizaciones más ricas en recursos (Machado, Góes Coelho, Silveira Santana & Rodrigues, 2007); Los insectos son atrapados en el aire.
Dominado por la mayoría de los otros colibríes en el este Brasil, por ejemplo, Leucochloris albicollis, Hylocharis chrysura, Thalurania glaucopis, Stephanoxis lalandi, y Eupetomena macroura. No defiende territorios y frecuentemente son expulsadas por las especies dominantes (los autores correlacionaron más peso de la especie con mayor grado de dominancia). Al ser competitivamente subordinados, estas especies itinerantes se aprovechan de las brechas dejadas por otras especies actuando como oportunísticas, explorando de manera fortuita recursos no-defendidos y ocasionalmente invadiendo territorios de aves más dominantes (Rojas & Ribon, 1997; Olmos & Boulhosa, 2000; Antunes, 2003; Justino, Maruyama & Oliveira, 2012).
REPRODUCCIÓN
Anida en lugares abiertos, de noviembre a abril, al menos en Brasil. Nido en forma de copa construido con material vegetal suave de Typha, Bromeliaceae y Gramineae, unido con telarañas y decorado en el exterior con líquenes Colocado en una rama horizontal dentro de la vegetación. Puesta de dos huevos. Incubación 13-14 días. Los pichones abandonan el nido entre los 20-22 días. La hembra se encarga de la construcción del nido, incubación y cuidado de los pichones (Chébez, 2008)