- Administración de Parques Nacionales (SIB). (2025). Ficha: Coccyzus euleri; recuperado en diciembre de 2025 en https://sib.gob.ar/especies/coccyzus-euleri
- Allen, J. A. (1876). List of birds collected by Mr. Charles Linden, near Santarem, Brazil. Bulletin of the Essex Institute, 8: 78–83. (enlace)
- Allen, J. A. (1893). On a Collection of Birds from Chapada, Mato Grosso, Brazil by Herbert H. Smith. Part III. Pipridae to Rheidae. Bull. Amer. Mus. Nat. Hist., 5 (10): 107-158. (enlace)
- Avibase (s.f.). Ficha: Cuclillo ventriblanco (Coccyzus euleri, Cabanis 1873); Recuperado en diciembre 2025 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=BBA3CB9AC0CFD95D
- Banks, R. C. (1988). An old record of the Pearly-breasted Cuckoo in North America and a nomenclatural critique. Bulletin of the British Ornithologists’ Club, 108 (2): 87–91.
- Barnett, J. M. & M. Pearman (2001:45). Lista comentada de las aves argentinas. Lynx Edicions, Barcelona. 164 pp. ISBN 84-87334-32-6
- Bastos, D. F., R. A. T. Souza, J. Zina & C. A. da Rosa (2019). Seasonal and spatial variation of road-killed vertebrates on BR-330, southwest Bahia, Brazil. Oecologia Australis, 23: 388–402. (enlace)
- Bencke, G. A. (2010). New and significant bird records from Rio Grande do Sul, with comments on biogeography and conservation of the southern Brazilian avifauna. Iheringia, Serie Zoologia 100 (4): 391–402. (enlace)
- BirdLife International (2024). Species factsheet: Pearly-breasted Cuckoo Coccyzus euleri. Downloaded from https://datazone.birdlife.org/species/factsheet/pearly-breasted-cuckoo-coccyzus-euleri on 03/12/2025
- Bodrati, A. (2005). Nuevos aportes a la distribución de algunas especies de aves argentinas. Nuestras Aves, 50: 30-33. (enlace)
- Bodrati, A., Cockle, K., Matuchaka, V. & C. Maders (2007). Reserva de la Biósfera Yabotí. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 300-302. Temas de Naturaleza y Conservación 5. CD-ROM. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Bodrati, A., K. Cockle, J. M. Segovia, I. Roesler, J. I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A., J. I. Areta & E. White (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves, 57: 63-80 (enlace)
- Braun, M. J., D. W. Finch, M. B. Robbins & B. K. Schmidt (2007). A Field Checklist of the Birds of Guyana. 2nd Edition. Publication 121. Biological Diversity of the Guianas Program, National Museum of Natural History, Smithsonian Institution, Washington, DC, USA. (enlace)
- Brito, G. R. R., G. M. Kirwan, C. P. Assis, D. H. Firme, D. M. Figueira, N. Buainain & M. A. Raposo (2016). A collection of birds from Presidente Kennedy and adjacent areas, Tocantins: a further contribution to knowledge of Amazonian avifauna between the Araguaia and Tocantins Rivers. Revista Brasileira de Ornitologia, 24 (2):168–184. (enlace)
- Cabanis, J. (1873). Protokoll der XLVII Monats-Sitzung. Journal für Ornithologie 21:70–73. (enlace)
- Campos Cedeño, E. & A. C. Vallely (2015). First modern North American record and first indication of breeding by Pearly-breasted Cuckoo (Coccyzus euleri) in Panama. North American Birds, 68 (3):302–304.
- Capper, D. R., R. P. Clay, N. A. Madroño, B. J. Mazar, I. J. Burfield, E. Z. Esquivel, C. P. Kennedy, M. Perrens & R. G. Pople (2001). First records, noteworthy observations and new distributional data for birds in Paraguay. Bulletin of the British Ornithologists’ Club, 121: 23–37. (enlace)
- Carriker, M. A. (1955). Notes on the occurrence and distribution of certain species of Colombian birds. Novedadas Colombianas, 2: 48-64. (enlace)
- Cavarzere, V., L. F. Silveira, V. R. Tonetti, P. Develey, F. K. Ubaid, L. B. Regalado & L. F. A. Figueiredo (2017). Museum collections indicate bird defaunation in a biodiversity hotspot. Biota Neotropica, 17 (4): e20170404. (enlace)
- Cherrie, G. K. (1916). A contribution to the ornithology of the Orinoco region. Museum of the Brooklyn Institute of Arts and Sciences Bulletin. 2: 133–374. (enlace)
- Chébez, J. C. (1994). Los que Se Van. Especies Argentinas en Peligro. Editorial Albatros, Buenos Aires, 604 pp.
- Chébez, J. C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5. Págs. 320. L. O. L. A. Bs.Aires. 320 pp. ISBN 950-9725-20-X
- Claessens, O., F. P. Brammer, T. Deville A. Renaudier (2011). First documented records of Pearly-breasted Cuckoo Coccyzus euleri for French Guiana, and an overlooked specimen from Ecuador. Bulletin of the British Ornithologists’ Club, 131 (2): 128–133. (enlace)
- Claessens, O., M. Giraud-Audine, F. Royer & L. Sénécaux (2017). What is the breeding range and breeding season of Pearly-breasted Cuckoo Coccyzus euleri? New records and breeding in French Guiana. Bulletin of the British Ornithologists’ Club, 137 (1): 3–11. (enlace)
- Cockle, K. L., A. Bodrati, M. Lammertink, B. B. Bonaparte, C. Ferreira & F. Di Sallo (2016). Predators of bird nest in the Atlantic Forest of Argentina y Paraguay. Wilson Jour. Ornith., 128: 120-131. (enlace)
- Cohn-Haft, M., A. Whittaker & P. C. Stouffer (1997). A new look at the “species-poor” central Amazon: The avifauna north of Manaus, Brazil. Ornithological Monographs, 48: 205–235. (enlace)
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti & E. E. Utges (1990). Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Volume 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1.
- Contreras, J. R., F. Agnolin, Y. E. Davies, I. Godoy, A. Giacchino & E. Ríos (2014). Atlas ornito-geográfico de la provincia de Formosa, República Argentina. 1º Ed. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 p. (enlace)
- Contreras, J. R., F. L. Agnolin, J. C. Chébez, Y. E. Davies, I. N. Godoy & E. Ríos (MS). Atlas Ornitogeográfico de la Provincia de Misiones, República Argentina. (Inédito).
- de la Peña M. R. (1999). Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 18; 244 pp. Buenos Aires. ISSN 0328-1620
- de la Peña, M. R. (2015). Aves Argentinas. Incluye nidos y huevos. 1º Ed. Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña, M. R. & S. Salvador (2016) Aves argentinas: descripción, comportamiento, reproducción y distribución. Ciconiidae a Heliornithidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Año 2016 | Vol. 20 | N° 2 | Pág. 1-627 | ISSN 0325-3856
- de la Peña, M. R. (2020). Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución. (Actualización). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), Vol 6:1-348. ISSN 0325-3856
- De Oliveria, N. L. da S. & F. R. Dario (2018). Diversity of birds and their ecological interactions in the Mura Indigenous Territory, Brazilian Amazon Rainforest. World News of Natural Sciences, 20: 85–102. (enlace)
- del Hoyo, J. (2020). All the Birds of the World. Lynx Edicions, Barcelona. 967 pp. ISBN 978-84-16728-37-4
- Di Giacomo, A. G. (2005). Aves de la Reserva El Bagual. En Historia Natural y Paisaje de la Reserva El Bagual, Provincial de Formosa, Argentina. Inventario de la Vertebrados y de la Flora Vascular de un Area Protegida del Chaco Húmedo. Temas de Naturaleza y Conservación, 4 (A. G. Di Giacomo and S. F. Krapovickas, Editors), Aves Argentina/Asociación Ornithológica del Plata, Buenos Aires. pp. 201–465 (enlace)
- Dubs, B. (1992). Birds of Southwestern Brazil. Catalogue and Guide to the Birds of the Pantanal of Mato Grosso and its Border Areas. Bertrona Verlag, Küstnacht, Suiza, pp. 1-164, pls. 1-58. (enlace)
- eBird (2025). Pearly-breasted Cuckoo (Coccyzus euleri); https://ebird.org/species/pebcuc1?siteLanguage=es_ES
- EcoRegistros (2025). Cuclillo Ceniciento (Coccyzus euleri). Accedido de https://www.ecoregistros.org el 04/12/2025.
- Erritzøe, J., C. F. Mann, F. P. Brammer & R. A. Fuller (2012). Cuckoos of the World. Christopher Helm, London, UK.
- Esquivel, A. & S. J. Peris (2011). Aves de San Rafael. Universidad de Salamanca/Asociación Pro Cordillera San Rafael, Paraguay.
- Esquivel, A., R. Zarza, R. Tiffer-Sotomayor, A. Díaz, D. Pérez & M. Velázquez (2019). Conservation status and challenges of the Atlantic Forest birds of Paraguay. Diversity, 11: 247 (enlace)
- Fernandes-Ferreira, H., S. V. Mendonça, C. Albano, F. S. Ferreira & R. R. N. Alves (2012). Hunting, use and conservation of birds in Northeast Brazil. Biodiversity and Conservation, 21 (1): 221-244. (enlace)
- Freile, J. F., R. Ahlman, D. M. Brinkuizen, P. J. Greenfield, A. Solano-Ugalde, L. Navarrete & R. S. Ridgely (2013). Rare birds in Ecuador: First annual report of the Committee of Ecuadorian Records in Ornithology (CERO). Avances, 5 (2): B24–B41. (enlace)
- Greenway, J. C. (1978). Type specimens of birds in the American Museum of Natural History, Part 2. Bulletin of the American Museum of Natural History, 161 (1): 1‒305. (enlace)
- Griscom, L. & J. C. Greenway (1941). Birds of Lower Amazonia. Bulletin of the Museum of Comparative Zoology at Harvard College, 88: 81–344. (enlace)
- Haverschmidt, F. (1968). Birds of Suriname. Oliver & Boyd. Edinburgh and London. Tweedddale Court. Edinburgh. (enlace)
- Hellmayr, C. E. (1913). Critical notes on the types of little-known species of neotropical birds, 2. Novitates Zoologicae, 20: 227-256. (enlace)
- Hellmayr, C. E. (1929). A contribution to the ornithology of northeastern Brazil. Publications 255 – Field Museum of Natural History, Zoological Series, 12 (18): 235–501. (enlace)
- Hilty, S. L. (2003). Birds of Venezuela. (2º Ed.). Princeton University Press, Princeton, NJ, USA. ISBN 0-691-09250-8
- Hilty, S. L. & W. L. Brown (1986). A Guide to the Birds of Colombia. Princeton University Press, Princeton, NJ, USA.
- Hughes, J. M. (2006). Phylogeny of the cuckoo genus Coccyzus (Aves: Cuculidae): A test of monophyly. Systematics and Biodiversity, 4 (4): 483–488. (enlace)
- Hughes, J. M. (2022). Pearly-breasted Cuckoo (Coccyzus euleri), version 2.0. In Birds of the World (S. M. Billerman, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.pebcuc1.02
- International Commission of Zoological Nomenclature (1992). Opinion 1688. Coccyzus euleri Cabanis, 1873 (Aves, Cuculiformes): specific name conserved. Bulletin of Zoological Nomenclature, 49: 178–179. (enlace)
- Lawrence, G. N. (1864). Catalogue of birds collected at the island of Sombrero, WI, with observations by AA Julien. Annals of the lyceum of Natural History, New York, 8: 92-106. (enlace1) (enlace2)
- Madroño A. N., R. P. Clay, M. B. Robbins, N. H. Rice, R. C. Faucett & J. C. Lowen (1997). An avifaunal survey of the vanishing interior Atlantic forest of San Rafael National Park, Departments Itapúa/Caazapá, Paraguay. Cotinga, 7: 45–53.
- Magalhães, J. C. R. (1999). As Aves na Fazenda Barreiro Rico. Plêiade, São Paulo. 215 pp.
- Mahler, I.K.F., A. E. Glayson & G. N. Mauricio (2005). A avifauna do Parque Estadual do Turvo, Río Grande do Sul. XI Reunión Argentina de Ornitología, pp. 123. Presentación Oral. (página 130 pdf) (enlace)
- Mallet-Rodrigues, F., R. Parrini & B. Rennó (2015). Bird species richness and composition along three elevational gradients in southeastern Brazil. Atualidades Ornitológicas, 188: 39–58. (enlace)
- Meyer de Schauensee, R. (1970). A Guide to Birds of South America. Academy of Natural Sciences, Philadelphia, Pennsylvania, USA. (enlace)
- Morante-Filho, J. C., D. Faria, E. Mariano-Neto & J. Rhodes (2015). Birds in anthropogenic landscapes: The responses of ecological groups to forest loss in the Brazilian Atlantic forest. PLOS ONE 10(6):e0128923 (enlace)
- Moschione, F. & L. Bishels (2005). Listado de las aves del parque Provincial Loro hablador, Provincia del Chaco. Informe técnico proyecto Elé/DFS.
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. ISBN 950-99063-6-0
- Olrog, C. Ch. (1979). Nueva Lista de la Avifauna Argentina. Ópera Lilloana XXVII. Ministerio de Cultura y Educación. Fundación Miguel Lillo. Tucumán, Argentina. 324 pp. ISSN 0078-5245
- Partridge, W. H. (1961). Aves de Misiones nuevas para la Argentina. Neotrópica, 7 (22): 25-28.
- Payne, R. B. (2005). The Cuckoos. Oxford University Press, Oxford, UK.
- Peters, J. L. (1940). Check-list of Birds of the World. Volume 4. Harvard University Press, Cambridge, MA, USA. (enlace)
- Pimentel, L.& F. Olmos (2010). The birds of Reserva Ecológica Guapiaçu (REGUA), Rio de Janeiro, Brazil. Cotinga, 33: 6–22.
- Pinheiro, R. T., T. Dornas, E. Santos Reis, M. O. Barbosa & D. Rodello (2008). Birds of the urban area of Palmas, TO: composition and conservation. Revista Brasileira de Ornitologia, 16 (4): 339-347. (enlace)
- Pinto, O. M. O. (1978). Novo Catálogo das Aves do Brasil. Primeira parte. Aves não Passeriformes e Passeriformes não Oscines, com exclusão da família Tyrannidae. Conselho Nacional de Desenvolvimento Científico e Tecnológico, São Paulo, Brazil. (enlace)
- Planqué, R., Vellinga, W. P., Pieterse, S., Jongsma J. & R. de By (Xeno-canto Foundation). Ficha: Cuclillo ventriblanco (Coccyzus euleri, Cabanis 1873); Recuperado en diciembre 2025 de https://xeno-canto.org/species/Coccyzus-euleri
- Remsen, J. V. & M. A. Traylor (1989). An Annotated List of the Birds of Bolivia. Buteo Books, Vermillion, SD, USA.
- Remsen, J. V., Jr., M. A. Traylor & K. C. Parkes (1986). Range extensions of some Bolivian birds, 2 (Columbidae to Rhinocryptidae). Bulletin of the British Ornithologists’ Club, 106 (1): 22–32. (enlace)
- Restall, R., C. Rodner & M. Lentino (2006). Birds of Northern South America: An Identification Guide. Christopher Helm, London, UK.
- Ridgely, R. S. & P. J. Greenfield (2001). The Birds of Ecuador. Volumes 1 and 2. Cornell University Press, Ithaca, NY, USA. 1584 pp. ISBN 9780713661613
- Ridgley, R. S., D. Agro & L. Joseph (2005). Birds of the Iwokrama Forest. Proceedings of the Academy of Sciences of Philadelphia, 154: 109–121. (enlace)
- Ridgway, R. (1916). The Birds of North and Middle America. Part 7. United States National Museum Bulletin 50. (enlace)
- Saibene, C. A., Castelino, M. A., Rey, N. R., Herrera, J. & J. Calo (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina. Monografía, 9. Ed. L.O.L.A. Literature of Latin America, Buenos Aires. 68 pp. ISSN 0328-1620
- Samuels, I, P. Bichier, J. Clark, T. Milleron & B. O’Shea (2014). Noteworthy records and range extensions from the Caura River watershed, Bolívar state, Venezuela. Cotinga, 36: 27–39.
- Santos, F. C. V, W. M. S. Souto, A. S. N. Ribeiro, R. F. P. de Lucena & A. Guzzi (2020). Traditional knowledge and perception of birds in the Paranaíba delta environmental protection area, Northeast Brazil. Acta Scientiarum Biological Sciences, 42: e47722. (enlace)
- Sclater, P. L. & G. E. Shelley (1891) Catalogue of the birds of the British Museum. Volume 19. British Museum (Natural History), London, United Kingdom. (enlace)
- Short, L. L. (1984). Priorities in ornithology: the urgent need for tropical research and researchers. The Auk, 101 (4): 27. (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brazil. 912 pp. ISBN 85-209-0816-0
- Smith, P., & R. P. Clay (2015). New and noteworthy bird records from “Área de Reserva para Parque Nacional” San Rafael. Paraquaria Natural, 3: 22–26. (enlace)
- Spaans, A. L., O. H. Ottema & J. J. M. Ribot (2018). Field Guide to the Birds of Suriname. Brill, Leiden, The Netherlands.
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker & D. K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA.
- Strewe, R. & C. Navarro (2004). New and noteworthy records of birds from the Sierra Nevada de Santa Marta region, north-eastern Colombia. Bulletin of the British Ornithologists’ Club, 124 (1): 38–51. (enlace)
- Tonetti, V. R., M. A. Rego, A. C. De Luca, P. F. Develey, F. Schunck & L. F. Silveira (2017). Historical knowledge, richness and relative representativeness of the avifauna of the largest native urban rainforest in the world. Zoologia, 34: e13728. (enlace)
- Vidoz, J. Q., A. E. Jahn & A. M. Mamani (2010). The avifauna of Estación Biológica Caparú, Bolivia. Cotinga, 32: 51–68. (enlace)
- Vitorino, B. D., A. V. B. Frota, S. K. I. Castrillon & J. R. S. Nunes (2018). Birds of Estação Ecológica da Serra das Araras, state of Mato Grosso, Brazil: Additions and review. Check List, 14: 893–922. (enlace)
- Willis, E. O. & Y. Oniki (1990:). Coccyzus euleri (Cabanis, 1873 (Aves, Cuculiformes): proposed conservation of the specific name. The Bulletin of Zoological Nomenclature, 47: 195-197. (enlace)
-
-
Cuclillo ceniciento | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOREl Cuclillo ceniciento (Coccyzus euleri) es considerado una especie poco común o rara en la mayor parte de su área de distribución. Su abundancia real sigue siendo insuficientemente conocida, debido tanto a su similitud con el migratorio Coccyzus americanus como a su conducta esquiva y la dificultad de su detección. Además, sus poblaciones pueden experimentar fluctuaciones interanuales asociadas, posiblemente, a la disponibilidad estacional de presas. Aunque la especie está catalogada oficialmente como estable, depende de biomas forestales altamente amenazados, por lo que su situación podría ser más vulnerable de lo que actualmente se reconoce. El tamaño global de la población no ha sido cuantificado, pero se describe a esta especie como “rara” (Stotz y col. 1996).
En Argentina:
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1º ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010. -
Cuclillo ceniciento | Distribución
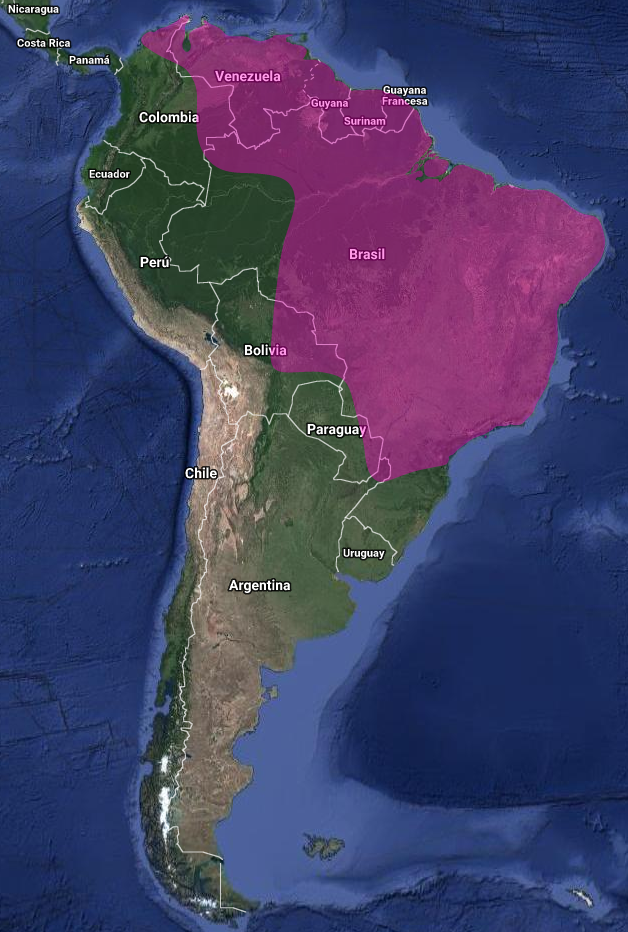
InfoNatura: Animals and Ecosystems of Latin America 2007 El Cuclillo ceniciento (Coccyzus euleri) se distribuye principalmente en Sudamérica al este de los Andes; sin embargo, persisten lagunas importantes respecto de su área reproductiva y su distribución estacional. Esta incertidumbre deriva, en parte, de su marcada similitud morfológica con el Coccyzus americanus (Cuclillo de pico amarillo), especie que también se presenta en el norte y centro de Sudamérica durante la migración boreal y el invierno (Hughes, 2020). La confusión histórica se intensifica por el hecho de que el C. euleri fue considerado durante mucho tiempo una subespecie del C. americanus, lo que vuelve poco informativos numerosos registros antiguos (Erritzøe et al., 2012:295; Barnett & Pearman, 2001:45).
La distribución del C. euleri continúa siendo muy deficiente y sujeta a interpretaciones contradictorias. La propuesta clásica de Meyer De Schauensee (1971:112) que incluye Guyana (Braun et al., 2007:14), Surinam, Venezuela (Mérida, norte de Bolívar y Amazonas), el este de Colombia hasta Cartagena, y el este de Brasil desde Pará hasta Río de Janeiro y Mato Grosso, así como la provincia argentina de Misiones, resulta de extrapolaciones basadas en apariciones esporádicas, sin considerar que la especie alcanza algunas de estas regiones sólo de manera ocasional. Así, en Colombia ha sido sugerida como un probable migrante austral (Hilty & Brown, 1986:217); en Surinam es un migrante poco común entre julio y septiembre, conocido sólo por tres ejemplares históricos (Spaans et al., 2018, citado en Hughes, 2022). Se la describe como “…a rare bird, perhaps only a migrant…” (Haverschmidt, 1968:150); y en Venezuela su presencia es muy localizada, restringida a pocas áreas geográficas y sin claridad sobre su residencia (Meyer De Schauensee & Phelps, 1978:111; Hilty, 2003:350; Payne, 2005:346). En este país se la considera errática y local, con fluctuaciones marcadas en la abundancia interanual, posiblemente relacionadas con brotes de orugas (P. Schwartz).
En Brasil, Sick (1986:319) proporciona información imprecisa “…Rio de Janeiro, Paraná, Mato Grosso, etc…”; en realidad, para Mato Grosso el único antecedente es el registro histórico de Allen (1893), no confirmado posteriormente (Dubs, 1992:47). Pinto (1978:155) ofrece datos puntuales para el Brasil central (Mato Grosso) y oriental (Pará a Paraná), sugiriendo cierta continuidad poblacional en el centro-este del país. Es probable que algunas de las poblaciones dispersas de Venezuela y del centro-este de Brasil sean reproductivas, y que la especie exhiba un grado elevado de trashumancia. Este patrón, sumado a la escasez de observaciones y colecciones en un subcontinente con baja densidad de ornitólogos (Short, 1984:892), dificulta la construcción de un marco biogeográfico coherente.
Los registros específicos disponibles refuerzan este carácter fragmentario. En Colombia se la considera rara en el norte y oriente hasta los 400 m (enero), con observaciones en la costa caribeña cerca de Cartagena, en el sureste de Guainía a lo largo del Río Negro (Macacuní; Hilty & Brown, 1986:217), y en mayo en el Parque Nacional Tayrona, Neguanje y la Reserva Natural Los Besotes (Strewe & Navarro, 2004:41). En Venezuela se documenta de manera errática en Mérida, Distrito Federal (San José de Los Caracas), sureste de Apure (Puerto Páez), norte de Bolívar (Caicara, alto Río Caura, Ciudad Bolívar, Upata, Guasipati) y oeste de Amazonas (Caño Cuao, El Carmen), además de Isla Margarita (Hilty, 2003:350), con registros adicionales en el río Nichare (abril) y el bajo Caroní cerca de Santa Elena (Samuels et al., 2014, citado en Hughes, 2022).
En la Guayana Francesa la especie es rara, con ocho registros que totalizan trece individuos entre 2009 y 2015, principalmente en agosto y septiembre (Claessens et al., 2011:129; Claessens et al., 2017:4). En Ecuador se ha consignado como migrante poco común (marzo; Payne, 2005:346; Freile et al., 2013:B34; Ridgely & Greenfield, 2001).
En Brasil, aunque generalmente rara, podría ser poco común en regiones meridionales (Claessens et al., 2017:7; Payne, 2005:346; De Oliveira et al., 2018:99; Brito et al., 2016:179; Pinheiro et al., 2008:343; Morante-Filho et al., 2015:7; Vitorino et al., 2018:903; Cavarzere et al., 2017:8; Tonetti et al., 2017:12; Pimentel & Olmos, 2010:6; Bencke, 2010; Erritzøe et al., 2012:295).
En Bolivia aparece como migrante poco común en abril, mayo y octubre (Payne, 2005:346; Vidoz & Mamani, 2010; Remsen et al., 1986:25; Remsen & Traylor, 1989). Finalmente, en Paraguay constituye un visitante estival raro entre octubre y noviembre (Esquível & Peris, 2011; Esquível et al., 2019:15; Smith & Clay, 2015:24; Capper et al., 2001:28; Payne, 2005:346).
Se conocen dos registros de C. euleri fuera de su distribución típica en Sudamérica. El primero corresponde a un espécimen inmaduro recolectado en octubre de 1863 en la isla Sombrero, ubicada al este de las Islas Vírgenes y al noroeste de Anguila, en el punto más septentrional de las Antillas Menores (Banks, 1988:90). Este individuo, curiosamente, constituye el espécimen tipo (descrito inicialmente como Coccyzus julieni y posteriormente asignado a Coccyzus euleri, a pesar de proceder de una localidad claramente extralimital. Su hallazgo dio origen a una prolongada controversia sobre la nomenclatura y la distribución geográfica de la especie. El segundo registro corresponde a la observación de una pareja en reproducción en julio en el Lago Bayano, Panamá (Campos-Cedeño & Vallely, 2015, en Hughes, 2022). No obstante, dos supuestos avistamientos adicionales en el centro de Panamá, en junio de 2007 y junio de 2009, fueron rechazados por el Comité de Registros de Panamá (D. Montañez y G. Berguido in litt., en Claessens et al., 2011).
Distribución geográfica en ARGENTINA (de la Peña, 2020:99; de la Peña & Salvador, 2016:338; de la Peña, 2015:303) (de la Peña, 1999:84; EcoRegistros 20 registros en en https://www.ecoregistros.org/ficha/Coccyzus-euleri; eBird 2025, en https://ebird.org/species/pebcuc1/AR-N)
En Argentina, el estatus local de conservación del Coccyzus euleri permanece indefinido (Contreras et al., 2014:281). Es posible que la intensificación reciente de los esfuerzos de observación esté revelando una presencia más frecuente de la especie. No obstante, su situación general podría evidenciar una disminución numérica y cierta retracción areal en sus movimientos migratorios, como sugiere la casi desaparición de la población migrante en Misiones (Contreras et al., Msc), aunque ejemplares han vuelto a registrarse en el Parque Nacional Iguazú (Chébez, 1994:426). Asimismo, la especie ha sido documentada en el Chaco argentino (Bodrati, 2005:31).
Contreras (1990:119) destaca que “…su presencia en el norte argentino, el Paraguay y Bolivia es más probable que lo que los presentes registros hacen suponer. La falta de prospección sistemática y de larga duración y la escasez de estudios regionales no permite, en la región de probable aparición de la especie, especulaciones acerca de su posible presencia.”. En este sentido, la objeción planteada por Chébez (1994:426) respecto de la observación de Canzioni (en Contreras, 1990:119) resulta poco sostenible, ya que presupone una fijación estricta al hábitat que no se ajusta al comportamiento real de la especie. El registro boliviano (Remsen, 1986:25), por ejemplo, procede de un ambiente muy diferente al de Misiones.
Más recientemente, su presencia ha sido confirmada en el Parque Estadual do Turvo (Mahler et al., 2005, en Hughes, 2022), mientras que los registros del estado de Paraná son los únicos claramente afines a los de Misiones.
Ecorregiones: Selva Paranaense y Chaco húmedo (Barnett & Pearman, 2001:45)
Citas y observaciones en las provincias de: Chaco, Formosa, Misiones y Santiago del Estero. (Tablas de coordenadas, referencias y comentarios)
HÁBITAT
El Coccyzus euleri se reproduce principalmente en bosques húmedos siempreverdes, bosques de galería y bosques secundarios. Durante la invernada en la Amazonia, utiliza bosques primarios de tierra firme y bosques ribereños dominados por el Ambay (Cecropia). Ocurre típicamente desde el nivel del mar hasta los 900 msnm de altitud (Erritzøe et al., 2012:296).
En Colombia y Venezuela se registra en bosques arenosos, matorrales y bosques de galería (Hilty & Brown, 1986:217); adicionalmente, en Colombia ocupa bosques secos tropicales (Strewe & Navarro, 2004:41) y en Venezuela bosques secundarios (Samuels et al., 2014). En esta última región se encuentra desde los 700 msnm al norte del Orinoco hasta los 350 msnm al sur del río (Hilty, 2003:350).
En Guyana utiliza bosques de tierras bajas (Braun et al., 2007:14), mientras que en Surinam emplea bordes costeros de manglar y bosques de sabana (Spaans et al., 2018, en Hughes, 2022). En la Guayana Francesa ocupa bosques primarios de dosel alto y bordes de bosque, así como bosques secundarios densos de dosel bajo y arboledas de tierras bajas (Claessens et al., 2017:5). En Bolivia ha sido registrada en hábitats de sabana (Vidoz et al., 2010) y en Ecuador en formaciones secundarias de borde (Freile et al., 2013:B24).
En Brasil utiliza el bosque primario de «terra firme» (Cohn-Haft et al., 1997) y el bosque estacional semideciduo (Vitorino et al., 2018:903). Generalmente se distribuye en altitudes de hasta 900 msnm, pero existe un registro en Itatiaia a 1.200 msnm (Mallet-Rodrigues et al., 2015:48). También emplea el bosque atlántico costero del sureste de Brasil, el este de Paraguay y el noreste de Argentina (Madroño et al., 1997). En Panamá se ha observado en bosques latifoliados secundarios (Campos-Cedeño & Vallely, 2015, en Hughes, 2022).
Información adicional señala su presencia en “…capoeira…” (Sick, 1997:387) y en ambientes típicos de la Chapada dos Guimarâes descritos como “…planalto…» de 700 a 800 metros acima do nível do mar, com matas ciliares nos vales e cerrados ou campos com buritis (Mauritia flexousa L.) nos planaltos…” (Willis & Oniki, 1990:21; véase también Allen, 1893 en Contreras, 1990:119). Contreras (1990:119) agrega que en Colombia puede ocupar matorrales y selvas ribereñas.
En Argentina se ha citado en selvas y bosques de transición (de la Peña, 2020:98).
Movimientos y migración
Los movimientos estacionales del Coccyzus euleri son poco conocidos. La especie es, al menos parcialmente, un migrante austral: algunos individuos se reproducen en el sur y el este de Brasil, el norte de Argentina y Paraguay durante el verano austral, y migran luego hacia el norte de Sudamérica en la estación no reproductiva. No obstante, los registros de reproducción al norte del Ecuador y en Panamá, entre enero y agosto, sugieren que ciertas poblaciones septentrionales podrían ser no migratorias (Payne, 2005:346; Claessens et al., 2017:3; Erritzøe et al., 2012:296).
Diversos autores subrayan que es un cuclillo sudamericano poco conocido y aparentemente raro. La posible confusión con el migrante boreal C. americanus, la escasez de registros confiables al norte del Amazonas y el comportamiento esquivo de esta especie forestal dificultan la delimitación precisa de su área de reproducción y su estatus en el norte de Sudamérica. En consecuencia, se la considera preferentemente un migrante austral que se reproduce principalmente en el sur y este de Brasil, el norte de Argentina y Paraguay, y migra posteriormente a la región septentrional del continente (Payne, 2005:346; Claessens et al., 2011:128; Erritzøe et al., 2012:290).
-
Cuclillo ceniciento | Comportamiento
El Cuclillo ceniciento se caracteriza por su comportamiento discreto y esquivo, permaneciendo con frecuencia oculto entre la vegetación (Erritzøe et al., 2012:295), razón por la cual puede pasar fácilmente desapercibido. Un individuo observado forrajeando tranquilamente junto a una pequeña bandada mixta en un bosque seco cercano a Bolívar, Venezuela, permaneció inmóvil entre el follaje durante aproximadamente un minuto antes de emprender un vuelo repentino tras un movimiento ascendente de la cola (Hilty, 2003:350). La especie es típicamente solitaria, aunque ocasionalmente puede registrarse en parejas.
Si bien no suele considerarse una especie particularmente social, ha sido observada integrando bandadas mixtas activas en el dosel en Manaus, Brasil (Cohn-Haft et al., 1997:215), en las proximidades de Bolívar, Venezuela (Hilty, 2003:350), y en Kourou, Guayana Francesa, donde se encontraba asociada con Cotinga cotinga (Cotinga pechimorada), Xipholena punicea (Cotinga púrpura), Polioptila guianensis (Perlita guayanesa) y Cyanicterus cyanicterus (Frutero lamiazul; Claessens et al., 2017:4).
No se ha documentado directamente la depredación de nidos; sin embargo, la pérdida de un nido en la Guayana Francesa podría atribuirse a la acción de un grupo de monos ardilla comunes (Saimiri sciureus), que se encontraban activos en el área en ese momento (Claessens et al., 2017:8).
VOCALIZACIONESEmite temprano por la mañana durante pocos minutos o en forma muy esporádica hasta las primeras horas de la tarde, siendo esta actividad notable durante pocos días entre los meses de octubre y noviembre
El canto primario del Cuclillo ceniciento, conocido como «Kuoup Call», consiste en una serie de notas fuertes, ásperas y de timbre semejante al de una rana, generalmente entre 5 y 15 emisiones, aunque en ocasiones supera las 20. Estas notas, que suelen producirse a un ritmo aproximado de una por segundo y con desaceleración hacia el final de la secuencia (Hilty, 2003:350), recuerdan a las notas terminales lentas del Cuclillo pico amarillo (Coccyzus americanus); sin embargo, esta última especie es típicamente silenciosa en sus áreas de invernada sudamericanas (Claessens et al., 2017:3). De manera complementaria, la especie emite una llamada de tipo cascabel ascendente, seguida de 4 a 9 notas acentuadas («tuctuctuctuc, tówlp»), similares a las de C. americanus (Hilty & Brown, 1986:217). Aunque el Tingazú (Piaya cayana) también produce un sonido de cascabeleo, carece de las notas terminales acentuadas (Bencke, 2010). El «rattle call» es menos frecuente que el «Kuoup Call» (Hilty & Brown, 1986:217).
Según Claessens et al. (2017:5), antes del inicio de la incubación se registran dos vocalizaciones principales: el canto, emitido por ambos sexos, y la llamada de cascabel, interpretada como señal de contacto o agresión, pues suele generarse en respuesta a la reproducción de vocalizaciones (playback), más que como señal de alarma. La actividad vocal es intensa durante el cortejo y la construcción del nido, pero disminuye marcadamente al comenzar la incubación (Claessens et al., 2017:5). Adicionalmente, responde de manera activa al playback, prolongando su actividad vocal y emitiendo particularmente la llamada de cascabel (Freile et al., 2013:B24; Claessens et al., 2017:4).
Asimismo, se han documentado interacciones vocales entre individuos: en la Guayana Francesa, un miembro de una pareja emitió el «Kuoup Call», mientras el otro respondió con la llamada de cascabel desde una percha ubicada a 5–6 m de altura (Claessens et al., 2017:4). Entre otras descripciones tempranas, Sick (1997:381) caracterizó la voz como ventrílocua (“kjoa”)
ALIMENTACIÓNLa información disponible acerca de la dieta del Cuclillo ceniciento es relativamente limitada. Sin embargo, al igual que muchas especies de la familia Cuculidae, es fundamentalmente insectívoro. Consume diversos invertebrados, con una clara preferencia por las orugas, y busca alimento principalmente en el dosel medio y superior del bosque, así como en zonas de borde forestal (Erritzøe et al., 2012:295). Su comportamiento alimentario es predominantemente solitario, aunque ocasionalmente puede integrarse en bandadas mixtas de especies (Erritzøe et al., 2012:295). En Brasil, se observó un individuo capturando una oruga cuya longitud era aproximadamente 1,5 veces la de su pico (Bencke, 2010).
REPRODUCCIÓNLa distribución reproductiva y los movimientos estacionales del Cuclillo ceniciento permanecen insuficientemente documentados. Tradicionalmente se pensaba que era una especie exclusivamente migratoria, que anidaba en el sur y este de Brasil, el norte de Argentina y Paraguay durante el verano austral, e invernaba al norte del ecuador, desde Colombia hasta la Guayana Francesa. No obstante, registros de reproducción en Colombia (Carriker, 1955:52), Venezuela (Claessens, 2017:7; Cherrie, 1916:311; Erritzøe et al., 2012:296), Guayana Francesa, el norte de Brasil (Claessens, 2017:7; Payne, 2005:346) y Panamá (Campos-Cedeño & Vallely, 2015, citado en Hughes, 2022) entre enero y agosto cuestionan esta interpretación y sugieren que las poblaciones septentrionales podrían ser residentes (Claessens, 2017:10).
El estudio de los registros reproductivos revela dos áreas de reproducción disyuntas: una en el sur de Sudamérica (sur de Brasil, Paraguay -Capper et al., 2001:28- y Argentina) y otra en el norte (este de Panamá, norte de Colombia, Venezuela, extremo norte de Brasil y las Guayanas), con más de la mitad de los registros al norte del ecuador. Resulta notable que la especie haya pasado inadvertida en regiones con comunidades ornitológicas consolidadas, como la Guayana Francesa, donde los primeros registros datan de 2009 (Claessens et al., 2011; Claessens, 2017:7) y Venezuela, donde se considera vagabunda (Hilty, 2003:350). En la Guayana Francesa, los registros confirmados (9 de agosto – 17 de septiembre) coinciden con la condición de migrante austral, lo que respalda la hipótesis de reproducción ocasional fuera del área típica, como sugiere también el registro en Roraima. La abundancia inusualmente alta en 2013 podría indicar una irrupción excepcional que facilitó la reproducción oportunista (Claessens, 2017)
En Argentina, la nidificación ha sido confirmada en Misiones en varias ocasiones. De la Peña (2020:98) menciona nidos localizados en la provincia y señala que la reproducción ocurre en octubre y noviembre. Partridge (1961:25) registró ejemplares con huevos listos para la puesta y testículos activos entre octubre y diciembre en arroyo Urugua-í. Otros nidos fueron documentados en el Parque Nacional Iguazú (Pearman en Bodrati et al., 2012:66), en Posada y Reserva Puerto Bemberg (Bodrati et al., 2012:65) y en el Parque Provincial Cruce Caballero, donde Cockle et al. (2016:122) observaron el 23 de noviembre de 2011 un evento de depredación: un Ramphastos dicolorus espantó a un adulto de C. euleri de un nido en copa situado a ~20 m en un Cedro blanco (Cedrella fissilis) consumiendo al menos un huevo antes de retirarse. El adulto regresó al nido pocos segundos después.
El comportamiento reproductor, incluida la incubación y el cuidado parental, ha sido escasamente observado. La especie es probablemente monógama. Se ha descrito cortejo con alimentación previa a la cópula: el macho ofrece una oruga, la hembra adopta una postura sumisa y posteriormente copulan, aunque no siempre se confirma la aceptación del alimento. La cópula ocurre a veces cerca del nido (≈10 m) y puede ser inducida también por la presentación de material de nidificación (Capper et al., 2001:28; Claessens, 2017:5). Llamativamente, se ha registrado cópula durante la estación no reproductiva tras la reproducción de vocalizaciones (playback), lo que podría indicar una defensa de pareja frente a un rival percibido (R. Czaban in litt. 2014; M. Cohn-Haft in litt. 2014 en Claessens, 2017:9). Este comportamiento sugiere emparejamientos durante la migración o la invernada, fenómeno no descrito previamente en los Cuculidae (Claessens, 2017:9).
Los nidos activos rara vez se detectan debido a su ubicación en vegetación densa (Claessens, 2017:5). Se han registrado entre 3 y 7 m de altura en un Ceibo Erythrina crista-galli en Argentina y en un Palo mulato (Bursera simaruba) en Panamá. En la Guayana Francesa, un nido fue hallado cerca de la punta de una rama horizontal a ~10 m de altura, oculto por lianas y protegido por un sotobosque de palmeras espinosas; el dosel circundante no superaba los 15 m. Un segundo nido, atípico, se ubicó en un bosque bajo (~10 m) sobre una barra arenosa rodeada de manglares, sabanas pantanosas y áreas cultivadas, a menos de 250 m del borde de la sabana (Claessens, 2017:5).
Ambos sexos participan en la construcción del nido. En la Guayana Francesa, el macho recolectó materiales —ramitas, lianas muertas, filamentos similares a hierba, musgo y una hoja seca— y los entregó a la hembra, siguiendo rutas discretas entre el follaje (Claessens, 2017:5).
El nido consiste típicamente en una plataforma suelta de palos delgados, similar al nido del Cuclillo pico amarillo (Campos-Cedeño & Vallely, 2015, citado en Hughes 2022).
Los huevos son elípticos, verde azulado pálido, y la puesta probablemente en número de 2 a 4 (Payne, 2005:347). Se desconoce la duración del periodo de incubación, aunque podría asemejarse a la de otros Coccyzus (9–12 días), con incubación iniciada desde la puesta del primer huevo y eclosión asincrónica. La incubación podría no ser biparental: en un nido de la Guayana Francesa solo se observó a la hembra incubando durante cinco días, adoptando una postura característica con el pecho dentro del nido y la cola elevada; el nido fue abandonado siete días después, posiblemente por depredación (Claessens, 2017:8).
A diferencia de numerosos Cuculidae, el C. euleri no es un parásito de cría obligado, aunque se requieren más estudios para confirmar plenamente este aspecto.
-
Cuclillo ceniciento | Descripción

© Animalia.Bio. Cuclillo ventriblanco. Algunos derechos reservados Según los autores (Hughes, 2022; Payne, 2005:345; Erritzøe et al., 2012:295; Hilty, 2003:350; Hilty & Brown, 1986:217; Brito et al., 2016:179)
La especie es sexual y estacionalmente monomórfica.
Adulto: Las partes superiores presentan un tono marrón grisáceo uniforme, con un ligero brillo bronceado. La región facial muestra un gris más oscuro por encima y detrás del ojo, lo que confiere una apariencia semejante a una máscara. El iris varía de marrón a negro. El anillo ocular es gris a negro en la hembra adulta, aunque ocasionalmente puede ser amarillo o rojo.
El pico moderadamente largo y decurvado con la punta ganchuda. El maxilar (mandíbula superior) es predominantemente marrón a negro. La mandíbula inferior y la base del maxilar son amarillas a anaranjadas, con la punta de la mandíbula inferior de color negro. El interior de la cavidad bucal en el adulto es también negro. El iris, el pico y las patas del juvenil son equivalentes a los del adulto.
Las alas son marrón grisáceo, con las secciones internas de las primarias blancas y las cubiertas alares inferiores blanco nacarado.
La cola, larga y graduada, es marrón grisáceo por arriba y negruzca por debajo. Las cubiertas infracaudales presentan un tono gris nacarado claro. La parte inferior de la cola es generalmente negruzca, con grandes manchas blancas y redondeadas en las puntas de las timoneras: T3 (13 mm), T4 (18 mm) y T5 (22 mm). T1 es gris parduzco y carece de punta blanca, mientras que T2 es negruzca con estrechas manchas blancas (3 mm).
Las partes inferiores, desde la garganta hasta el pecho, exhiben un color blanco grisáceo nacarado; el vientre es blanco, mientras que las axilares y las cubiertas infraalares son blanco nacarado.
Los pies zigodáctilos (dos dedos internos dirigidos hacia adelante y dos externos invertidos) presentan coloración gris a gris azulada, con la suela amarillenta y las garras negras.
Juvenil: El juvenil es similar al adulto, aunque presenta bordes finos y pálidos en las alas. Las remeras son más estrechas y puntiagudas, con manchas blanquecinas inferiores menos definidas que gradúan hacia el marrón. La cola carece de manchas en R1; R2 muestra un tenue rastro blanco en la punta; y R3 (8 mm), R4 (15 mm) y R5 (15 mm) presentan manchas blancas. Las cubiertas auriculares no son más oscuras que la corona, por lo que no exhiben la apariencia de máscara facial característica del adulto.
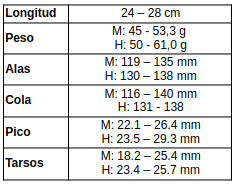
Medidas (Payne, 2005:345; Erritzøe et al., 2012:295; Hilty, 2003:350; Hilty & Brown, 1986:217; Brito et al., 2016:179; de la Peña, 2020:98)
Mudas
Poco conocida. Probablemente muda una vez al año (Payne, 2005:345). Las primarias se mudan siguiendo un patrón de muda irregular, en el que la muda avanza o retrocede saltándose una o más primarias adyacentes (Payne, 2005:345). -
Cuclillo ceniciento | Taxonomía
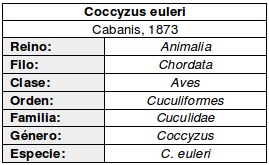
Monotípico (del Hoyo, 2020:169)
El Cuclillo ceniciento (C. euleri) presenta una gran similitud morfológica con su especie hermana Coccyzus americanus (Cuclillo pico amarillo), migrante o invernante en amplias zonas de su distribución. No obstante, puede diferenciarse con mayor fiabilidad por la ausencia de la mancha rufo brillante en las primarias (visible en vuelo), su menor tamaño, su tonalidad más oscura y grisácea, y las cubiertas infraalares completamente blancas (Erritzøe et al., 2012:295). Otros rasgos de diferenciación propuestos, como el pecho gris perla o el anillo ocular gris (Hilty, 2003:350; Restall et al., 2003), resultan menos consistentes, dado que individuos de primer año e incluso algunos adultos de C. americanus también presentan anillos oculares grises (Payne, 2005:345), y la coloración ventral de esta última especie varía del blanco puro al gris pálido (Claessens et al., 2011:129).
El comportamiento puede ser igualmente útil para la identificación. El C. americanus no suele encontrarse en el área de distribución del Coccyzus euleri entre abril y agosto, debido a su condición migratoria (Hughes, 2020). Además, durante el invierno austral tiende a ocupar hábitats semiabiertos y arbustivos, mientras que el Cuclillo ceniciento (C. euleri) se asocia preferentemente al dosel forestal (Claessens et al., 2011:130). Asimismo, el C. americanus suele permanecer silencioso en Sudamérica (Hilty & Brown, 1986:217; Hilty, 2003:350).
-
Cuclillo ceniciento (Coccyzus euleri)

© Animalia.Bio. Cuclillo ventriblanco. Algunos derechos reservados Del género Coccyzus, el Coccyzus euleri (Cuclillo ceniciento) constituye una de las especies menos conocidas, pese a su amplia distribución en el norte y centro de Sudamérica. El limitado conocimiento sobre su ecología y comportamiento se ha visto reforzado por su marcada similitud con el Coccyzus americanus (Cuclillo pico amarillo), especie boreal que inverna en Sudamérica y con la cual comparte rasgos morfológicos y vocales. Esta semejanza llevó a ornitólogos de los siglos XIX y XX a considerarla una subespecie meridional del Cuclillo pico amarillo. La situación se complicó aún más por la existencia de un polémico espécimen tipo, un juvenil colectado en la isla del Sombrero, en las Antillas Menores, muy distante de su distribución habitual. Como resultado, la especie recibió múltiples denominaciones comunes y científicas hasta que la Comisión Internacional de Nomenclatura Zoológica estableció oficialmente su epíteto específico en 1990.
Nota: El espécimen tipo, recolectado en la isla Sombrero y descrito originalmente como Coccyzus julieni (Lawrence, 1864:42), generó prolongadas controversias con respecto a la nomenclatura. En 1873, Cabanis (Cabanis, 1873:72) describió independientemente a Coccygus euleri (= Coccyzus euleri) a partir de un ejemplar brasileño, sin advertir que se trataba de la misma especie. Aunque julieni poseía prioridad taxonómica, euleri prevaleció en la literatura del siglo XX. La Comisión Internacional de Nomenclatura Zoológica suprimió formalmente el nombre julieni en favor de euleri tras la solicitud de Willis & Oniki (1990:195), decisión ratificada en 1992 (Opinión 1688). Por otra parte, el nombre Coccygus lindeni (Allen, 1876:81), basado en un ejemplar colectado cerca de Santarém (Brasil), se reconoce actualmente como sinónimo posterior de Coccyzus euleri (Erritzøe et al., 2012:295).
Nombres comunes: Cuclillo ceniciento (Argentina, Paraguay); Cuco buchiblanco (Colombia); Cuclillo ventriblanco (Venezuela); Cuclillo chico, Cuclillo gris grande. Papa-lagarta, papa-lagarta-de-barriga-branca, papa-lagarta-de Euleri (Brasil) (Sick, 1997:387); En guaraní le llaman “Tuja kue” (de la Peña, 2020:98; Avibase, 2025).
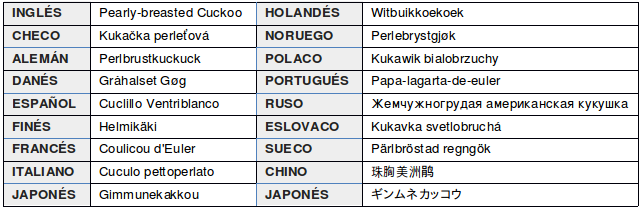
En otros idiomas:
Breves apuntes históricos:
- The Auk. American Ornithologists’ Union. Washington, D. C. (1891): Vol VIII: 159 (Coccyzus lindeni «… siendo de la misma región general del descrito por Cabanis probablemente muy similar al Coccyzus euleri…»)
- The birds of North and Middle America: a descriptive catalogue of the higher groups, genera, species, and subspecies of birds known to occur in North America, from the Arctic lands to the Isthmus of Panama, the West Indies and other islands of the Caribbean sea, and the Galapagos Archipelago. Ridgway, Robert, Friedmann, Herbert. Bulletin (United States National Museum). Washington: Govt. Print. Off., 1916: Parte VII: 19 («… El tipo de especímen de Coccyzus americanus julienis de Lawrence, que dice ser de la Isla de Sombrero- Antillas menores- y posiblemente ha sido erróneamente acreditado a esta localidad… concuerda estrechamente con los especímenes brasileños de Coccyzus euleri examinados…)
- Catalogo das aves do Brasil e lista dos exemplares que as representam no Museu Paulista. Pinto, Oliveiro M. de Oliveira. BR [Museu Paulista] 1938: 172 (Coccyzus euleri)
- Catalogos da fauna brazileira. Brölemann, Henry Wilfrid, Ducke, A. (Adolfo), Hempel, Adolph, Ihering, H. von (Hermann), Ihering, Rodolpho von. São Paulo, Brazil: Typ. do Diario oficial, 1907-1913; Vol I:160 (Coccyzus euleri)
- A contribution to the ornithology of northeastern Brazil. Publication (Field Museum of Natural History: 1909). Hellmayr, Carl Eduard. Chicago, 1929. Zoological Series ; Vol 12, no. 18: 432 (Coccyzus euleri)
- The Bulletin of zoological nomenclature. Intl Commission on Zoological Nomenclature. London,International Trust for Zoological Nomenclature (1990); Vol 47:195-196 («El propósito de esta publicación es la de conservar el nombre específico de «Coccyzus euleri» – Cabanis 1873-, establecido desde hace mucho tiempo en Sudamérica. Este nombre invalida el sinónimo de «Coccyzus julieni» – Lawrence 1864-«)
-
Cuclillo pico amarillo | Bibliografía
- Adamus, P. R. (1987). Atlas of Breeding Birds in Maine, 1978–1983. Maine Department of Inland Fisheries and Wildlife, Augusta, ME, USA. (enlace)
- Administración de Parques Nacionales. Sistema de Información de Biodiversidad (SIB); Ficha: Coccyzus americanus; Recuperado en noviembre 2025 de https://sib.gob.ar/especies/coccyzus-americanus
- Alcorn, J. R. (1988). The Birds of Nevada. Fairview West Publishing, Fallon, NV, USA. (enlace)
- Amos, E. J. R. (1991). A Guide to the Birds of Bermuda. Corncrake, Warwick, Bermuda. 206 pp.
- Anderson, B. W. & S. A. Laymon (1989). Creating habitat for the Yellow-billed Cuckoo (Coccyzus americanus). USDA Forestry Service, USA. (enlace)
- Antelo, C. M. & Z. J. B. Fernández (2013). Las aves no passeriformes de Tucumán, Argentina. Miscelánea, 132. Fundación Miguel Lillo, Argentina. (enlace)
- Andrews, P. & R. Righter (1992). Colorado Birds. Denver Museum of Natural History, Denver, CO, USA. 442 pp.
- Avibase. Ficha: Cuclillo piquigualdo (Coccyzus americanus, Linnaeus, 1758); Recuperado en noviembre 2025 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=0CF12F8155708DC8
- Bancroft, G. T., A. M. Strong & M. Carrington (1995). Deforestation and its effects on forest-nesting birds in the Florida Keys. Conservation Biology, 9: 835–844. (enlace)
- Banks, R. C. (1988). Geographic variation in the Yellow-billed Cuckoo. Condor, 90: 473–477. (enlace)
- Banks, R. C., Cicero, C., Dunn, J. L., Kratter, A. W., Rasmussen, P. C., Remsen Jr, J. V., … & D. F. Stotz (2006). Forty-seventh supplement to the American Ornithologists’ Union check-list of North American birds. The Auk, 123 (3): 926-936. (enlace)
- Barber, N. A., R. J. Marquis & W. P. Tori (2008). Invasive prey impacts the abundance and distribution of native predators. Ecology, 89 (10): 2678–2683.
- Barnett, J. M. & M. Pearman (2001). Lista comentada de las Aves Argentinas. Lynx Edicions, Barcelona, Spain. 164 pp. ISBN 84-87334-32-6
- Beal, F. E. L. (1898). Cuckoos and shrikes and their relation to agriculture. U.S. Department of Agriculture Biological Survey Bulletin 9, USA. (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1: Rheidae through Furnariidae. Bulletin of the American Museum of Natural History, 178: 369–636. (enlace)
- Bender, R. O. (1961). Food competition among closely related sympatric species. Wilson Bulletin, 73: 214. (enlace)
- Bent, A. C. (1940). Life histories of North American cuckoos, goatsuckers, hummingbirds, and their allies. United States National Museum Bulletin, 176. (enlace)
- Bernstein, L. (1965). Fossil birds from the Dominican Republic. Quarterly Journal of the Florida Academy of Sciences, 28: 271–284. (enlace)
- Binford, L. C. (1989). A distributional survey of the birds of the Mexican state of Oaxaca. Ornithological Monographs, 43. American Ornithologists’ Union, Washington, DC, USA. (enlace)
- BirdLife International (2021). Species factsheet: Yellow-billed Cuckoo Coccyzus americanus. Downloaded from https://datazone.birdlife.org/species/factsheet/yellow-billed-cuckoo-coccyzus-americanus on 21/11/2025
- Bodrati, A., K. Cockle, J. M. Segovia, I. Roesler, J. I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A. & S. A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Historia Natural. Tercera Serie, Volumen 5 (1): 77-89. (enlace)
- Bosque, C. & M. Lentino (1987). The passage of North American migratory land birds through xerophytic habitats on the western coast of Venezuela. Biotropica, 19: 267–273. (enlace)
- Brandán, Z. J. (2005). Avifauna de un sector del Bosque de transición Tucumano, en diferentes condiciones de uso. Acta Zoológica Lilloana, 49 (1-2): 3-8. (enlace)
- Brandán, Z. J. & C. I. Navarro (2009). Lista actualizada de las aves de la provincia de Tucumán. Fundación Lillo. Tucumán (enlace)
- Buden, D. W. (1987). The birds of the southern Bahamas, British Ornithology Club Check-list. Nº 8. British Ornithology Club, London, UK. (enlace)
- Burgos, F. G., J. L. Baldo & F. M. Cornell (2009). Lista de las aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. S. S. de Jujuy. (enlace)
- Campbell, R. W., N. K. Dawe, I. McTaggart-Cowan, J. M. Cooper, G. W. Kaiser & M. C. E. McNall (1990). The Birds of British Columbia, Volume 2. Diurnal Birds of Prey Through Woodpeckers. Royal British Columbia Museum, Victoria, Canada.
- Camperi, A. R., Darrieu, C. A. & M. Juárez (2008). Avifauna de la provincia de La Rioja (Argentina): lista comentada de especies. Acta zoológica lilloana, 76-97. (enlace)
- Carma, M. I. (2007). Relevamiento de aves de la provincia de Catamarca. Consejo Federal de Inversiones. 1º Ed., Buenos Aires. 500 pp. ISBN 978-987-510-081-7 (enlace)
- Carothers, S. W., R. R. Johnson & S. W. Aitchison (1974). Populations structure and social organization of southwestern riparian birds. American Zoology, 14: 97–108. (enlace)
- Chébez, J. C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5.; 320 pp. Ed. L.O.L.A. (Literature of Latin America). Buenos Aires. ISBN 950-9725-20-X
- Clark, K. B., B. Procsal & M. Dodero (2014). Recent trends in Yellow-billed Cuckoo occurrences in southern California, with observations of a foraging cuckoo in San Diego County. Western Birds, 45 (2): 141–150. (enlace)
- Clay, M. B. (1929). The Yellow-billed Cuckoo. Bird-Lore, Vol. 31 (3): 189–190. (enlace)
- Clotfelter, E. D. & T. Brush (1995). Unusual parasitism by the Bronzed Cowbird. Cóndor, 97 (3): 814–815. (enlace)
- Coconier, E. G. (ed.) (2007). Las aves silvestres de Acambuco, provincia de Salta, Argentina. Relevamiento de un AICA prioritaria de la selva Pedemontana. Temas de Naturaleza y Conservación, 6: 1-127. Aves Argentinas/AOP, Buenos Aires (enlace)
- Codesido, M. & D. Bilenca (2004). Variación Estacional de un Ensamble de Aves en un Bosque Subtropical Semiárido del Chaco Argentine. Biotropica, 36 (4): 544-554.
- Contino, F. N. (1980). Aves del noroeste argentino. Universidad Nacional de Salta, Secretaría de Estado de Asuntos Agrarios, Dirección General de Recursos Naturales Renovables. 136 pp.
- Contreras, J. R. (1981). Lista preliminar de la avifauna correntina. I. No Passeriformes. Historia Natural, 2: 21-28.
- Contreras, J. R. (1987). Lista preliminar de la avifauna de la provincia de Formosa, República Argentina. Historia Natural, VII (4): 33-52.
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti & E. E. Utges (1990). Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Volume 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1. 164 pp.
- Contreras, J. R., F. Agnolin, Y. E. Davies, I. Godoy, A. Giacchino & E. Ríos (2014). Atlas ornito-geográfico de la provincia de Formosa, República Argentina. 1º Ed. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 pp. (enlace)
- Coria, O. R., Quiroga, O. B., Navarro, J. L., Heredia, J., Torres, R. & J. Lima (2021). Lista actualizada de las aves de Santiago del Estero, Argentina. Acta Zoológica Lilloana: 42:143. (enlace)
- Cracraft, J. (1964). Observations on sun-bathing in the Yellow-billed Cuckoo. Wilson Bulletin, 76: 187. (enlace)
- Cramp, S. (1985). The Birds of the Western Palearctic, Volume 4: Terns to Woodpeckers. Oxford University Press, Oxford, UK.
- Crawford, R. L. & H. M. Stevenson (1984). Patterns of spring and fall migration in northwest Florida. Journal of Field Ornithology, 55 (2): 196–203. (enlace)
- Darrieu, C. A., Camperi, A. R., Piloni, G. & N. R. Bogado (2013). Lista actualizada de las aves de la provincia de Buenos Aires. (1º Ed.) Fundación de Historia Natural» Félix de Azara». 56 pp. ISBN 978-987-29251-1-6 (enlace)
- De Casenave, J. L., Pelotto, J. P., Caziani, S. M., Mermoz, M. & J. Protomastro (1998). Responses of avian assemblages to a natural edge in a Chaco semiarid forest in Argentina. The Auk, 115 (2): 425-435. (enlace)
- de la Peña M. R. (1999). Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 18; 244 pp. Buenos Aires. ISSN 0-328-1620
- de la Peña, M. R. (2006). Lista y distribución de las aves de Santa Fe y Entre Ríos. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 15; 138 pp. Buenos Aires. ISSN 0-328-1620
- de la Peña, M. R., Laene Silva, R., Capuccio, G. & L. M. Bonin (2009) Aves del Río Uruguay. Guía Ilustrada de Especies del Bajo Uruguay y el Embalse de Salto Grande. (CARU). Comisión Administradora del Río Uruguay
- de la Peña, M. R. (2011). Atlas ornitogeográfico de la provincia de Santa Fe. Serie Naturaleza y Conservación No 4. Pág. 1-500.
- de la Peña, M. R. (2013) Citas, observaciones y distribución de aves argentinas: Edición ampliada. Serie Naturaleza, Conservación y Sociedad N° 7, Ediciones Biológica, 786 pp.
- de la Peña, M. R. (2015). Aves Argentinas. Incluye nidos y huevos. 1º Ed. Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña, M. R. (2016). Aves Argentinas: descripción, comportamiento, reproducción y distribución. Charadriidae a Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie). Vol. 20 (1): 1-627.
- de la Peña, M. R. (2020). Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución (actualización). Cuculidae, Tytonidae, Strigidae, Nyctibiidae, Caprimulgidae, Apodidae, Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) N° 6: 1-348. ISSN 0325-3856
- del Hoyo, J. de. (2020). All the Birds of the World. Lynx Edicions, Barcelona. ISBN 978-84-16728-37-4
- Di Giácomo, A. G. (2005). Aves de la Reserva El Bagual. Pp 203-465 en Historia natural y paisaje de la Reserva El Bagual, Provincia de Formosa, Argentina (A. G. Di Giácomo and S. F. Krapovickas, Editores). Temas de Naturaleza y Conservación N°4. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires, Argentina. (enlace)
- Dobkin, D. S. (1994). Conservation and Management of Neotropical Migrant Land Birds in the Northern Rockies and Great Plains. University of Idaho Press, Moscow, ID, USA. (enlace)
- Downer, A. & R. Sutton (1990). Birds of Jamaica: A Photographic Field Guide. Cambridge University Press, Cambridge, UK. (enlace)
- Duquette, G. (2019). “Yellow-billed cuckoo”, pp. 172-173 in Second Atlas of the Breeding Birds of Southern Québec. Regroupement (M. Robert, M.-H. Hachey, D. Lepage and A.R. Couturier, eds.). Regroupement QuébecOiseaux, Canadian Wildlife Service (Environment and Climate Change Canada) and Bird Studies Canada, Montréal, xxv + 694 p. Downloaded on 15 January 2024 https://www.atlas-oiseaux.qc.ca/telechargement_en.jsp
- Eastman, J. (1991). Yellow-billed Cuckoo. In The Atlas of Breeding Birds of Michigan (R. Brewer, G. A. McPeek, and R. J. Adams Jr., Editors). Michigan State University Press East Lansing, MI, USA. pp. 234–245.
- Eaton, S. W. (1979). Notes on the reproductive behavior of the Yellow-billed Cuckoo. Wilson Bulletin, 91: 154–155. (enlace)
- Eaton, S. W. (1988). Yellow-billed Cuckoo. In The Atlas of Breeding Birds in New York State (R. F. Andrle and J. R. Carroll, Editors). Cornell University Press, Ithaca, NY, USA. pp. 198–199 (enlace)
- eBird. Ficha: Cuclillo piquigualdo (Coccyzus americanus). Recuperado en noviembre 2025 de https://ebird.org/species/yebcuc
- Echevarría, A. L., N. L. Marigliano & J. M. Chani (1998). Composición y variaciones anuales de la diversidad de aves de una localidad de Bosque chaqueño serrano (Ticucho, El Cadillal, Tucumán, Argentina). Acta Zoológica Lilloana, 44 (1): 207-217.
- Echevarría, A. L. & J. M. Chani (1999). Lista de aves del embalse El Cadillal, provincia de Tucumán. Acta Zoológica Lilloana, 45 (1): 141-145.
- Echevarría, A. L. & J. M. Chani (2000). Estructura de las comunidades de aves acuáticas del embalse El Cadillal, Tucumán, Argentina. Acta Zoológica Lilloana, 45 (2): 219-232. (enlace)
- Echevarría, A. L. & J. M. Chani (2006). Aves migratorias, la importancia del embalse El Cadillal, (Tucumán, Argentina) como sitio de tránsito e invernada. Acta Zoológica Lilloana, 50 (1-2): 97-108 (enlace)
- Echevarría, A. L., J. M. Chani, R. Lobo Allende, M. D. Juri, J. Torres Dowsall, E. Martín & E. Tribulo (2007). Aves del Jardín Botánico de la Fundación Miguel Lillo, Fundación Miguel Lillo, Tucumán, Argentina, 1º Ed.. 136 pp.
- Echevarría, A. L., L. R. Lobo Allende, M. D. Juri, J. M. Chani, J. Torres Dowsall & E. Martín (2011). Composición, estructura y variación estacional de la comunidad de aves del Jardín Botánico de la Fundación Miguel Lillo, Tucumán, Argentina. Acta. Zool. Lilloana, 55: 123-136.
- EcoRegistros (2025). Ficha: Cuclillo pico amarillo (Coccyzus americanus, Linnaeus 1758); Recuperado en noviembre 2025 de https://www.ecoregistros.org/ficha/Coccyzus-americanus
- Ehrlich, P. R., D. S. Dobkin & D. Wheye (1992). Birds in Jeopardy: The Imperiled and Extinct Birds of the United States and Canada, Including Hawaii and Puerto Rico. Stanford University Press, Stanford, CA, USA. (enlace)
- Esteban, J. G. (1953). Nuevas localidades para aves argentinas. Acta Zool. Lilloana, 13: 349-362.
- Evans, P. G. H. (1990). Birds of the Eastern Caribbean. Macmillan Press, Ltd., London, United Kingdom. (enlace)
- Fanjul, M. E. (2010). El papel de las plantaciones de limones (Citrus lemon) para la avifauna en Tucumán, Argentina. Tesis de Maestría, Universidad Nacional de Córdoba. Programa de Postgrado en Manejo de Vida Silvestre, Córdoba, Argentina.
- Farrell, L. L. (2014). Examining the genetic distinctiveness of the western subspecies of Yellow-billed Cuckoo Coccyzus americanus occidentalis. Ardea, 101 (2): 165–170. (enlace)
- Fernández Guaraz, J. L. (2013). Nuevo registro de Cuclillo pico amarillo (Coccyzus americanus) para la provincia de Entre Ríos, Argentina. Ecoregistros Revista, 3 (8): 33-35. (enlace)
- Ffrench, R. (1991). A Guide to the Birds of Trinidad and Tobago. Revised edition. Cornell University Press, Ithaca, NY, USA.
- Fleischer, R. C., M. T. Murphy & L. E. Hunt (1985). Clutch size increase and intraspecific brood parasitism in the Yellow-billed Cuckoo. Wilson Bulletin, 97: 125–127. (enlace)
- Fraga, R. M. (1997). Sección III, Aves. La Categorización de las aves argentines en F.U.C.E.M.A., A.O.P., S.A.R.E.M. y A.P.N. Libro Rojo de Mamíferos y Aves Amenazados de la Argentina. 157-219 pp. (enlace)
- Franzreb, K. E. & S. A. Laymon (1993). A reassessment of the taxonomic status of the Yellow-billed Cuckoo. Western Birds, 24: 17–28.
- Friedmann, H. (1971). Further information on the host relations of the parasitic cowbirds. Auk, 88: 239–255. (enlace)
- Friedmann, H., L. Griscom & R. Moore (1950). Distributional checklist of the birds of Mexico, Part I. Pacific Coast Avifauna 29. (enlace)
- Gaines, D. (1974). Review of the status of the Yellow-billed Cuckoo in California: Sacramento Valley populations. Condor, 76: 204–209. (enlace)
- Gaines, D. & S. A. Laymon (1984). Decline, status, and preservation of the Yellow-billed Cuckoo in California. Western Birds, 15: 49–80. (enlace)
- Giacomelli, E. (1907). Catálogo sistemático de la avifauna riojana. Anales de la Sociedad Científica Argentina, 63: 66-84.
- Giacomelli, E. (1923). Catálogo sistemático de las aves útiles y nocivas de la provincia de La Rioja. Hornero, 3: 66-84. (enlace)
- Giai, A. G. (1950). Notas de viajes. Por el norte occidental de Santa Fe y por el norte de Misiones. Hornero, 9 (2): 121-164. (enlace)
- Giraudo, A. R., Bortoluzzi, A. & V. Arzamendia (2006). Vertebrados tetrápodos de la Reserva y Sitio Ramsar “Esteros del Iberá” (Corrientes, Argentina): Análisis de su composición y nuevos registros para especies amenazadas. Natura Neotropicalis, 37 (1-2): 1-20. (enlace)
- Grocki, D. R. J. & D. W. Johnston (1974). Chlorinated hydrocarbon pesticides in North American cuckoos. Auk, 91: 186–188. (enlace)
- Groschupf, K. (1987). Status of the Yellow-billed Cuckoo (Coccyzus americanus occidentalis) in Arizona and west Texas. USFW Service, Phoenix, AZ.
- Halterman, M. D. (2009). Sexual dimorphism, home range, detection probability, and parental care in the Yellow-billed Cuckoo. Ph.D. dissertation, University of Nevada, Reno, NV, USA. (enlace)
- Halterman, M. D., Johnson, M. J., Holmes, J. A. & S. A. Laymon (2015). A natural history summary and survey protocol for the western distinct population segment of the Yellow-billed Cuckoo. Sacramento, CA: US Fish and Wildlife Service. (enlace)
- Hamilton III, W. J. & M. E. Hamilton (1965). Breeding characteristics of Yellow-billed Cuckoos in Arizona. Proceedings of the California Academy of Science, 32: 405–432. (enlace)
- Hanna, W. C. (1937). California Cuckoo in the San Bernardino Valley, California. Cóndor, 39: 57–59. (enlace)
- Harrison, C. J. O. (1979). A Field Guide to the Nests, Eggs and Nestlings of North American Birds. Collins, New York. (enlace)
- Haverschmidt, F., & G. F. Mees (1968). Birds of Suriname. Paramaribo, Suriname: VACO N.V. (enlace)
- Hayes, F. E. (1995). Status, Distribution, and Biogeography of the Birds of Paraguay. American Birding Association, Colorado Springs, Colorado, USA.
- Hayes, F. E., S. M. Goodman, J. A. Fox, T. G. Tamayo & N. E. López (1990). North American bird migrants in Paraguay. Condor, 92: 947–960. (enlace)
- Hendricks, D. P. (1975). Copulatory behavior of a pair of Yellow-billed Cuckoos. Auk, 92: 151. (enlace)
- Hilty, S. L. (2002). Birds of Venezuela. (2º Ed.). Princeton University Press, 41 William Street, Princeton, New Jersey 08540. 878 pp. ISBN: 0691021317
- Hilty, S. L. & W. L. Brown (1986). A Guide to the Birds of Colombia. Princeton University Press, Princeton, NJ, USA.
- Howe, W. H. (1986). Status of the Yellow-billed Cuckoo (Coccyzus americanus) in New Mexico. New Mexico Department Game Fish, Santa Fe, NM, USA.
- Howell, J. C., A. R. Laskey & J. T. Tanner (1954). Bird mortality at airport ceilometers. Wilson Bulletin, 66: 207–215. (enlace)
- Howell, S. N. G. & S. Webb (1995). A Guide to the Birds of Mexico and Northern Central America. Oxford University Press, New York, NY, USA.
- Hughes, J. M. (1996). Phylogenetic analysis of the Cuculidae (Aves, Cuculiformes) using behavioral and ecological characters. The Auk, 113 (1): 10-22. (enlace)
- Hughes, J. M. (1997). Taxonomic significance of host-egg mimicry by facultative brood parasites of the avian genus Coccyzus (Cuculidae). Canadian Journal of Zoology, 75: 1380–1386.
- Hughes, J. M. (2006). Phylogeny of the cuckoo genus Coccyzus (Aves: Cuculidae): a test of monophyly. Systematics and Biodiversity, 4 (4): 483-488. (enlace)
- Hughes, J. M. (2020). Yellow-billed Cuckoo (Coccyzus americanus), version 1.0. In Birds of the World (P. G. Rodewald, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.yebcuc.01
- Johnsgard, P. A. (1979). Birds of the Great Plains: Breeding Species and their Distribution. University of Nebraska Press, Lincoln, NE, USA. (enlace)
- Johnston, D. W. (1975). Ecological analysis of the Cayman Island avifauna. Bulletin of the Florida State Museum Biological Sciences, 19: 235–295. (enlace)
- Kepler, C. B. & A. K. Kepler (1978). Status and nesting of the Yellow-billed Cuckoo in Puerto Rico. Auk, 95: 417–419. (enlace)
- Klimaitis, J. F. (1975). Lista sistemática de aves del partido de Berisso (Bs. As.): parte I: no Passeriformes. Hornero, 11 (04): (enlace)
- Klimaitis, J. F. & F. N. Moschione (1987). Aves de la Reserva Integral de Selva Marginal de Punta Lara y sus Alrededores. Dirección de Servicios Generales del Ministerio de Economía de la Provincia de Buenos Aires, Argentina.
- Lack, D. (1976). Island Biology, Illustrated by the Land Birds of Jamaica. Volume 3. University of California Press, Berkeley, CA. USA.
- Laubmann, A. (1930). Vögel en Wissenschaftliche Ergebnisse der Deutschen Gran Chaco-Expedition. Verlag von Strecker und Schröder, Stuttgart.
- Laymon, S. A. (1980). Feeding and nesting behavior of the Yellow-billed Cuckoo in the Sacramento Valley. Sacramento: Calif. Dept. Fish and Wildlife. (enlace)
- Laymon, S. A. & M. D. Halterman (1987). Can the western subspecies of Yellow-billed Cuckoo be saved from extinction? Western Birds, 18: 19–25. (enlace)
- Laymon, S. A. & M. D. Halterman (1989). A proposed habitat management plan for Yellow-billed Cuckoos in California. US Department of Agriculture, Forest Service, Pacific Southwest Forest and Range Experiment Station, 110: 272–277. (enlace)
- Laymon, S. A., P. L. Williams & M. D. Halterman (1997). Breeding status of the Yellow-billed Cuckoo in the South Fork Kern River Valley, Kern County, California: Summary report 1985? 1996. In Challenge Cost-Share Grant: Admin. Rep. USDA Forest Service, Sequoia National Forest, Cannell Meadow Ranger District. (enlace)
- Lucero, M. M. (1983). Lista y distribución de aves y mamíferos de la provincia de Tucumán. Miscelánea Nº 75. Fund. M. Lillo. Tucumán. 61 pp. (enlace)
- Lucero, M. M., J. M. Chani, Z. J. Brandán, A. L. Echevarría & M. D. Juri (2002). Lista de aves de San Miguel de Tucumán y Yerba Buena. Acta Zool. Lilloana, 46 (1 y 2): 131-135 (enlace)
- Lucero, M. M., Z. J. Brandán & J. M. Chani (2005). Composición y variación anual de la avifauna de los tres grandes parques urbanos de San Miguel de Tucumán (Tucumán, Argentina). Acta Zool. Lilloana, 49 (1 y 2): 43-48.
- Manassero, M., H. Luna & L. Acquaviva (2007). Jaaukanigás. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 433-434. Temas de Naturaleza y Conservación 5. CD-ROM. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires.
- McNeil, S. E., D. Tracy, J. R. Stanek & J. E. Stanek (2012). Yellow-billed Cuckoo distribution, abundance and habitat use on the lower Colorado River and tributaries, 2011 annual report. Boulder City: Lower Colorado River Multi-species Conservation Program, Bureau of Reclamation. (enlace)
- Mengel, R. M. (1965). The Birds of Kentucky. Ornithological Monographs 3. American Ornithologists’ Union, Washington, DC, USA. (enlace)
- Meyer de Schauensee, R. (1982). A Guide to the Birds of South America. Livingston Publishing Company, Wynnewood, PA, USA. (enlace)
- Meyer de Schauensee, R. & W. H. Phelps (1978). A Guide to the Birds of Venezuela. Princeton University Press, Princeton, NJ, USA. (enlace)
- Miatello, R., Baldo, J., Biancucci, L. & V. Cobos (2003). Nuevos registros de aves poco citadas para Córdoba, Argentina. Nuestras Aves, (45): 15-21. (enlace)
- Monroe, B. L., Jr. (1968). A distributional survey of the birds of Honduras. Ornithological Monographs, 7. American Ornithologists’ Union, Washington, D.C., USA. (enlace)
- Morici, A. (2012). Las aves del área Natural Protegida “Dique Roggero” (Buenos Aires, Argentina). Biológica, 15: 24-36. (enlace)
- Moschione, F. & L. Bishels (2004). Listado de las aves del Parque Provincial Loro Hablador, provincia del Chaco. Informe Técnico. Proyecto Elé/DFS. Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F. N. & J. Segovia (2005). Listado de las aves de la Reserva Natural Las Lancitas, Santa Bárbara, Jujuy. (Informe Téc.) Proy. Elé/DFS.
- Moschione, F., O. Spitznagel & M. González (2014). Lista de aves de Salta. Gobierno de la Provincia de Salta. (enlace)
- Narosky, T. & A. G. Di Giacomo (1993). Las aves de la provincia de Buenos Aires, distribución y estatus. Asoc. Orn. del Plata. Vazquez Mazzini Editores, L.O.L.A., Buenos Aires. 127 pp. ISBN: 950-99063-6-0
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. ISBN 950-99063-6-0
- Naturalis Biodversity Center (2017). Dutch Caribbean Species Register, www.dutchcaribbeanspecies.org. Accessed on ocubre 2025. (enlace)
- Navarro, C. I., Z. J. Brandán & N. L. Marigliano (2007). Lista comentada de las aves de un fragmento de la Reserva Provincial La Florida, Tucumán, Argentina. Acta Zool. Lilloana, 51: 142-150. (enlace)
- Nolan, Jr., V. (1975). External differences between newly hatched cuckoos (Coccyzus americanus and C. erythropthalmus). Cóndor, 77: 431. (enlace)
- Nolan, Jr., V. & C. F. Thompson (1975). The occurrence and significance of anomalous reproductive activities in two North American nonparasitic cuckoos Coccyzus spp. Ibis, 117: 496–503. (enlace)
- Nolan, V., Jr. (1963). Reproductive success of birds in a deciduous scrub habitat. Ecology, 44: 305–313. (enlace)
- Nores, M. A., D. Yzurieta & S. A. Salvador (1991). Lista y Distribución de las Aves de Santiago del Estero, Argentina. Bol. Acad. Nac. Cienc. Córdoba, 59: 157-196 (enlace)
- Nores, M. (1996). Avifauna de la provincia de Córdoba. Fauna, 1: 255-337.
- Oberholser, H. C. (1974). The Bird Life of Texas. Vol 1. University of Texas Press, Austin, TX, USA. (enlace)
- Olrog, C. Ch. (1979). Nueva Lista de la Avifauna Argentina. Ópera Lilloana XXVII. Ministerio de Cultura y Educación. Fundación Miguel Lillo. Tucumán, Argentina. 324 pp. ISSN 0078-5245
- Olrog, C. Ch. (1984). Las aves argentinas. Una guía de campo. Ad. Parques Nacionales. 352 pp. (enlace)
- Ortiz, D. & C. Ruiz (2011). Migración y estacionalidad de aves en el arroyo Mista, Tucumán, Argentina. Nuestras Aves, 56: 16-18. (enlace)
- Ortiz, D. & R. Aráoz (2014). Aves de la Sierra de San Javier. Universidad Nacional de Tucumán. ISBN 978-987-33-4376-6 (enlace)
- Pagano, L. G., Jordan, E. A. & J. I. Areta (2012). Aves de la Reserva Natural de Punta Lara. In book: Inventario de los Vertebrados de la Reserva Natural Punta Lara, provincia de Buenos Aires, Argentina.Edition: Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 8.Publisher: Aves Argentinas. Editors: Gabriela Agostini, Ignacio Roesler. (enlace)
- Parker T. A., III, S. A. Parker & M. A. Plenge (1982). An Annotated Checklist of Peruvian Birds. Buteo Books, Vermillion, South Dakota, USA. (enlace)
- Payne, R. B., Editor (2005). The Cuckoos. Oxford University Press, New York, NY, USA.
- Peck, G. K. & R. D. James (1983). Breeding Birds of Ontario: Nidiology and Distribution. Volume 1: Nonpasserines. Royal Ontario Museum, Toronto, ON, Canada. (enlace)
- Pereyra, J. A. (1938). Aves de la zona ribereña nordeste de la provincia de Buenos Aires. Memorias del Jardín Zoológico. La Plata. Tomo 9, parte 2: 1-304.
- Peterjohn, B. G. (1989). The Birds of Ohio. Indiana University Press, Bloomington, IN, USA. (enlace)
- Planqué, R., Vellinga, W. P., Pieterse, S., Jongsma J. & R. de By (Xeno-canto Foundation). Ficha: Cuclillo piquigualdo (Coccyzus americanus, Linnaeus 1758); recuperado en noviembre 2025 de https://xeno-canto.org/species/Coccyzus-americanus
- Potter, E. F. (1980). Notes on nesting Yellow-billed Cuckoos. Journal of Field Ornithology, 51: 17–29. (enlace)
- Potter, E. F. (1981). Effects of cool weather on nesting behavior and development in the Yellow-billed Cuckoo. Chat, 45:15–16. (enlace)
- Preble, N. A. (1957). Nesting habits of the Yellow-billed Cuckoo. American Midland Naturalist, 57: 474–482. (enlace)
- Pruett, C.L., Gibson, D.D. & K. Winker (2001). Molecular “cuckoo clock” suggests listing of western Yellow-billed Cuckoos may be warranted. Wilson Bull., 113 (2): 228–231. (enlace)
- Pugnali, G. & P. Chamorro (2008). Lista de aves de la Reserva Costanera Sur. Aves Argentinas. Buenos Aires. (enlace)
- Pulich, W. M. (1988). The Birds of North Central Texas. Texas A & M University Press, College Station, Texas, USA. 439 pp. ISBN 9780890963227
- Pyle, P. (1995). Incomplete flight feather molt and age in certain North American non-passerines. North American Bird Bander, 20: 15–26. (enlace)
- Quiroga, O. B., W. S. Aveldaño, J. C. Mamaní, E. Martínez Pastur & T. Moreno Ten (2020). Notas sobre veintidós especies de aves del noroeste argentino. Nótulas Faunísticas. Segunda Serie, 285: 1-7. (enlace)
- Raffaele, H., J. Wiley, O. Garrido, A. Keith & J. Raffaele (2003). Birds of the West Indies. Princeton University Press, Princeton, NJ, USA. ISBN 0-691-11319
- Rappole, J. H., E. S. Morton, T. E. Lovejoy III & J. S. Rous (1983). Nearctic Avian Migrants in the Neotropics. U.S. Fish and Wildlife Service, Washington, DC, USA. (enlace)
- Remsen, Jr., J. V., M. A. Traylor, Jr. & K. C. Parkes (1986). Range extensions for some Bolivian birds, 2 (Columbidae to Rhinocryptidae). Bulletin of the British Ornithologists’ Club, 106: 22–32. (enlace)
- RHJV (Riparian Habitat Joint Venture) (2004). The riparian bird conservation plan: a strategy for reversing the decline of riparian associated birds in California. California Partners in Flight. (enlace)
- Ridgely, R. S. & J. A. Gwynne (1989). A Guide to the Birds of Panama with Costa Rica, Nicaragua, and Honduras. 2nd edition. Princeton University Press, Princeton, NJ, USA.
- Ridgway, R. (1916). The Birds of North and Middle America. Part 7. United States National Museum Bulletin 50. (enlace)
- Rohwer, S., K. A. Hobson & V. G. Rohwer (2009). Migratory double breeding in Neotropical migrant birds. Proceedings of the National Academy of Sciences of the United States of America, 106 (45): 19050-19055. (enlace)
- Rohwer, S. & C. S. Wood (2013). Abundant early-summer breeding in Sinaloa does not suggest post-migration breeding in three potential double breeders. Wilson Journal of Ornithology, 125 (2): 243-250.
- Rohwer, S., V. G. Rohwer, A. T. Peterson, A. G. Navarro-Sigüenza & P. English (2012). Assessing migratory double breeding through complementary specimen densities and breeding records. Cóndor, 114 (1): 1–14. (enlace)
- Saibene, C. A., Castelino, M. A., Rey, N. R., Herrera, J. & J. Calo (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina. Monografía N.º 9. (1º Ed.). Editorial L.O.L.A. (Literature of Latin America). Buenos Aires, Argentina. 70 pp. ISSN 0328-1620
- Salvador, S. A., Salvador, L. A., Ferrari, C. & S. Vitale (2016). Listado de las aves de la Provincia de Córdoba, Argentina. Argentina Birds Checklist. (enlace)
- Salvador, S. A., L. A. Salvador & C. Ferrari (2017). Aves de la provincia de Córdoba. Distribución e Historia Natural. Ed. DP. Argentina. SA.
- Sauer, J. R., J. E. Hines & J. Fallon (2008). El censo de aves reproductoras de América del Norte: resultados y análisis 1966-2007. Versión 5.15.2008. Centro de Investigación de Vida Silvestre Patuxent del USGS.Laurel, MD.
- Schönwetter, M. (1967). Handbuch der Oologie, Volume 1: Nonpasseres. Akademie-Verlag, Berlin, Germany. (enlace)
- Schulenberg, T. S. (2010). Birds of Peru: revised and updated edition (Vol. 63). Princeton University Press.
- Sferco, G. D. & M. Nores (2003). Lista comentada de las aves de la Reserva Natural Chancaní, Córdoba, Argentina. Hornero, 18 (1): 21-29. (enlace)
- Shire, G. G., K. Brown & G. Winegrad (2000). Communication towers: a deadly hazard to birds. A report compiled by the American Bird Conservancy documenting the killing of 230 bird species. American Bird Conservancy, Washington, DC, USA. (enlace)
- Short, L. L. (1974). Nesting of southern Sonoran birds during the summer rainy season. Cóndor, 76 (1):21–32. (enlace)
- Sibley, C. G. & B. L. Monroe (1990). Distribution and taxonomy of birds of the world. Yale University Press, Connecticut. ISBN 0-300-04969-2 (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Uma Introdução. Universidad de Brasília, Brasília, Brazil. 912 pp. ISBN 85-209-0816-0
- Slud, P. (1964). The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History, 128. (enlace)
- Stevenson, H. M. & B. H. Anderson (1994). The Birdlife of Florida. University Press of Florida, Gainesville, FL, USA. (enlace)
- Stiles, F. G. & A. F. Skutch (1989). A Guide to the Birds of Costa Rica. Cornell University Press, Ithaca, NY, USA. (enlace)
- Stockton De Dod, A. (1978). Aves de la República Dominicana. Santo Domingo: Museo Nacional de Historia Natural. (enlace)
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker III & D. K. Moskovits (1996). Neotropical birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA.
- Stotz, D. F., R. O. Bierregaard, M. Cohn-Haft, P. Peterman & J. Smith (1992). The status of North American migrants in central Amazonian Brazil. Cóndor, 94: 608–621. (enlace)
- Sutton, G. M., R. B. Lea & E. P. Edwards (1950). Notes on the ranges and breeding habits of certain Mexican birds. Bird-Banding, 21 (2): 45–59. (enlace)
- Sutton, G. M. (1967). Oklahoma Birds, Their Ecology and Distribution with Comments on the Avifauna of the Southern Great Plains. University of Oklahoma Press, Norman, OK, USA.
- Vega, J. H. & J. H. Rappole (1994). Composition and phenology of an avian community in the Rio Grande Plain of Texas. Wilson Bulletin, 106: 366–380. (enlace)
- Vides-Almonacid, R. (1991). La alteración del bosque de Yungas en Tucumán, Argentina y el uso de las aves como indicadores ecológicos para el diseño de zonas de amortiguamiento en áreas protegidas. Tesis Maestría Sc., Programa de Maestría en Manejo de Vida Silvestre para Mesoamérica y el Caribe, Universidad de Costa Rica, 210 pp.
- Vides Almonacid, R. (1993). Estudio comparativo de las taxocenosis de aves de los bosques montanos de la Sierra de San Javier, Tucumán, Argentina: Bases para su manejo y conservación. Tesis doctoral, Facultad de Cs. Naturales, Universidad Nacional de Tucumán, Argentina, 347 pp.
- Wallace, G. J. W. P. Nickell, & R. F. Bernard (1961). Bird mortality in the Dutch elm disease program in Michigan. Cranbrook Institute of Science Bulletin 41. (enlace)
- Wallace, C. S. A., M. L. Villarreal & C. van Riper III (2013). Influence of monsoon-related riparian phenology on Yellow-billed Cuckoo habitat selection in Arizona. Journal of Biogeography, 40 (11):2094–2107. (enlace)
- Wenger, T. (2013). En Michigan Breeding Bird Atlas II. Ed. Chartier, A. T., Baldy, J. J. & J. Brenneman. Kalamazoo Nature Center, Michigan. ISBN 978-0-615-77004-8 (enlace)
- Wetmore, A. (1968). Additions to the list of birds recorded from Colombia. Wilson Bulletin, 80: 325–326. (enlace)
- Wilson, J. K. (2000). Additional observations on precopulatory behavior of Yellow-billed Cuckoos. Southwestern Naturalist, 45 (4): 535–536. (enlace)
- Woods, R. W. (2006). Checklist of Falkland Islands Birds
- Yasukawa, K. (2010). Yellow-billed Cuckoo hatched and fed by a Red-winged Blackbird. Wilson Journal of Ornithology, 122 (2): 402–405. (enlace)
- Yzurieta, D. (1995). Manual de reconocimiento y evaluación ecológica de las aves de Córdoba. Ministerio de Agricultura, Ganadería y Recursos Renovables. Córdoba.
- Zotta, A. R. (1934). Sobre el contenido estomacal de algunas aves. Hornero, 5 (3): 376-383. (enlace)
- Zotta, A. R. (1944). Lista sistemática de las aves Argentinas. Mus. Argen. Cienc. Nat. Buenos Aires.
-
Cuclillo pico amarillo | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR.La especie presenta un rango de distribución extremadamente amplio y, en consecuencia, no se aproxima a los umbrales de la categoría Vulnerable según los criterios de extensión de ocurrencia (<20.000 km²), reducción del área de ocupación o fragmentación severa. Aunque existen evidencias de un declive poblacional, este no alcanza el umbral exigido por la UICN para considerar la especie como Vulnerable (disminuciones >30 % en diez años o tres generaciones). Su población global es muy numerosa y supera ampliamente el límite crítico de 10.000 individuos maduros, sin indicios de un declive acelerado que permita clasificarla en una categoría de mayor riesgo. Por estas razones, la especie se evalúa como de “Preocupación Menor”. No obstante, se ha registrado un descenso significativo promedio del 1,6 % anual entre 1970 y 2017 (Partners in Flight 2019) y una reducción del 7 % en Norteamérica durante la última década (Pardieck et al. 2018).
El cuclillo pico amarillo (Coccyzus americanus) es un migrante neotropical que se reproduce en Norteamérica y México y pasa el invierno en Sudamérica (Halterman, 2009:1; Hughes, 2020). Aunque común en el este del continente, sus poblaciones occidentales han experimentado declives severos asociados a la pérdida histórica de más del 95 % del hábitat ribereño (Gaines & Laymon, 1984:49), en un patrón similar al de otras especies ribereñas obligadas del oeste (Hughes, 2020; Laymon & Halterman, 1989:273). Este deterioro ha impulsado acciones de conservación que culminaron en su designación como “amenazada” bajo la «Endangered Species Act».
La especie depende de vegetación ribereña nativa, como álamos y sauces; sin embargo, la pérdida de hábitat alcanza entre 90–99 % en Arizona, Nuevo México y California. Entre los factores principales se encuentran represas, desvíos de agua, ganadería, canalización de ríos y expansión de vegetación exótica como Tamarix y Russian olive, agravados por el cambio climático y la sequía (USFWS 2013; Hughes, 2020).
Las designaciones estatales han variado en función de revisiones taxonómicas (Banks 1988a; Ehrlich et al., 1992). La población occidental fue finalmente incluida como “amenazada” a nivel federal en 2014 (USFWS 2014b), pero persisten categorías divergentes entre estados, desde “en peligro crítico” en Nevada hasta “especie sensible” o “de preocupación” en otros estados del oeste (USFWS 2013, 2014b).
Entre las amenazas antrópicas destacan los efectos de pesticidas (mortalidad directa, adelgazamiento de cáscaras y bioacumulación de DDT) (Laymon, 1980:11; Wallace et al., 1961:31; Grocki & Johnston, 1974:186), así como colisiones con torres y edificios durante la migración nocturna (Howell et al., 1954:212; Shire et al., 2000:8). La degradación y fragmentación del hábitat reduce las características del entorno reproductivo, con requerimientos mínimos de 40–80 ha de bosque ribereño continuo en California (Laymon & Halterman, 1989:274). Las obras hidráulicas, la agricultura, el pastoreo y la expansión de Tamarix han contribuido significativamente a estos declives (Dobkin, 1994:B24; Groschupf, 1987).
Adicionalmente, la especie enfrenta perturbaciones acústicas en zonas urbanas (Goodwin & Shriver, 2011), fluctuaciones climáticas asociadas a la Oscilación del Atlántico Norte y El Niño (Anders & Post, 2006), depredación por aves rapaces y mamíferos, y parasitismo ocasional por Molothrus spp. (Hughes, 1999). El descenso anual de 1,7 % entre 1966 y 2007 (Sauer et al., 2008) refleja una tendencia negativa marcada, en especial en regiones occidentales.
Las estrategias de conservación recomiendan mantener rodales ribereños de álamos y sauces de 10–15 m en el oeste (Anderson & Laymon, 1989) y bosques abiertos con sotobosque denso en el este, junto con la restauración del hábitat y la eliminación del uso de pesticidas en zonas cercanas. Aunque la población global se estima en 9.200.000 individuos y se clasifica como de “preocupación menor” (Rich et al., 2003), la población occidental continúa en declive debido a la destrucción del hábitat, alteraciones hidrológicas, expansión de vegetación no nativa, sequías prolongadas y efectos del cambio climático (Halterman et al., 2015:8).
En Argentina:
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010. -
Cuclillo pico amarillo | Distribución
By Ulrich prokop – Hughes, Janice M. 1999. Yellow-billed Cuckoo (Coccyzus americanus), The Birds of North America Online (A. Poole, Ed.). Ithaca: Cornell Lab of Ornithology; Retrieved from the Birds of North America Online: http://bna.birds.cornell.edu/bna/species/418 doi:10.2173/bna.418, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=20627251  Reproducción
Reproducción Migración
Migración Invernada
InvernadaEl Cuclillo pico amarillo presenta un área de reproducción muy amplia que abarca la Norteamérica templada hasta México y las Antillas Mayores (Hughes, 2020), con posibles núcleos reproductivos en América Central y el noroeste de Sudamérica. Su distribución puede confundirse debido a la presencia de adultos no reproductores fuera de los rangos conocidos durante la época reproductiva. Según Bent (1940:54), junto con su subespecie occidental, ocupa prácticamente todo Estados Unidos y parte del sur de Canadá, siendo más común en los estados australes.
El área de invernada se concentra casi totalmente en Sudamérica al este de los Andes, con la mayoría de registros invernales (diciembre–febrero) en el sur del continente, particularmente en este de Bolivia, centro y este de Brasil, Bolivia, Paraguay, Uruguay y norte de Argentina, pero no en Chile (Stotz et al., 1992:614; Remsen et al., 1986:24; Hayes et al., 1990:955; Meyer de Schauensee, 1982:111; Rappole et al., 1983:245). Se reporta en Colombia entre septiembre y mayo (Hilty & Brown, 1986:217) y en Venezuela es de común a frecuente pero muy localizada, transitoria y rara residente invernal del norte, registrada principalmente entre finales de agosto y principios de mayo, desde el nivel del mar hasta 1.400 m, alcanzando 4.200 m al cruzar pasos montañosos (Hilty, 2002:349; Meyer de Schauensee & Phelps, 1978:111; Hilty, 2002:349). Es localmente común en Surinam (Haverschmidt & Mees, 1994:150), rara en Guyana (Tostain et al., 1992) y transitoria y muy rara en Ecuador (Ridgely & Greenfield, 2010:181). En Perú es un migrante boreal poco común entre octubre y mayo (Schulenberg et al., 2010:182). Sick (1997:387) documenta su presencia regular en Brasil durante el invierno boreal. En las Antillas Mayores se reproduce de forma poco común entre mayo y agosto y migra principalmente entre septiembre–octubre y marzo–abril (Raffaele et al., 2003:98; Buden, 1987:71).
En su hábitat reproductivo, la especie prefiere bosques abiertos con claros y vegetación baja y densa, asociados frecuentemente a cursos de agua, evitando áreas urbanas extensas (Eaton, 1988:198). En el noreste y centro de Estados Unidos y sur de Canadá utiliza bosques, tierras de labranza abandonadas, huertos cubiertos de maleza y matorrales ribereños (Johnsgard, 1979:189; Peck & James, 1983:227; Eaton, 1988:198). En el medio oeste ocupa humedales de sauces y cornejos, así como bosques sucesionales densos (Nolan, 1963:305). En el suroeste de EE.UU. selecciona bosques ribereños desérticos con sauces, álamos, alisos, nogales y mezquites (Hamilton III & Hamilton, 1965:407; Gaines, 1974:206), prefiriendo parches >81 ha (Laymon & Halterman, 1989:19). En el Caribe utiliza bosques costeros secos, ribereños y semicaducifolios (Lack, 1976; Stockton De Dod, 1978:166; Kepler & Kepler, 1978:417). En México se asocia principalmente a hábitats ribereños pero también a bosques secos arbustivos (Short, 1974:24; Howell & Webb, 1995). Binford (1989:127) lo describe como migrante transitorio en gran parte de Oaxaca.
Durante la migración, ocupa matorrales costeros, vegetación secundaria, setos, bordes de bosques y bosques húmedos de tierras bajas desde el nivel del mar hasta 2.500 m (Stiles & Skutch, 1989:184; Howell & Webb, 1995). En el noroeste de Venezuela utiliza estratos arbóreos de 5–6 m dominados por arbustos espinosos y cactus (Bosque & Lentino, 1987:268). En el oeste, sigue corredores ribereños reverdecidos tras los monzones (Wallace et al., 2013:2094).
En las áreas de invernada, prefiere vegetación leñosa cercana al agua dulce, matorrales densos, bosques caducifolios y bosques de galería hasta 1.500 m (Rappole et al., 1983:245; Stotz et al., 1996:168). En Centroamérica ocupa bosques abiertos, bosques de galería, matorrales y manglares (Ridgely & Gwynne, 1989:181; Stiles & Skutch, 1989:184). En Surinam y Guyana se asocia a manglares y hábitats ribereños (Tostain et al., 1992; Haverschmidt & Mees, 1994:150). En Venezuela se encuentra desde tierras bajas hasta zonas de páramo, con registros incluso a 4.200 m (Meyer de Schauensee & Phelps, 1978:111). En Argentina ocupa bosques, sabanas y montes (de la Peña, 2020:96).
Migra usualmente en grupos pequeños y silenciosos (Stiles & Skutch, 1989:184), aunque puede observarse en gran número en Centro y Sudamérica (Wetmore, 1968:325; Hilty & Brown, 1986:217). La migración es predominantemente nocturna (Crawford & Stevenson, 1984:202), con pérdidas corporales superiores al 50% tras travesías oceánicas. Existen indicios de nomadismo posmigratorio asociado a brotes de orugas (Hamilton & Hamilton, 1965:419; Nolan & Thompson, 1975:496; Barber et al., 2008:2678) y tras huracanes en el noreste de EE.UU. (Veit & Petersen, 1993). Los migrantes orientales llegan a las zonas de cría a finales de abril–principios de mayo, mientras que los occidentales lo hacen 4–8 semanas más tarde, desde mediados hasta finales de mayo (Franzreb & Laymon, 1993:24). En otoño, los orientales parten entre finales de septiembre y principios de octubre, y los occidentales entre finales de agosto y mediados de septiembre (Potter, 1980:25). Las poblaciones orientales migran a Sudamérica vía Centroamérica y el Caribe, siendo más frecuentes en otoño que en primavera. La ruta de los occidentales es menos conocida, aunque probablemente siga la vertiente Pacífica de México y Centroamérica hasta el noroeste de Sudamérica (Friedmann et al., 1950:132; Monroe, 1968:328). La especie migra regularmente por el sur de Estados Unidos, Centroamérica y las Antillas, con registros en Puerto Rico, Jamaica y Costa Rica (Kepler & Kepler, 1978:418; Lack, 1976; Stiles & Skutch, 1989:184). En California llega a inicios de junio.
Distribución geográfica en Argentina (de la Peña, 1999:83; de la Peña, 2020:96; de la Peña, 2016:336; de la Peña et al., 2009:106; de la Peña, 2015:302).
Coccyzus americanus (Linnaeus, 1758) migratorio de Norteamérica. Llega hasta las provincias de Buenos Aires, Catamarca, Chaco, Córdoba, Corrientes, Entre Ríos, Formosa, Jujuy, Misiones, Salta, La Rioja, Santa Fe, Santiago del Estero, Tucumán y es visitante ocasional (errante) en las Islas Malvinas.Ecorregiones: Chaco Húmedo, Chaco Seco, Espinal, Selva de Yungas, Selva Paranaense.