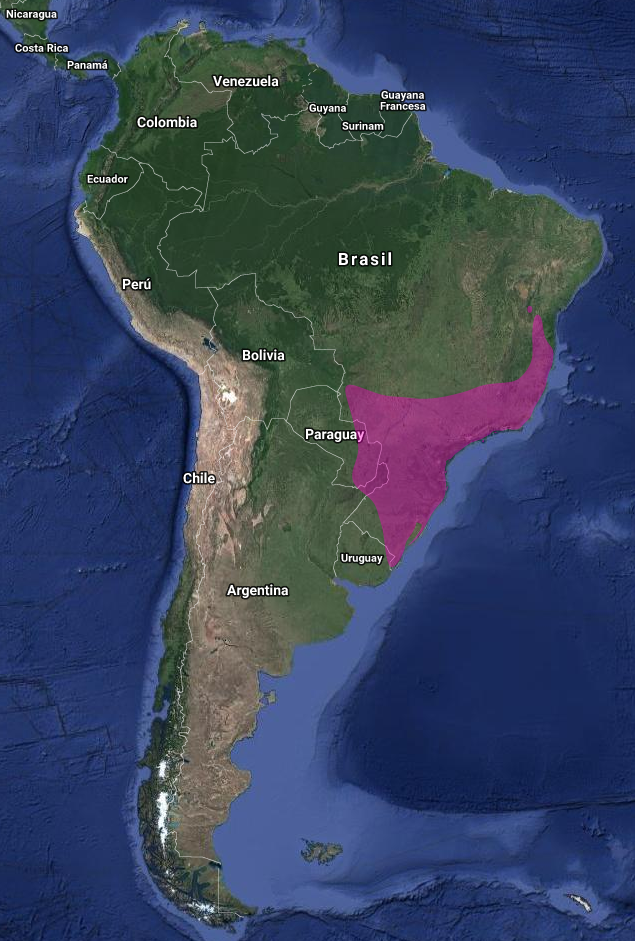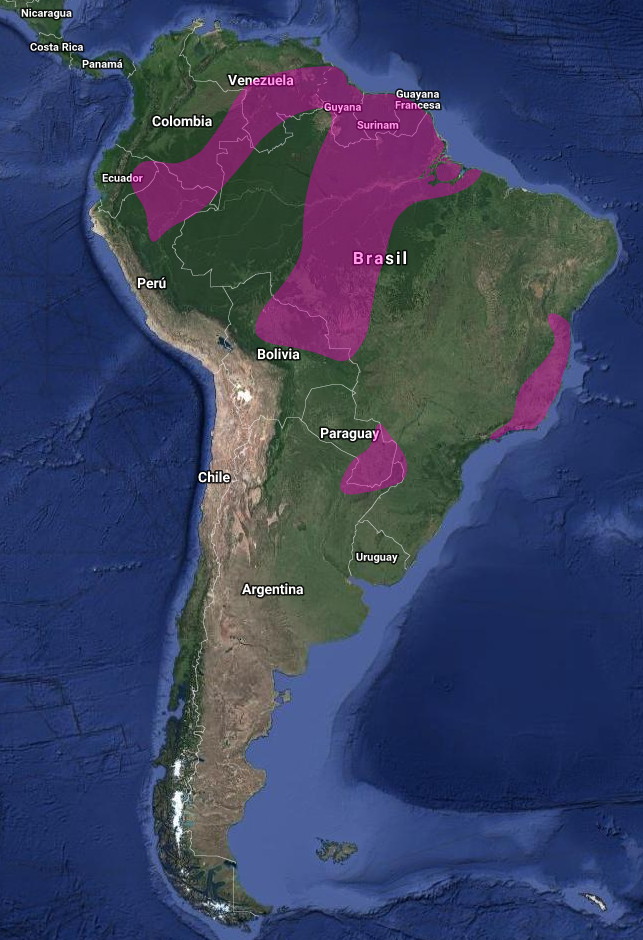
Endémico de Sudamérica (Short, 1975) con amplia área de distribución: este de Colombia hasta Surinam (Bangs & Penard, 1918; Shor,t 1975; Stotz et al., 1996) y Guayanas (Short, 1975; Stotz et al., 1996); sur de Venezuela (Nicaragua; Suapure; Mts. Auyan-tepui y Roraima)(Guilliard, 1941; Crease, 2009); sur y este de Ecuador (Short, 1975; Stotz et al., 1996); noreste de Perú (Zimmer, 1950; Short, 1975; Stotz et al., 1996); noroeste y norte y centro de Brasil –Manaos (Friedmann, 1948); noreste de Bolivia (Ruschi, 1967); sureste y centro de Paraguay donde se consideran los registros como “hipotéticos” por ser principalmente registros históricos, sin detalles que apoyen estas evidencias (Hayes, 1995; Brooks, Barnes, Bartrina, Butchart, Clay, Esquivel, Etcheverry, Lowen & Vincent, 1995); y este de Brasil (Cintra, 1990) y sur (dos Anjos & Ferreira, 1998; Short 1975) hasta noreste de Argentina
En Argentina: Aunque Olrog (1959) la cita para Misiones, Formosa, Chaco y Entre Ríos, en el Informe del Ministerio de Medio Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas del año 2015 “Categorización de las Aves de la Argentina”, afirman que su presencia en Argentina solo está basada en pocos registros observacionales, datos no publicados y/o evidencias no documentadas, es decir sin evidencia concluyente de su presencia en el país, por lo que la consideran como “especie hipotética para la República Argentina”.
Sin embargo Barnett & Pearman (2001) no lo consideran así y la incluyen en su Lista comentada de las Aves Argentinas.
Este de Chaco (Chatellenaz, 2005;), Formosa (según el autor, un único registro con presencia estacional indeterminada (López Lanús 1997);( De la Peña, 1999); Corrientes (De la Peña, 1999), Santa Fe, Entre Ríos – este registro necesita verificación- (Short, 1975), Santiago del Estero- Los Gallegos- (Quiroga, Capllonch, Pérez Bogado & Soria, 2016) y Misiones (Short, 1975; De la Peña, 1999, 2006); en Misiones (Saibene et al., 1996) la incluyen como “especie de presencia a confirmar en P.N. Iguazú”.
Aunque Chébez (1996) la cita con interrogantes en Iguazú y Gral Belgrano, unos años después en la «Guía para la identificación de las Aves de Iguazú», Narosky & Chébez (2002) no la consideran para esta localidad.
Ecorregiones: Selva Paranaense; Chaco húmedo (Barnett & Pearman, 2001)
Hábitat: Borde y dosel del bosque de tierras bajas, bosque secundario, sabana, plantaciones de café, más raramente en vegetación costera abierta y parece ser bastante numeroso en el centro urbano de Londrina en el sureste de Brasil (dos Anjos1998). También en isletas de monte y selva de galería (López Lanús, 1997)
Generalmente alrededor de 200–500 msnm, a veces hasta 1850 msnm (Tepuis) (Stotz et al., 1996)
Se alimenta a baja altura en la periferia de la vegetación (Stotz et al., 1996)