ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR
Especie con rango extremadamente amplio, por lo tanto no se aproxima a los umbrales de Vulnerabilidad bajo criterio de tamaño del rango (extensión < 20.000 km² combinado con declinación o fluctuación del tamaño del rango, extensión/calidad del hábitat, o tamaño de la población y número pequeño de localizaciones o fragmentación severa). Se desconoce la tendencia de la población, pero que no es lo suficientemente rápida como para alcanzar los umbrales de los criterios de tendencia de la población ( declinación > 30% en 10 años o 3 generaciones). El tamaño de la población no ha sido cuantificado, pero no se cree que que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (< 10.000 individuos maduros con una declinación continua estimada ( > 10% en 10 años o 3 generaciones, o con una estructura poblacional específica). Por estas razones la especie es considerada como: Preocupación menor
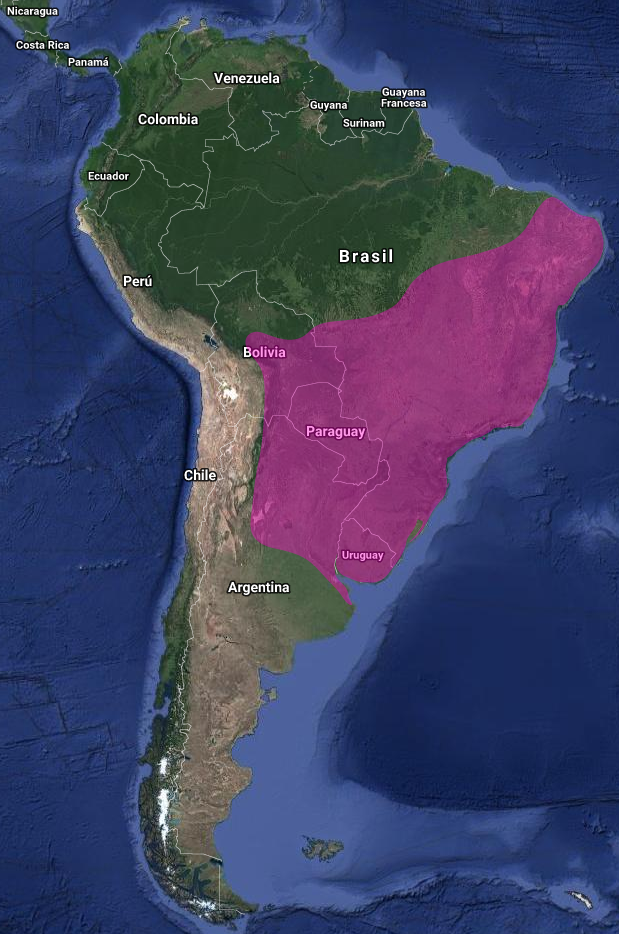
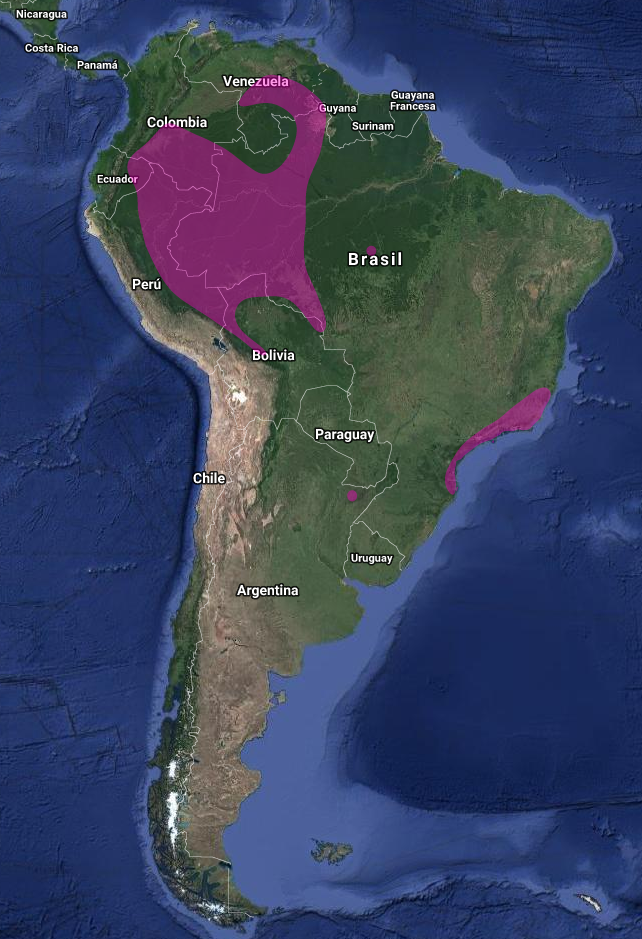
En Argentina: Acepta fácilmente hábitats artificiales, como jardines, parques y plantaciones. Dentro de su rango en Argentina, es la especie de colibrí más vista. Ocurre en una serie de áreas protegidas en toda la zona, como los Parques Nacionales Serra dos Orgãos, Serra da Capivara y Chapada dos Guimarães (Brasil) y la Reserva Ecológica Costanera Sur (Argentina).
MADS-AA-NA: No Amenazada según MADS&AA 2015 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas) Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 pp (2015)
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable) López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable) Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010