- Contenido restringido para suscriptores. Suscripción gratuita para acceso a la bibliografía completa y sus enlaces. Pinchar en "Ingresar" para crear su perfil de suscriptor
-
Jote cabeza negra | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR
Contaldi y colaboradores, concluyen, que con una población total estimada en 20 millones de individuos, se sabe que hoy sus poblaciones extremas se encuentran en proceso de expansión como consecuencia del impacto de la actividad antrópica en el ambiente a nivel local (mayor oferta de alimento y disminución en la persecución) o global (mayores temperaturas producto del cambio climático) (Contaldi et al., 2019:8)
Esta especie tiene un rango extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). La tendencia de la población parece estable, por esto esta especie no alcanza los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población es extremadamente grande, por lo tanto esta especie no se aproxima a los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como de “preocupación menor” (Stotz, 1996:142).
En Argentina (S.I.B.):
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable ). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas ).Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable ).Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza ). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Jote cabeza negra | Distribución
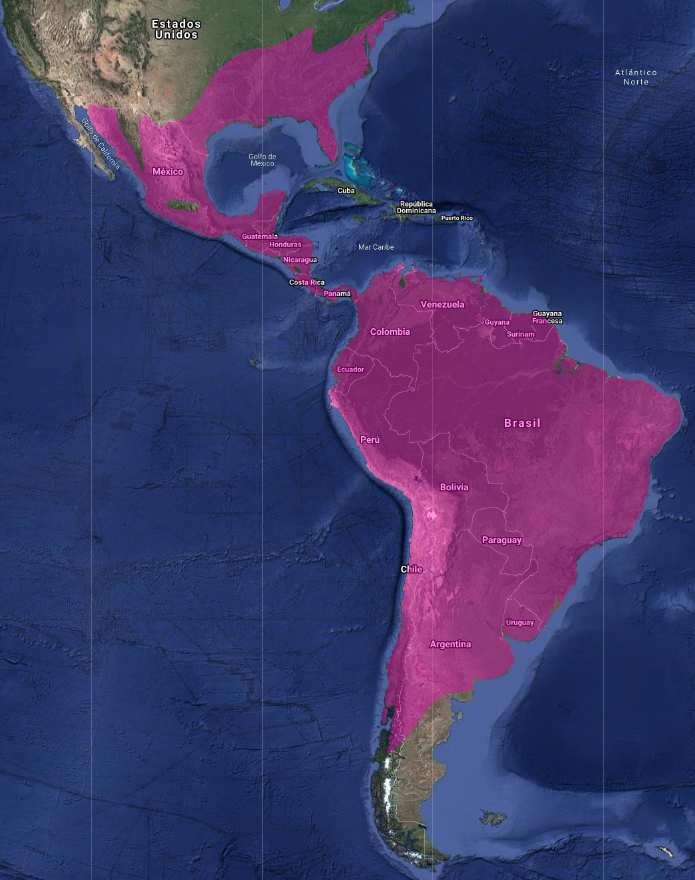
InfoNatura: Animals and Ecosystems of Latin America 2007 Se distribuye por todo el continente americano desde Canadá a Chile y Argentina. Parte oeste de Sudamérica hasta el sur de Chile y Argentina.
En Argentina: Jujuy, Salta, Tucumán, Catamarca, La Rioja, Santiago del Estero, Formosa, Chaco, Misiones, Corrientes, Entre Ríos, Córdoba, Santa Fe, La Pampa, Buenos Aires, San Luis, San Juan, Mendoza, Neuquén, Río Negro, Chubut y Santa Cruz (De la Peña, 1987:44-45); (De la Peña, 1999:37).HÁBITAT
Es la especie más difundida debido en gran parte a su adaptabilidad a diferentes entornos. Habita en lugares de poca vegetación (márgenes de bosques, orillas de ríos, y del mar), bosques, esteros y sabanas. También en zonas urbanas donde se le ve en los basureros.
Ecorregiones: Altos Andes, Bosques Patagónicos, Campos y Malezales, Chaco Húmedo, Chaco Seco, Delta e Islas del Paraná, Espinal, Estepa Patagónica, Esteros del Iberá, Monte de Llanuras y Mesetas, Monte de Sierras y Bolsones, Pampa, Puna, Selva de Yungas, Selva Paranaense. -
Jote cabeza negra | Comportamiento
Muy sociable. Los miembros de la familia mantienen relaciones de larga duración. Los miembros más cercanos de la familia mantienen contacto estrecho a lo largo del año (Rabenold, 1986:32); (Rabenold, 1987b:647); (Parker et al., 1995:395). Viven muchos años, con registros de longevidad de 16 años y 10 meses (Clapp et al., 1982:103)
Durante 3-4 meses después de emplumarse, el nido sirve de lugar de sociabilización diario para jóvenes y adultos (Rabenold, 1986:37). Más tarde, cuando la cría ya es mayor, se encuentran en los posaderos comunales y sitios de alimentación (Rabenold, 1986:37-38).
Los padres alimentan los pichones hasta 6 meses después de emplumarse (Jackson, 1975:603); (Rabenold, 1986:38).
Los juveniles y adultos mantienen contacto estrecho hasta la siguiente estación reproductiva, cuando los adultos se vuelven más agresivos y expulsan a los jóvenes del nido (Stewart, 1983:311).
Una vez separados de sus padres, los juveniles vagabundean entre los posaderos y durante algún tiempo siguen a los adultos (muchas veces intolerantes con ellos), de los cuales aún dependen para alimentarse (Rabenold, 1987a:650-652).
Durante este periodo de vagabundeo, los juveniles aprenden a alimentarse por sí mismos. Demoran mucho tiempo la reproducción (al menos 8 años) (Parker et al., 1995:395).
De manera constante constituyen alianzas, e interactúan entre varias parejas de adultos y sus crías, aparentemente de forma cooperativa en posaderos y carcasas (Parker et al., 1995:395). Existe una fuerte asociación entre el grado de relación genética entre los adultos y cómo ellos interactúan. Individuos que son genéticamente similares es muy probable que utilicen el mismo dormidero la misma noche, así como, el acicalamiento mutuo solo entre parientes (y parejas); se ha observado que las peleas son principalmente entre individuos aparentemente no relacionados (Parker et al., 1995:399).
A menudo, el Jote Cabeza Negra ocupa los posaderos comunales durante varios años, a veces décadas (Prather et al., 1976:668). Algunos son utilizados de forma permanente a lo largo del año, pero otros pueden utilizarse estacionalmente, o de forma temporal, cerca de fuentes de alimento eventuales (Sweeney & Fraser, 1986:24).
Cada individuo utiliza varios posaderos dentro del área de residencia, formando un sistema de posaderos (Stolen, 1996b). A menudo comparte dormideros con el Jote de Cabeza Colorada (Prather et al., 1976:668); (Buckley, 1997:267); (Buckley, 1998:124) y Caranchos (Caracara plancus) (Ng & Jasperson, 1984:214).
Los juveniles que aún son dependientes de sus padres muestran gran fidelidad con los posaderos, pero los mayores prefieren uno solo. Los adultos demuestran fidelidad intermedia (Rabenold 1987b:650).
Son comunes los enfrentamientos en los posaderos comunales. La agresión se dirige a los que no pertenecen al grupo, y los perdedores es poco probable que vuelvan (Rabenold 1987b:651). Los adultos que tienen sus nidos cerca de los posaderos, ganan más enfrentamientos que en posaderos más alejados (Rabenold 1987:651). De esta forma, los adultos que se reproducen localmente pueden controlar, parcialmente, el acceso a los posaderos de individuos que no pertenecen al grupo. Estas agresiones reducen las posibilidades que los adultos sean seguidos a las zonas de alimentación por los extraños y minimizar los costes de compartir alimentos con tales individuos (Rabenold, 1987b:651).
El Jote Cabeza Negra camina y corre bien, a veces con saltitos distintivos y las alas medio abiertas. Según Mahoney (1983, citado en Buckley 2020) corren a velocidades de alrededor de 6.6 km/h. A velocidades >7 km/h cambian de trote a galope, pero solo pueden mantener esta velocidad unos pocos minutos.
Un componente importante en su estrategia de búsqueda de alimento es el vuelo planeado energético-eficiente. Su habilidad para cubrir grandes áreas, de una manera eficiente desde el punto de vista energético, le permite obtener alimentos espacialmente impredecibles, como es la carroña (Parrott, 1970:363).
Generalmente corre 2-3 pasos para tomar el vuelo, aleteando si las termales son suaves. Utiliza el aleteo, normalmente, cuando se desplaza entre los posaderos y los sitios de alimentación conocidos (Kirk & Gosler, 1994:940); (Buckley 1997:267).
Se eleva a gran altura, volando en círculos, aprovechando las corrientes térmicas ascendentes y planea manteniendo las alas en línea horizontal (Pennycuick, 1983:324). Vuelo estable, alternando rápidas batidas de alas con periodos cortos de deslizamiento. En vuelo, cabeza negra, puntas de alas blancas, cola corta en forma de abanico.
Su vuelo es menos eficiente que el de otros buitres ya que las alas no son tan largas por lo que tiene menor superficie para planear. Regurgita cuando se le acercan o es molestado, con lo que disuade a sus predadores y emprende vuelo más fácilmente al disminuir su peso.En tierra tiene el hábito de “urohidrosis”: orina y defeca en sus patas para que se enfríen por evaporación. Tienden a alimentarse durante el día, volviendo a sus dormideros por la noche.
Al carecer de olfato son más gregarios y por lo general dependen de su vista para distinguir animales inmóviles desde cientos de metros de altura. Planea alto aprovechando corrientes térmicas, a menudo con otras aves grandes como Jabirúes (Jabiru mycteria), Tuyuyúes (Mycteria americana) y Chajáes (Chauna torquata) (Di Giácomo & Krapovickas, 2005:227).
Tiene buena relación con el hombre. Puede ser domesticado. Desempeñan importante labor sanitaria por su capacidad de eliminar deshechos de la actividad humana. Se ha demostrado que los microbios del carbunclo y cólera son destruidos en el aparato digestivo del Jote.
Se ha registrado casos de acicalamiento a Caracara plancus (Carancho) en un posadero (Ng & Jasperson, 1984:214) y en carcasas (Haverschmidt, 1977:392); (Silva & Carmo, 2015:22); (Souto et al, 2009:1). El acicalamiento probablemente estrecha las relaciones sociales entre individuos de la especie, pero no se explica cuando se dirige a otras especies. El acicalamiento a Caranchos puede ser un error, o tal vez reduce la agresividad de estos últimos.
El acicalamiento se realiza de forma generalizada (Haverschmidt, 1977:392); (Rabenold, 1986:33); (Stolen, 1996b) entre parejas, familiares, crías y hermanos (Rabenold, 1986:37); (Parker et al., 1995:399), en zonas que no pueden alcanzar con facilidad. Generalmente en los posaderos, pero también en carcasas (Rabenold, 1986:37); (Stolen, 1996b).
Se baña en aguas poco profundas (Rea, 1983: 42); (Sazima, 2011:81)
Suelen ser más tolerantes con otros individuos que nidifican en las cercanías como el Jote Cabeza Colorada (Jackson, 1983); (Stewart, 1974:598); (McHargue, 1977; citado en Buckley, 2020)ALIMENTACIÓNOportunista, se alimenta fundamentalmente de carroña de grandes animales, aunque puede comer todo tipo de cadáveres (Stewart, 1978:79); (Coleman & Fraser, 1987:733); (Rabenold, 1987a:1775); (Buckley, 1996:480). Ocasionalmente consume presas vivas. En un análisis de egagrópilas del área periurbana de Dina Huapi (Río Negro, Argentina), realizado por Ballejo & De Santis, (2013:13), los autores encontraron, además de restos orgánicos, otros sintéticos como restos de bolsa de polietileno, fragmentos de plástico, goma elástica, cartón, fragmento de tela, cuerda, tanza de pesca, fragmento de baldosa, pintura sintética y otros restos indeterminados.
El bulbo olfatorio del Coragyps atratus está menos desarrollado que el del Cathartes aura (Bang, 1964:155); (Bang & Cobb, 1968:58) y a diferencia del Cathartes aura, el Coragyps atratus no utiliza el olfato para localizar los cadáveres (Stager, 1964:55).
Por lo tanto el Cathartes aura es más eficiente al localizar los restos y casi siempre precede a los Coragyps atratus, por lo que dependen de ellos para encontrar alimentos (Stewart, 1978:82); (Houston, 1986:318); (Houston, 1988:405); (Buckley, 1996:473); (Buckley, 1997:267); (Stolen, 1996:43)
Una vez localizado el cadáver, los Coragyps atratus se acumulan rápidamente y desplazan a los Cathartes de la comida (Stewart, 1978:82); (Wallace & Temple, 1987:292); (Houston, 1988:405); (Stolen, 1996:43); (Buckley, 1997:267).
Dado que su estrategia de alimentación se basa en mantener a los otros depredadores a la vista, los C. atratus vuelan más alto que los Catharthes (Stewart, 1978:82); (Houston, 1988:405); (Buckley, 1996:473); (Stolen, 1996:43). Utilizan las térmicas para ganar altitud, y llegan a alcanzar alturas hasta de ≥300 m (Houston, 1988:405).
Los estudios de Rabenold (1987a:1775) y Buckley (1997:267) han demostrado que posado comunal del C. atratus juega un papel importante en su comportamiento de alimentación, dado que puede facilitar la formación de grupos para la búsqueda de alimentos (Rabenold, 1987a:1775); (Buckley, 1996:486), existiendo además, fuertes evidencias que estos grupos funcionan como centros de información (sitio de posado comunal donde se intercambia la información sobre la localización de los alimentos) (Ward & Zahavi, 1973:517).
Los Jotes de Cabeza Negra no pueden abrir carcasas grandes por sí solos, dependen de los grandes carroñeros, que sí lo pueden hacer. Al contrario que el Cathartes aura, el cuál generalmente coloca uno o dos pies sobre la presa para comer, el Coragyps atratus no suele utilizar las patas (Houston, 1988:7).
Cuando la carcasa está suficientemente abierta, pueden extraer las vísceras; esto desemboca en un gran ajetreo de pájaros que rápidamente tiran de ellas para engullir los trozos.
Comen rápidamente (intervalo medio entre picotazos 4.52 s ± 0.8 SE, n = 126 (Houston, 1988:410), mientras que el Cathartes aura es más lento (intervalo medio entre picotazos 6.96 s ± 1.1 SE, n = 131), en parte porque ellos pasan más tiempo en posición alerta. Los Coragyps dependen muy estrechamente de los miembros de su grupo para alertar de la inminente llegada de predadores (Houston, 1988:411), y por ello son capaces de alimentarse más eficientemente.
Sus métodos de alimentación son: 1) picoteando pequeños trozos diseminados alrededor y sobre la carcasa; 2) tirando de tejido muscular laxo o vísceras; 3) Desgarrando tendones de los huesos; 4) desgarrando trozos de piel (Houston, 1988:408).Ocasionalmente atacan y matan animales domésticos, incluso cerdos recién nacidos (Lovell, 1947:131); (Parmalee, 1954:445); corderos (Roads, 1936:219); (Sprunt, 1946:260) y terneros (Parmalee, 1954:445).
Se alimenta sobre el suelo, aunque también a orillas del agua, por carroña o peces pequeños (Jackson et al, 1978:142).
También se los ha citado cazando y comiendo: pichones de Garza Bruja (Nycticorax sp), mofetas y zarigüeyas (McIlhenny, 1939:472), crías de Tortuga Laúd (Dermochelys coriacea) (Mrosovsky, 1971:672). Individualmente atacan pequeños animales, pero los de mayor tamaño lo hacen en grupo. Se los ha citado, comiendo estiércol y material vegetal (McIlhenny, 1945:137). En Surinam, consumen frutos (dañados durante la cosecha) de cocoteros (Cocos nucifera) y Palmera africana (Elaeis guineensis) (Haverschmidt, 1947:210); (Elias & Valencia, 1982:214). En América Central y Sudamérica, generalmente buscan la comida en las ciudades, en vertederos y basura de las calles (Iñigo Elías, 1987:7); (Hill & Neto, 1991:173).
Se lo ha registrado alimentándose de cadáveres de animales silvestres: Mulita grande (Dasypus novemcinctus), Gualacate (Euphractus sexcinctus), Zorro de monte (Cerdocyon thous), Lobito de río (Lontra longicaudis), Coatí (Nasu nasua), Aguará-popé (Procyon cancrivorus), Tapir (Tapirus terrestres), Pecarí de collar (Pecarí tajacu), Ciervo e los pantanos (Blastocerus dichotomus), Guazuncho pardo (Mazama gouazoupira), y Carpincho (Hydrochaeris hydrochaeris). También en cadáveres de grandes aves como Ñandú (Rhea americana), Cigueña americana (Ciconia maguari) y grandes reptiles como Yacaré (Caimán sp.), Curiyú (Eunectes notatus) y Ñacaniná (Hydrodynastes gigas). Peces muertos como Tarariras (Hoplias Malabaricus) y Bagres sapos (Rhamdia quelen). Restos de placentas de pariciones del ganado (Di Giácomo & Krapovickas 2005:227); Huevos de Flamenco austral (Phoenicopterus chilensis) (De la Peña, 2020:14-15). Se han registrado individuos comiendo de bloques de sal (Coleman et al., 1986:281).
No almacenan alimentos pero, visitan de forma repetitiva la misma carcasa durante varios días. Este hábito les permite a aquellos ejemplares que no conocían la localización, descubrirlas con solo seguir a sus con-específicos desde los posaderos (Rabenold, 1987a:1775); (Buckley, 1997:267).VOCALIZACIONESLos Jote Cabeza Negra carecen de siringe y musculatura asociada (Ligon, 1967:19) y por lo tanto solo pueden emitir un número limitado de sonidos.
Los más comunes son silbidos y gruñidos que se escuchan fundamentalmente al comer y volar.
Los “gruñidos” suenan como cuando los perros comen (Baynard, 1914b; citado en Buckley, 2020) o “guff, guff, guff” similar a cuando los perros ladran a la distancia (Saunders, 1906;166).
Los adultos producen un silbido cuando son molestados al comer o en sus nidos (Baynard, 1914; citado en Buckley, 2020).
Sonidos no vocales
Cuando descienden a comer, a menudo lo hacen en ángulo agudo que genera un silbido (Thurber 1981:97).
REPRODUCCIÓNMonógamos; se emparejan para toda la vida (Rabenold, 1986:34); en un estudio realizado en el norte del estado de Carolina, registró que las parejas se mantenían al menos 12 años, y solo se reemplazaban después de la muerte de uno de ellos (Decker et al. 1993:29). Estudios de ADN realizados sobre huellas de 16 familias nucleares, de 32 individuos en reproducción y 36 crías, no revelaron evidencias de paternidad fuera de la pareja; estos resultados indican que las parejas son estrictamente monógamas (Decker et al., 1993:29).
Las parejas mantienen el contacto estrecho a lo largo de todo el año. Suelen posarse cerca del sitio probable antes de la nidificación (Stewart, 1983:310); (Jackson, 1983 y 1988; citado en Buckley, 2020); este comportamiento, el cual puede comenzar unas 4-6 semanas antes de depositar los huevos, puede permitirles valorar la calidad del sitio y la ausencia de elementos perturbadores a su alrededor (Stewart, 1983:310).
En temporada reproductiva, varios autores han descrito vuelos aparentemente de cortejo; un individuo (aparentemente el macho) persigue a la hembra en el aire y periódicamente se lanza hacia ella (Bent, 1937:28-29); (Stolen, 1996b; citado en Buckley, 2020). El macho capta la atención de la hembra volando en círculos, con el cuello estirado hacia delante, mientras exhala profundamente; otra danza ritual consiste en enfrentarse uno a otro en un alarde arriba-abajo con el pico abierto (Rea, 1983; citado en Buckley, 2020); en esta danza, mantienen las alas totalmente desplegadas, alternando con saltos y emisión sonidos similares a “ladridos” (Rabenold, 1986:38)
No construye nido. Deposita directamente los huevos en el lugar elegido y utiliza una gran variedad de sitios de nidificación, como cuevas, huecos oscuros en troncos de árboles y tocones, grietas entre las rocas (Coleman & Fraser, 1989b:21), arbustos y matorrales, edificios abandonados, rascacielos (Hill and Neto 1991:173), etc. (Marchant 1960:360-362); (De la Peña, 2013:88).
En Argentina se reproduce desde fines de julio a mediados de diciembre. Lo hace en huecos de árboles y a veces sobre el suelo en un lugar protegido y oculto. Se encontraron nidos hasta los 6 ó 7 m de altura. Donde depositan los huevos pueden agregar trocitos de corteza o algunos pequeños palitos. En nidos en los pastizales agregaron pastos y trocitos de estiércol seco. Se localizaron nidos en Tucumán, Formosa, Chaco, Misiones, San Juan, Mendoza, La Pampa, Santa Fe, Córdoba, Buenos Aires, Neuquén, Río Negro (De la Peña, 2020:15); (Lucero, 2020:40); (Di Giácomo & Krapovickas 2005:227).
Los sitios de nidificación seguros, frecuentemente son utilizados durante varios años seguidos (Jackson, 1988; citado en Buckley, 2020).
Pone 2-3 huevos, en días consecutivos (Stewart, 1974:596), alternos o con intervalos de 2-3 días (Baynard, 1909; citado en Buckley, 2020). Existen numerosos registros de reemplazo de una nidada perdida (3-4 semanas después) con una nueva puesta (Hill & Neto 1991:175).
La forma de los huevos varía entre ovalado, elíptico o ovoide elongado (raro fusiforme) (Bent, 1937:32). El tamaño de los huevos del C. a. foetens: 2 huevos medidos en Argentina: 74.5 x 45.0 y 72.0 x 47.0, respectivamente (Wetmore, 1962:4).
El color de fondo es variable entre blanco, blanquecino, blanco grisáceo, cremoso, celeste pálido o celeste verdoso pálido, con manchas castañas, violáceas, pardas o negruzcas y pintas grises. Algunos con pocas pintas y manchas. A veces las manchas más concentradas en el polo mayor (Bent, 1937:32-33).
Stewart observó que la incubación comenzaba con la puesta del primer huevo.
En cuanto al periodo de incubación existen numerosas reseñas, pero las más convincentes sugieren que es de 38-39 días (Stewart, 1974:599).
El autor (Stewart, 1974:596) comenta que, los adultos ocasionalmente pierden el rastro de sus huevos durante la noche, con el consiguiente enfriamiento, lo que podría contribuir a la variación en los registros de periodos de incubación. La eclosión puede ser el mismo día, o hasta 3 días después (Stewart, 1974:596).
Ambos padres comparten la incubación por igual, alternándose cada 24 hs (Stewart, 1974:596 y 600).
Mantienen los huevos en la parte superior de los dedos de los pies, dando pequeños pasos y arrastrando los pies debajo de ellos. También utilizan la mandíbula para posicionar los huevos, particularmente para que estén más próximos entre sí; utilizan el pico para recuperarlos cuando salen de esta posición (Stewart, 1974:596).
El primer signo de eclosión es la aparición de una protuberancia cercana al extremo mayor (Bent, 1937:33); la cría extiende la brecha y fuerza la rotura de la cáscara. Este proceso completo puede tardar hasta 24 hs o más.
Nacen cubiertos de abundante plumón de color beige; ojos oscuros y piel desnuda de la cara de color negro (Bent, 1937:32); pesan aproximadamente 70 g (McHargue, 1981:182).
De crecimiento relativamente lento, el peso asintótico se alcanza alrededor de los 60-65 días (McHargue,1981:182); (Coleman & Fraser,1989a: 200-201). Este crecimiento lento puede ser una adaptación a los aportes impredecibles de alimentos debido a las condiciones climáticas (McHargue, 1981:182).
Los autores creen que el mejor predictor de la edad es la medición del ala a los 80 días de edad, ya que es menos variable que el peso (Coleman & Fraser, 1989a:201); (Stewart, 1974:598)
Las alas completamente emplumadas a los 65 días y han desarrollado las plumas del dorso y pecho, pero aún están cubiertos con plumón en zona inferior y cuello. A los 79 días ya están completamente emplumados con algo de plumón presente aún en pecho y vientre (McHargue, 1981:182).
El primer vuelo es alrededor de los 75-80 días (Stewart 1974:598). Una vez que pueden volar, los juveniles suelen permanecer en las cercanías del nido durante alrededor de 10 días antes de abandonar a sus padres.
Los padres cuidan a sus crías continuamente durante los primeros días después de la eclosión (Stewart 1974:596). Mientras aún son pequeños, los cubren con el pecho, pero al crecer son cubiertos con las alas (Stewart, 1974:597).
La frecuencia de estos cuidados disminuye a partir de los 14 días, ya que los polluelos, a esta edad,parecen ser capaces de regular independientemente la temperatura. Stewart observó que en algunos casos el cuidado diurno continuaba hasta los 24 días y hasta 43 días durante las noches, cuando ya los adultos dejan de pasar la noche en el nido.
Cuando son pequeños, son alimentados frecuentemente por regurgitación directamente desde el pico de los padres (15-20 sesiones diarias). En base a sonidos, se cree que también son alimentados por la noche. Alrededor del día 14 comienzan a recibir alimentos sólidos, que aún toman del pico de los adultos. A medida que crecen, los padres pasan largos periodos fuera del nido y alimentan a los pichones solo 2-4 veces al día; solo los días en que las condiciones para el vuelo no son adecuadas (días lluviosos), pueden no alimentarse para nada (Stewart, 1974:597); (McHargue, 1981:182).
Cuando son pequeños, los padres normalmente inician la alimentación extendiendo hacia ellos el pico (Stewart, 1974:597), sin embargo, al crecer los jóvenes solicitan activamente comida a sus padres emitiendo silbidos agudos, moviendo sus cabezas, extendiendo parcialmente las alas y pateando con los pies (McHargue, 1977:328).
A los 21 días ya tienen incorporado el mecanismo de urohidrosis (McHargue, 1981:182).
El periodo de dependencia de los juveniles es largo. La alimentación por los padres continúa hasta 5 semanas después de emplumarse y solicitan comida hasta 15 semanas después (McHargue, 1977:328).MIGRACIÓN
Residente a lo largo de casi toda su distribución, aunque en invierno muchos individuos se retiran de las zonas extremas del norte y de las grandes altitudes. Por ejemplo, en Missouri, migran hacia el sur desde mediados de octubre a noviembre, y permanecen ausentes hasta febrero o principios de marzo (Robbins & Easterla, 1992:61); (Vickery, 1982:152); (Yee et al., 1994:82).
También realizan movimientos locales, de corta duración, cuando el tiempo es desfavorable y retornan cuando cambian las condiciones climatológicas (Eisenmann, 1963:244); (Skutch, 1969:731); (Wetmore, 1965:161). -
Jote cabeza negra | Taxonomía
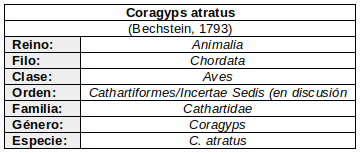
* Los Jotes o Buitres americanos integrantes de esta familia son elevados a un Orden separado: Cathartiformes. Propuesta aceptada por el SACC (South American Classification Committee) Considerado Monotípico por Friedmann (1950:19-30), la American Ornithologyst Union (1957) y Stresemann & Amadon (1979:275). Sin embargo Wetmore (1962:1-4) y Blake (1977; citado en Buckley, 2020: https://doi.org/10.2173/bow.blkvul.01) reconocen 3 subespecies. Su validación requiere futuros estudios de algunas de las características, (no cuantificadas), utilizadas para diferenciar las subespecies (Buckley, 2020: https://doi.org/10.2173/bow.blkvul.01)
SUBESPECIES (Según Wetmore, 1962:1-4)
- C.a. atratus (Bechstein, 1793); “buitre negro de Norteamérica” (México, Tejas y Sur de EEUU)
- C.a. brasiliensis (Bonaparte, 1850); “Buitre negro de América del Sur” (América Central, y norte de América del Sur)
- C. a. foetens (Lichtenstein, 1817); “Buitre negro andino” (Zona andina, desde norte Ecuador, Bolivia, Paraguay, Uruguay, Argentina y tierras bajas de Chile)
-
Jote cabeza negra | Descripción
-
Jote cabeza negra (Coragyps atratus)

Illustrations of the American ornithology of Alexander Wilson and Charles Lucian Bonaparte (1835) NOMBRES COMUNES: Zamuro (Venezuela), Zopilote, Zopilote negro ó Nopo (México y El Salvador), Zopilote o Zote (Honduras), Sucha (Bolivia), Gallote o Gallinazo (Panamá), Zopilote o Zoncho (Costa Rica y Nicaragua), Chulo, Golero o Gallinazo (Colombia), Gallinazo (Perú), Gallinazo Negro (Ecuador), Jote (Chile y Argentina), Cuervo o Buitre negro (Argentina y Uruguay), Yrivu (Paraguay, sur y centro de Brasil), Urubu (Brasil); En guaraní ” yryvu”
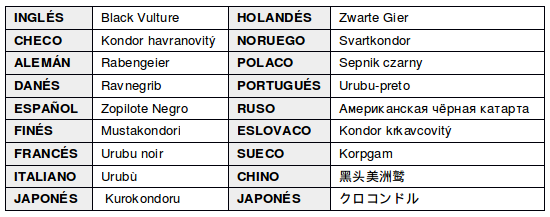
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS
- A general history of birds. (1821-1828). Latham, John. Winchester [England]: Printed by Jacob and Johnson, for the author: sold in London by G. and W.B. Whittaker. Vol 1: 14-15
- Planches enluminées d’histoire naturelle. (1765-1783). Martinet, François Nicolas, Buffon, Georges Louis Leclerc, comte de, Daubenton, Edme Louis, Daubenton, M. Paris?:s.n., 1765-1783. Vol 2: ilustración 187. (Vautour du Brésil)
- Travels through North & South Carolina, Georgia, east & west Florida, the Cherokee country, the extensive territories of the Muscogulges, or Creek Confederacy, and the country of the Chactaws. Bartram, William. (1793). Dublin,For J. Moore, W. Jones, R. MʾAllister, and J. Rice. Pág. 285. (Vultur atratus)
- Apuntamientos para la historia natural de los páxaros del Paragüay y Rio de la Plata. (1802). Azara, Félix de. Madrid Imp. de la Viuda de Ibarra (1802-1805). Tomo 1: 19 (Iribú)
- Histoire naturelle des oiseaux de l’Amérique Septentrionale : contenant un grand nombre d’espèces décrites ou figurées pour la première fois. (1807). Vieillot, L. P., Bouquet, engraver, Langlois, Pierre Gabriel, printer, Jean Gabriel, , illustrator . A Paris: Chez Desray:1807. Vol 1: 23 (Vultur urubu)
- Dictionnaire d’histoire naturelle. (1816). Paris, Chez Deterville. Vol 12: 401 (Catharista urubu)
- Tableau méthodique des ordres, sous-ordres, familles, tribus, genres, sous-genres et races d’oiseaux. (1831). Lesson, R. P. (René Primevère), Prêtre, J. G., ilustrador. Bruxelles: Chez F.G. Levrault ; Vol 1: 27-28 (Cathartes urubu)
- llustrations of the American ornithology. (1835). Alexander Wilson, Charles Lucian Bonaparte, Turvey, J.; Edimburgh, Frazer & Co.
- Voyage dans l’Amérique méridionale : (le Brésil, la république orientale de l’Uruguay, la République argentine, la Patagonie, la république du Chili, la république de Bolivia, la république du Pérou), exécuté pendant les années 1826, 1827, 1828, 1829, 1830, 1831, 1832, et 1833. (1835-1847). D’Orbigny, Alcide Dessalines d’, Bibron, Gabriel, Blanchard, Emile, Brullé, Gaspard Auguste, Gervais, Paul, Guizot, François, Martius, Karl Friedrich Philipp von, Milne-Edwards, H. (Henri), Montagne, Jean François Camille, Valenciennes, M. Paris: Chez Pitois-Levrault et ce., libraires-éditeurs, rue de la Harpe, no. 81; Vol 4: 31-38 ; Ilustración 1: fig 1 y 2 (Cathartes urubu)
- The birds of America: from drawings made in the United States and their territories. (1840-1844). Audubon, John James, Bowen, John T., lithographer. New York: J.B. Chevalier. Vol 1: 17- 20; ilustración Nº 3 (Cathartes atratus)
- The genera of birds : comprising their generic characters, a notice of the habits of each genus, and an extensive list of species referred to their several genera. (1849). Gray, George Robert, Hullmandel, Charles Joseph, impresor de las ilustraciones. Mitchell, D. W. (David W.), ilustrador. Hullmandel & Walton, impresor de las ilustraciones. London: Longman, Brown, Green, and Longmans. Vol 1: ilustración 1, página 4. (Cathartes foetens)
- Conspectus generum avium. (1850-1857). Bonaparte, Charles Lucian. Lugduni Batavorum :Apud E.J. Brill,. Vol 1: 2. (Vultur atratus)
- American ornithology. (1871). Wilson, Alexander, Baird, Spencer Fullerton, Bonaparte, Charles Lucian. Philadelphia: Porter & Coates. Vol 1-2 (Atlas c-2) (Black vulture)
- Zur Ornithologie Brasiliens: Resultate von Johann Natterers Reisen in den Jahren 1817 bis 1835. (1871). Pelzeln, August von, Natterer, Johann. Wien: A. Pichler’s Witwe & Sohn. Pág. 1 (Cathartes foetens)
- Catalogue of the Birds in the British Museum. (1874-98). British Museum (Natural History). Department of Zoology. [Birds]. London. Vol 1: 24 (Catharistes atratus)
