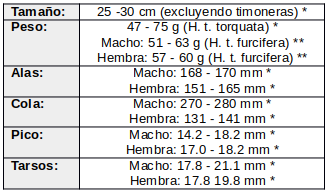
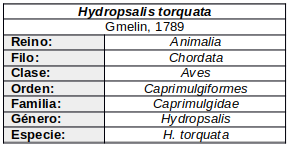
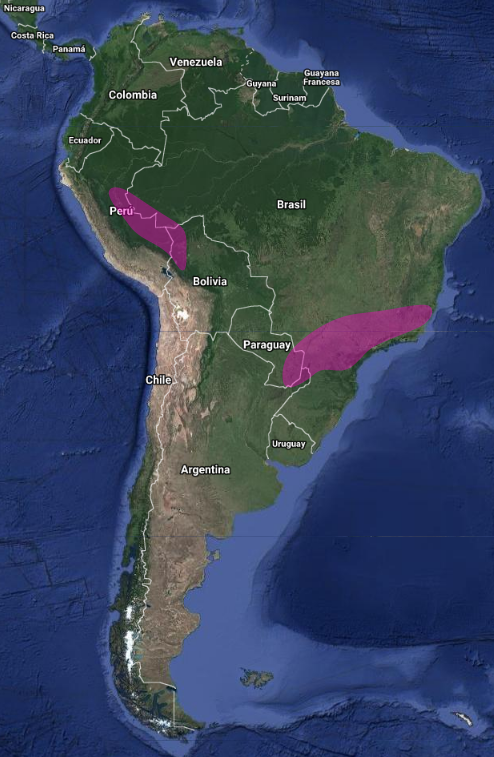
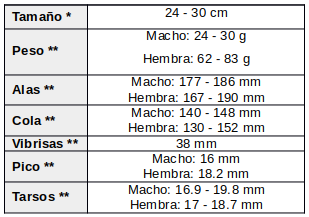
Poco estudiado.
Es una especie habitante de sabanas, bosques abiertos, selvas ribereñas y forestaciones, avistado solitario o en pareja.
Hábitos crepusculares y nocturnos, con incursiones para alimentarse desde perchas o desde el suelo (Sick, 1997:414; Cleere 1998:289; Ingels et al., 1999:565; de la Peña, 2020:239). Durante el día descansa a la sombra, en el suelo desnudo de sectores boscosos o con matorrales (Contreras et al., 2014:315), solo o en grupos de hasta 3 individuos (Wetmore, 1926:205).
Territorial, aunque no existen datos publicados (Cleere, 1998:289).
Vuelo errático (de la Peña, 2020:239; Wetmore, 1926:205) durante 20-30 m, antes de descender al suelo, detrás de la vegetación o sobre una rama o un tronco (Wetmore, 1926:205; Belton, 1984:563).
Cuando es perturbado se mueve bruscamente y abre y cierra la boca (Wetmore, 1926:205).
VOCALIZACIONES
El canto (al amanecer y atardecer) se describe como, una secuencia prolongada de repetitivos “tsip” (una nota por segundo, como un grillo) (Sick, 1997:413; Wetmore, 1926:205), que emite encaramado en ramas bajas y ocasionalmente en vuelo, al atardecer o amanecer (Ingels et al., 1999:565). También un débil «ti», aparentemente acompañado de un áspero “rhi rhi-grrr” (mecánico?) (Schulenberg et al. 2010:202). En Brasil, los cantos son más frecuentes después de fuertes lluvias y ligados a actividades reproductivas (Sick, 1997:413).
Sonidos no-vocales
Producen ruidos al batir las alas, volando durante el cortejo o en defensa del territorio (Wetmore, 1926;205; Sick, 1997:420; Cleere, 1998:289; Belton, 1984:563).
ALIMENTACIÓN
Insectívoro. La dieta incluye escarabajos (Coleoptera), polillas (Lepidoptera), moscas (Diptera), crisopas (Neuroptera), chinches (Hemiptera), hormigas (Formicidae), avispas (Chrysididae), abejas (Himenoptera), saltamontes, grillos, langostas (Orthoptera), termitas (Isoptera), cucarachas (Blattodea), mantis religiosas – Mamboretá (Mantodea), y cigarras (Cicadidae) (Alabarce, 1990:93; Cleere, 1998:289; de la Peña, 2020:239).
REPRODUCCIÓN
Existe escasa información sobre su biología reproductiva. Existen registros en el sur de Brasil de septiembre a diciembre (Belton, 1984:563); en Argentina desde principios de octubre a finales de diciembre (de la Peña, 1987:92; de la Peña, 2013:196; Pautasso & Cazenave, 2002:100).
Durante el cortejo, el macho estira las alas casi directamente hacia arriba, y luego los cierra rápidamente, produciendo una serie de hasta cinco «sonidos repetidos rápidamente entre un golpe y un broche de presión» (Belton, 1984:563).
No construye nido, depositando los huevos directamente en el suelo (sobre la tierra u hojas y pequeñas ramas secas) de praderas y claros de monte, alejadas de fuentes de agua y orillas de caminos (Contreras et al., 2014:315).
Puesta de 2 huevos, castaño pálidos, blanco-cremosos, o beige-rosados, salpicados en toda la superficie con pequeñas manchas, pintitas y líneas de tonos ocres y pardos (Belton, 1984:563; de la Peña, 1987:92; de la Peña, 2013:197; Cleere, 1998:289; Pautasso & Cazenave, 2002:100). (Lámina V (fig.5) (Aplin, 1894:149)
En Argentina, Pautasso & Cazenave (2002:100) comentan que » Los nidos estaban localizados en zonas alejadas de cuerpos de agua, en áreas topográficamente elevadas (e.g., albardones interiores).
Período de incubación 18-19 días. Los pichones permanecen 12-13 días en el nido. Nacen con los ojos abiertos, pico negro, interior de la boca y paladar de color rosa, iris pardo oscuro y patas negruzcas. Cuerpo cubierto de plumón pardo acanelado con líneas pardo negruzcas y grisáceas distribuidas por todo el cuerpo. Ventralmente pardo. Los pichones tienen un desarrollo rápido. Al segundo día si son molestados corren por el suelo y a los 12-13 días dejan el nido. (De la Peña, 2013:196-197; Pautasso & Cazenave, 2002:101).
La hembra, como aptitud de agresividad, vuela cerca y abre las alas y la boca. Emite un grito ronco, áspero. Se puede posar en troncos o ramas bajas, mueve la cabeza hacia arriba y abajo y realiza movimientos acompasados de la cola (De la Peña, 2013:197). de la Peña (2020:239), observa maniobras de distracción de la hembra, mientras está en el nido, en las que aparenta estar herida mientras agranda la zona gular.
Las hembras se encargan de la incubación y cría (En dos ocasiones se realizaron observaciones crepusculares y nocturnas de la hembra capturando insectos y alimentando a los pichones) (Pautasso & Cazenave, 2002:101-102).
Los autores Pautasso & Cazenave (2002:102) no observaron a los machos cerca de los nidos en ninguna oportunidad, por lo que se supone que no participaron, al menos activamente, de la cría, solo en comportamientos de defensa y distracción; observaron maniobras de distracción, que registraron en los últimos días de incubación y durante la cría de los pichones que consistían en alejarse del nido unos pocos metros, en vuelo rasante al suelo; luego se asentaba en un lugar, aleteaba contra el piso y abría la boca ampliamente, momento en que emitía una voz ronca, breve y no muy perceptible. Otro comportamiento consistió simplemente en desplegar las alas y caminar alrededor del nido (Pautasso & Cazenave, 2002:102).
En ningún caso se observaron comportamientos agresivos entre adultos de la misma especie (Pautasso & Cazenave, 2002:103).
Para más detalles ver Pautasso & Cazenave, 2002.
Nidificación en Argentina
Se localizaron nidos en las provincias de Salta, Tucumán, Mendoza, Catamarca, Córdoba, Santiago del Estero, La Pampa, Misiones, Santa Fe, Entre Ríos y Buenos Aires de septiembre a febrero. En el suelo, en praderas o claros en los montes (de la Peña, 2020:240).