- Phaethornithinae que incluye a los ermitaños. Tienen los tres dedos delanteros pegados en la base. También poseen plumas de dirección (timoneras centrales) extremadamente alargadas.
- Trochilinae que incluye a los colibríes. Tienen dedos separados. Sus plumas de la cola (timoneras centrales) no alargadas.
En Misiones encontramos 16 géneros y 24 especies:
Picaflor negro (Florisuga fusca)
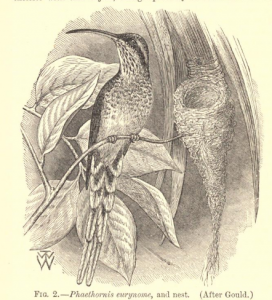
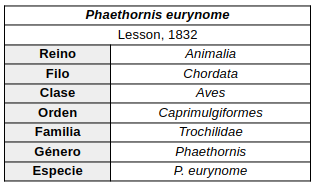
Emitaño escamado (Phaethornis eurynome)
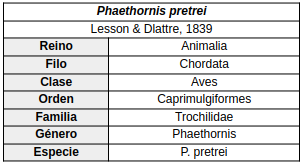
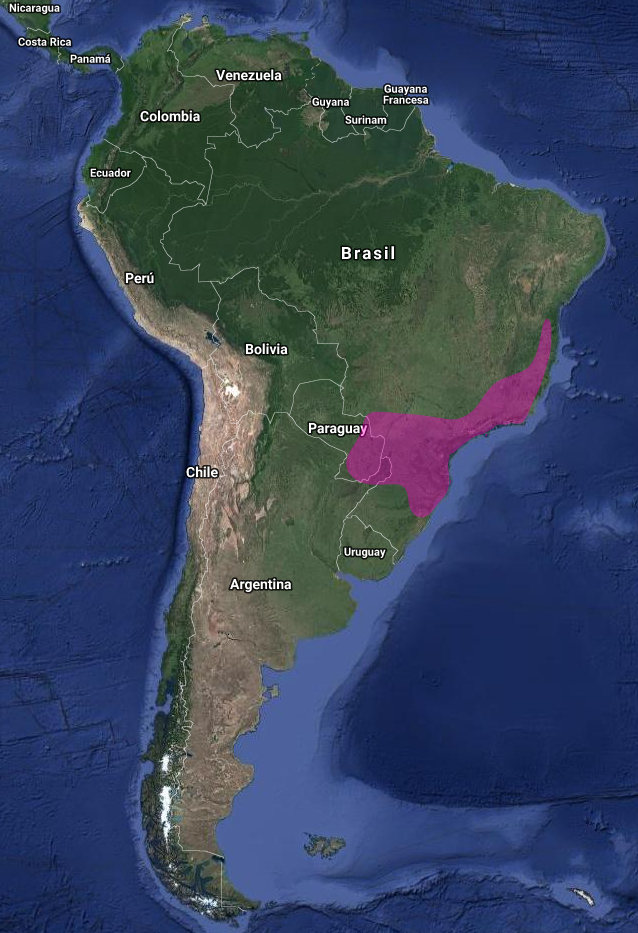
Emitaño canela (Phaethornis pretrei)
Picaflor de antifaz (Polytmus guainumbi)
Picaflor de vientre negro (Anthracothorax nigricollis)
Picaflor común (Chlorostilbon lucidus)
Picaflor copetón (Stephanoxis loddigesii)
Picaflor tesoro o tijereta (Eupetonema macroura)
Picaflor sombrío (Eupetomena cirrochloris)
Picaflor zafiro (Thalurania furcata)
Picaflor de corona violácea (Thalurania glaucopis)
Picaflor de garganta blanca (Leucochloris albicollis)
Picaflor esmeralda (Amazilia versicolor)
Picaflor de pecho azul (Amazilia lactea)
Picaflor de cola castaña (Hylocharis sapphirina)
Picaflor bronceado (Hylocharis chrysura)
Picaflor de barbijo (Heliomaster furcifer)
Picaflor picudo (Heliomaster longirostris)
Picaflor de garganta escamada (Heliomaster squamosus)
Picaflor amatista (Calliphlox amethystina)
Picaflor topacio (Chrysolampis mosquitus)
Colibrí mediano (Colibri serrirostris)
Coqueta verde sureña (Lophornis chalybeus)
MORFOLOGÍA
Dimorfismo sexual
El más pequeño puede pesar menos de dos gramos. El más grande, el colibrí gigante, que habita en Perú y Chile, pesa unos 20 gramos.
Plumaje vistoso con colores estructurales metálicos de las plumas que cambian según el ángulo de incidencia de la luz. Los machos generalmente de color más llamativo que las hembras
Patas cortas. Los colibríes sólo pueden posarse en las ramas, ya que se ven imposibilitados para andar o correr sobre el suelo.
Pico fino y largo, a veces curvo y boca estrecha. Las dos partes del pico del picaflor se superponen y calzan de tal forma que el picaflor puede abrir ligeramente el pico y sacar la larga lengua cuando liban néctar (El maxilar se sobrepone a la mandíbula formando un vacum, como una bomba aspirante. (H. Bocker 1937). Al igual que Nectariniidae y a diferencia de otros pájaros el picaflor tiene una lengua que puede curvar los bordes formando un tubo que le permite libar néctar. Algunos (Ramphodon, Galucis, Colibri y Avocettula) tienen la parte terminal del maxilar serrada, lo que sugiere la ventaja de fijar los objetos lisos.
La lengua con la que liban las flores es un órgano especializado, casi transparente, formado por dos tubos enrollados como si fueran láminas de celofán. Mientras el colibrí sorbe, su lengua entra y sale rápidamente y, tal como observó en 1852 el naturalista inglés William Charles Linnaeus Martin, el líquido «desaparece muy rápido, quizá por capilaridad». Cada uno de los tubos de la lengua se despliega para coger el néctar en una centésima de segundo. Luego el ave bombea el líquido hasta la garganta apretando el pico.
Lengua muy comprimida y extensible, bífida y tubular en la punta.
El pico puede medir hasta 15 mm, y la lengua del mismo individuo hasta 30 mm. El hioides que soporta la base de la lengua contornea el cráneo y alcanza la cabeza por debajo de la piel. Cuello comprimido y móvil.
Alas largas. La mano es mayor que el brazo o igual a éste, que es extremadamente corto.
Poseen 10 remeras primarias grandes y 6 a 7 remeras secundarias.
Patas diminutas con dedos muy fuertes y uñas largas y afiladas con forma de gancho. No sirven para andar.
COMPORTAMIENTO
A menudo confiados.
Vuelo muy veloz, ágil y sonoro (cuando vuelan en picado a 97 kilómetros por hora y despliegan la cola, emiten un sonido que no procede de sus cuerdas vocales, sino de la vibración de las plumas caudales cuando el aire pasa a través de ellas. En el cortejo, algunas especies de colibrí casi duplican la frecuencia del aleteo; otras solo baten un ala). Es capaz de volar hacia atrás porque su cuerpo se ubica en forma vertical. Las alas se extienden hacia atrás y adelante describiendo una figura de 8 acostado. Esto impulsa el aire hacia abajo (en lugar de hacia atrás). El poder de sus alas en el aleteo ascendente y descendente es igual, debido a que la estructura de los músculos pectorales es simétrica. Tiene músculos igualmente fuertes para elevar y bajar las alas.
Durante las horas de frío esconden las patas bajo el plumaje del abdomen. Poseen la capacidad de hibernar. Caen en un sueño letárgico para sobrevivir a las caídas bruscas de la temperatura. En clima frío, los cuerpos de los colibríes entran en una “modalidad de conservación de energía llamada torpor”, explica el ecologista de la Universidad Estatal de Oregón, Adam Hadley. En el norte durante el invierno experimentan una “mini-hibernación” cada noche, durante la cual sus temperaturas corporales se desploman de 41ºC a solo 9ºC.
La frecuencia cardíaca también disminuye durante el torpor. Por ejemplo, la del colibrí garganta azul (Lampornis clemenciae)cae de 1.260 latidos por minuto a escasos 50 a 180 latidos.
Los colibríes no dejan de alimentarse cuando hace frío. Hadley vio que un colibrí cabeza roja (Calypte anna) visitaba el comedero de aves de su patio durante un día de menos 2 grados centígrados.
Agresivas, defienden el territorio de nidificación y alimentación tanto de individuos de su especie u otras diferentes.
Les gusta mojarse (deben limpiarse debido al constante contacto con el líquido viscoso de las flores).
Les gusta tomar baños de sol. Limpian su pico con las patas.
Cuando la vegetación es densa, los colibríes tienen que esquivar las ramas y las hojas. A menudo los colibríes desafían los aguaceros para beber néctar y no morir de inanición. Se sacuden el agua igual que hacen los perros, con una oscilación de la cabeza y del cuerpo. Según investigadores de la Universidad de California en Berkeley, cada sacudida dura cuatro centésimas de segundo y somete la cabeza del ave a 34 veces la fuerza de la gravedad. Y lo más increíble: pueden hacerlo mientras vuelan o cuando están posados sobre una percha.
VOCALIZACIONES
La mayoría tiene una voz aguda semejante al zumbido de los insectos y murciélagos.
Poseen voces diferentes para expresar alarmas, ataques, frecuentemente entonadas en vuelo.
Algunos cantan en grupos y mantienen su territorio colectivo durante años.
Un aspecto poco conocido de la vida de los picaflores es su sistema de comunicación sonora.
A pesar de tener siringe, el órgano productor de sonidos de las aves, ellos son capaces de emitir una variedad increíble de estructuras sonoras.
Generalmente se caracterizan por ser sonidos muy agudos y rápidos y por lo tanto poco percibidos por nuestros oídos.
Científicos de la Academia Brasileña de Ciencias descubrieron que los picaflores son capaces de, por ejemplo, emitir 2 sonidos al mismo tiempo (voz doble), variar individualmente una secuencia de notas de su canto (modalidad de canto «versátil») y presentar variaciones regionales del canto o «dialectos», índice de aprendizaje. De hecho, desenvuelven una característica, rara en animales, de aprender «su lengua», es decir que adquieren su repertorio vocal por «imitación», NO por instinto (Jarvis et al., 2000)
ALIMENTACIÓN
Los picaflores están altamente especializados en la alimentación con néctar pero varían muchísimo en su comportamiento y dependencia en cuanto al néctar y en su grado de especialización sobre las flores. Con sus picos puntiagudos y lenguas con forma de U invertida hacen agujeros muy finos en la base de las corolas tubulares y beben el néctar sin ayudar en la polinización de la planta, mientras que otros son excelentes, aunque incidentales polinizadores.
Para mantener su vuelo tan enérgico los colibríes pueden llegar a consumir una cantidad de néctar superior a su peso corporal, gracias a una lengua que repite el movimiento de absorción hasta 15 veces por segundo.
Al igual que las abejas pueden calcular la cantidad de azúcar en una flor y pasar por alto las que nos son adecuadas a sus necesidades. Prefieren un contenido de azúcar de alrededor del 25% y si baja a menos de 15% no lo beben. El néctar es un alimento energético pero es pobre en proteínas, vitaminas y minerales. Por eso los picaflor suplementan su alimentación con insectos y arañas que utilizan especialmente para alimentar a sus crías.
La defensa de una fuente de néctar consiste en alternar periodos de alimentación con periodos de reposo en lugares próximos a la fuente utilizada, vigilando y agrediendo a los individuos invasores. El balance entre la energía adquirida por el uso exclusivo de un área de alimentación y la energía utilizada defendiendo esta área determina si esta defensa es energéticamente ventajosa o no.
El tamaño del área defendida está relacionada con la disponibilidad de recursos y densidad de competidores (Gass, 1976)
También puede ocurrir que una especie inicie la defensa de un territorio o sea desalojada por otra más dominante cuando el «valor» de este territorio aumente (cantidad y calidad del néctar), o que cuando el «valor» disminuya abandone la defensa y sea sustituida por otra especie inferior en la jerarquía.
REPRODUCCIÓN
Durante la época de reproducción se dan una serie de acontecimiento bastante variados.
En una primera fase el macho canta y se exhibe para llamar la atención de las hembras de su especie. Proclama su territorio, que defiende otros machos de su especie a no ser que haya asociados varios machos.
Una segunda fase donde el macho ejecuta vuelos nupciales delante de una determinada hembra emitiendo diferentes tipos de vocalizaciones, generalmente con la cola expandida.
Los colibríes exhiben sus habilidades aéreas en el amor y en la guerra, repeliendo rivales y cortejando parejas. Por ejemplo, los machos cabeza roja “se elevan 30 metros en el aire y se lanzan en picado”, y durante la caída, extienden las plumas de sus colas para producir una especie de gorjeo, antes de volver a elevarse a la misma altitud y repetir la maniobra, señala Hadley.
Algunos machos hacen exhibiciones impresionantes con el plumaje de la cola, como el colibrí cola de espátula (Loddigesia mirabilis); otros, como el colibrí cabeza violeta (Calypte costae) y el zumbador garganta rayada (Selasphorus calliope) despliegan una gorguera de colores intensos, que cambia de opaca a deslumbrante bajo diferente luz.
Finalmente el cortejo finaliza con la cópula entre los dos sexos.
Nidos a baja altura, colgados o asentados en ramas, hojas, raíces, techos de grutas, etc. Construyen sus nidos empleando telas de araña, musgo y líquenes, y los aseguran a las ramas y hojas resistentes, bastante por encima del nivel del suelo. Polígamos.
Hadley señala que, en áreas más tropicales, los nidos de los colibríes tienen forma más cónica y están construidos bajo hojas de plantas que los protegen de la lluvia.
La hembra construye el nido, incuba y alimenta a los pichones. El nido tiene forma de tacita, cono invertido o cilíndricos. Emplean en la construcción musgos, líquenes, detritus, tallos, cortezas de árboles, hojas secas, liados con telas de arañas. Internamente tapizado con materia algodonosa, pelos, cerdas, lanas, materiales vegetales suaves.
Ponen 2 huevos blancos, cilíndricos.
Los pichones nacen con los ojos cerrados y escaso plumón con pico corto. Son alimentados por la madre por regurgitación, tocándole la madre la cabeza con el pico para que abran la boca. Durante los primeros 7 días son alimentados por la madre. Cuando falta alimento las crías caen en letargo. Dejan el nido a las 3 semanas.
DISTRIBUCIÓN Y HÁBITAT
Frecuentan lugares donde crecen las madreselvas y otras plantas similares, ya que se alimentan del néctar y los pequeños insectos que encuentran en el interior de las flores. Como van de una a otra planta, también contribuyen a polinizarlas, al igual que hacen las abejas. Se los encuentra en bosques, selvas, sabanas, montañas, serranías, parques, jardines y áreas urbanas.
Habitan exclusivamente en América. Desde el sur de Alaska hasta Tierra del Fuego. El lugar con mayor diversidad está en el norte de los Andes, donde 290 especies residen en las selvas de tierras bajas, en los bosques nubosos de las cumbres y en todos los ecosistemas que hay entre medio.
BREVES APUNTES HISTÓRICOS
- Histoire naturelle et générale des colibris, oiseaux-mouches, jacamars et promerops. Audebert, J. B. (Jean Baptiste), Vieillot, L. P. A Paris,chez Desray,an XI=1802.
- Histoire naturelle des oiseaux-mouches : ouvrage orné de planches dessinées et gravées par les meilleurs artistes. Lesson, R. P. (René Primevère). Paris :Arthus Bertrand,[1829-1830].
- Histoire naturelle des colibris : suivie d’un supplément à l’Histoire naturelle des oiseaux-mouches : ouvrage orné de planches dessinées et gravées par les meilleurs artistes : et dédié A.M. le Baron Cuvier. Lesson, R. P. (René Primevère) ; Paris :Arthus Bertrand,[1830-1832]
- Histoire naturelle des oiseaux-mouches, ou, Colibris constituant la famille des trochilidés. Mulsant, Martial Étienne. Lyon :Au Bureau de la Société Linnéenne,1874-1877.
- Ornithology. Humming birds. Jardine, William. Edinburgh,W.H. Lizars; [etc., etc.][186-?]
- An introduction to the Trochilidae : or family of humming-birds Gould, John London :Printed by Taylor and Francis,1861.
- A monograph of the Trochilidæ, or family of humming-birds. Gould, John. London :Printed by Taylor and Francis ;1861 [i.e. 1849-1861]
- An introduction to the Trochilidae, or family of humming-birds. Darwin, Charles.
BIBLIOGRAFÍA
- Ares R. (2007) Aves: Vida y Conducta. Vázquez Mazzini Editores. Buenos Aires: 100-101
- Borrell B. (21 noviembre 2017). Colibríes, las aves más pequeñas del mundo. National Geographic.
- Cebolla Badie M. (2000) El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación. Suplemento Antropológico; Vol XXXV, n.º 2: 9-188 (enlace)
- Crawford H. Greenewalt (1960). The hummingbirds. National Geographic
- De la Peña M.R. (1987) Nidos y huevos de Aves Argentinas: 96
- De la Peña M.R.; F.C.; Laene Silva, R.; Capuccio, G. y Bonin, L.M (2009) Aves del Río Uruguay, Guía Ilustrada de Especies del Bajo uruguay y el Embalse de Salto Grande. Comisión Administradora del Río Uruguay. CARU: 102
- De la Peña M.R. (2015). Aves argentinas. EUDEBA. Ediciones UNL; Vol I: 342
- De la Peña M.R. y Salvador S. (2016) Aves Argentinas: Descripción, comportamiento, Reproducción y Distribución. Charadriidae a Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie); Vol.20 (1): 499
- Enciclopedia Británica. 5º Edición (1998) Macropedia; Vol XV: 8-85
- Hilty S. (2005) Birds of Tropical America. University of Texas Press: 185-214
- Jarvis E.D., Ribeiro S., da Silva M.L., Fix Ventura D., Vielliard J. y Mello C. (2000) Aprendizagem vocal em beija-flores. Atualidades Ornitológicas. N.96 – Julho/Agosto (July/August). (enlace)
- Langley L. (2017) Cómo sobreviven al invierno los colibríes. National Geographic.
- Narosky T. (2010) Aves de Argentina y Uruguay. Vázquez Mazzini Editores; 42
- Olrog, C. Ch. (1959). Las aves argentinas. Una Guía de campo. Universidad Nacional de Tucumán. Instituto Miguel Lillo. Argentina; 158
- Sick Helmut (1997) Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro: 433-452