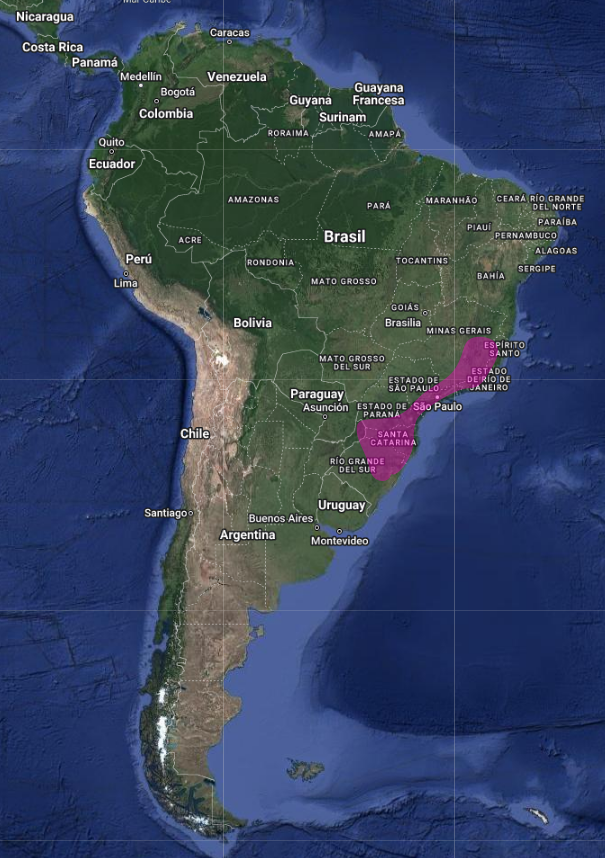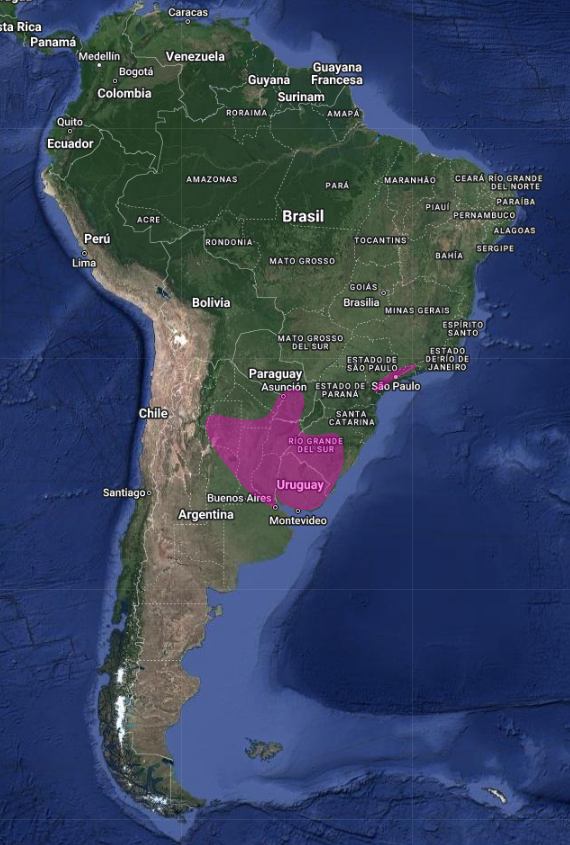
Su distribución es disyunta, en el este y sudeste de Brasil (Distrito Federal y en los Estados de Sao Paulo, Minas Gerais, Paraná y Río Grande do Sul) (Straube, 1991: 308), este de Paraguay y norte de Argentina, siendo rara su presencia y poco conocida su biología, en los tres países (Holmberg, 1939:175; Short, 1975:237; Olrog, 1979:137; Collar et al., 1992:462; Pearman & Abadie, 1995:12; Cleere, 2002:171; Accordi, 2002:227; Bornschein et al., 1996:125; Stotz et al., 1996:317; Lowen et al., 1997:17; Kirwan et al., 1999:202; Mazar Barnett & Pearman, 2001:48; Bodrati et al., 2019:157; de la Peña, 2020:231).
La inclusión repetida de Uruguay dentro de su distribución (Pinto, 1938:180; Olrog, 1979:137; Sick, 1997:421; Collar & Andrew, 1988:85) constituye probablemente un error en vista de que no existen registros documentados de su presencia en el país y permanece sin ser listado en las publicaciones recientes de avifauna nacional (Cuello & Gerzenstein, 1962; Gore & Gepp, 1979; Cuello, 1985:13); no obstante, el registro proveniente de Colón, que se ubica inmediatamente al otro lado del río Uruguay, en Argentina, indica la probabilidad de que la especie se halle presente en el país (Birdlife International, 1992:569)
En general se lo considera residente, pero Pearman & Abadie (1995:14) y Mazar Barnett & Pearman (2001:48) sugieren que en gran parte, sino enteramente, es migrante austral en Argentina, partiendo luego del periodo reproductivo, ya que todos los registros confirmados de Argentina eran del verano austral (octubre a febrero), mientras que los de Brasil eran a lo largo del año.
Contreras et al. (2014:318) concluyen en que es posible que la especie sea migrante, pero, en ese caso corresponde formular la pregunta: ¿Hacia dónde se dirige para realizar su residencia invernal? La cuestión queda abierta para futuras investigaciones al respecto.
Habita desde tierras bajas hasta los 1.100 msnm (Stotz et al. 1996:174).
Poco se conoce sobre la densidad de sus poblaciones y biología en general, y ha sido considerado como amenazado tanto a nivel nacional como internacional (Collar et al. 1992:463; BirdLife International 2022; MAyDS y AA 2017)
Distribución geográfica en Argentina
En Argentina el Eleothreptus anomalus (Gould, 1838) en Jujuy, Salta, Santiago del Estero, Formosa, Chaco, Córdoba, Santa Fe, norte de Buenos Aires, Entre Ríos, Corrientes y Misiones (Short, 1975:237; Olrog, 1979:137; de la Peña, 1999:92; Contreras et al., 2014:318; de la Peña, 2015:335; de la Peña, 2020:231-232).
Un registro proveniente de Catamarca parece constituir un probable error y la inclusión de Salta en el mapa en Narosky e Yzurieta (2010:193) podría también tratarse de una equivocación (Collar, 1992:462; Cleere, 1998:296; Birdlife International, Categorías de amenaza, 1992:568). (Ver localidades, coordenadas y referencias en los enlaces)
HÁBITAT
Se ha considerado al E. anomalus habitante de marismas o áreas cercanas al agua (Bornschein et al. 1996:125; Lowen et al. 1997:14; Accordi, 2001:227; Contreras et al., 2014:316; Straneck & Viñas, 1994; Cleere, 1998:295; de la Peña, 2020:231; Stotz et al., 1996:174).
Pero otros autores, lo han observado en hábitats tales como mesetas áridas, bosque en galería, bosque de transición, monte y pajonales, y baśandose en una revisión de datos publicados y otros registros aún sin publicar de Argentina y Brasil, concluyen que éste hábitat sería el más representativo, siendo falsa la asociación de la especie solo con las marismas (Pearman & Abadie, 1995:13; Kirwan et al. 1999:205; Young, 2015)
Accordi (2002:229) junto con Cleere (1998:295) y Kirwan (1999:205), coinciden en que el E. anomalus es dúctil en la selección de su hábitat
Desde los 0-1.100 msnm (Stotz et al., 1996:174).
Ecorregiones: Chaco húmedo, Delta e islas del Paraná, Espinal, Esteros del Iberá, Selva Paranaense.