- Administración de Parques Nacionales. Sistema de Información de Biodiversidad. Argentina. (s.f.) Ficha: Thalurania glaucopis Recuperado de https://sib.gob.ar/especies/thalurania-glaucopis el 30/01/2020.
- Argentavis. (s.f.) Picaflor corona violácea (Thalurania glaucopis). Recuperado de http://argentavis.org/2012/sitio/especie_co.php?id=642 el 19/01/2020.
- Aximoff, I.A. & Freitas, L. (2009) Composição e comportamento de aves nectarívoras em Erythrina falcata (Leguminosae) durante duas florações consecutivas com intensidades diferentes. Revista Brasileira de Ornitologia 17(3–4): 194–203. (enlace)
- Barnett J.M., & Pearman M. (2001) Lista Comentada de las Aves Argentinas. Editorial Lynx, Barcelona: 49
- Belton, W. (1984) Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bull. Amer. Mus. Nat. Hist. 178(4): 369–636. (enlace)
- Berlioz, J. (1930) Note critique sur quelques trochilidés du genre Thalurania. Bull. Mus. Hist. Nat. 2(2): 65–69. (enlace)
- BirdLife International (2020) Species factsheet: Thalurania glaucopis. Downloaded from http://www.birdlife.org on 31/01/2020
- Bouchard, S., Vonhof, M.J., Fenton, M.B. & Monette, G. (2000) Nutrient preferences of Brazilian hummingbirds. Wilson Bull. 112(4): 558–562. (enlace)
- Brooks, T.M., Barnes, R., Bartrina, L., Butchart, S.H.M., Clay, R.P., Esquivel, E.Z., Etcheverry, N.I., Lowen, J.C. & Vincent, J. (1993) Bird Surveys and Conservation in the Paraguayan Atlantic Forest: Project CANOPY ’92 Final Report. BirdLife Study Report 57. BirdLife International, Cambridge. (enlace)
- Cebolla Badie M. (2000) El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación. Suplemento Antropológico; Vol XXXV, n.º 2: 9-188 (enlace)
- Cestari, C. & Pizo, M.A. (2008) Utilization of epiphytes by birds in a Brazilian Atlantic forest. Orn. Neotropical 19(1): 97–107. (enlace)
- Chébez, J.C. (1996). Fauna Misionera, Catálogo Sistemático y Zoogeográfico de los vertebrados de la Provincia de Misiones (Argentina) (1o Ed.). Editorial L.O.L.A. (Literature of Latin American); 136
- De la Peña, M.R. (1984) Descripción de nuevos nidos para la avifauna argentina. Historia Natural 4(2): 19
- De la Peña M.R. (1999) Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. Buenos Aires, Argentina: 97 (451)
- De la Peña M.R. (2015). Aves Argentinas. Buenos Aires EUDEBA, Vol.1: 349
- EcoRegistros. Picaflor Corona Violácea (Thalurania glaucopis) – Ficha de la especie. Accedido de http://www.ecoregistros.org el 31/01/2020.
- Enciclopedia Británica (1998). Vol 15; Macropedia: Birds: 1-108
- Hayes, F.E. (1995) Status, Distribution and Biogeography of the Birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association. Albany & Colorado Springs. 224 pp. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Zafiro Capirotado Thalurania glaucopis (Gmelin, JF, 1788). Recuperado de https://avibase.bsc-eoc.org/species.jsp?avibaseid=F83FDFF6B10C8F13 el 19/01/2020.
- Lima, C.A., Siqueira, P.R., Gonçalves, R.M.M., Vasconcelos, M.F. & Leite, L.O. (2010) Dieta de aves da Mata Atlântica: uma abordagem baseados em conteúdos estomacais. Orn. Neotropical 21(3): 425–438. (enlace)
- López Lanús, B., Grilli, P., Di Giacomo, A. S., Cococonier, E.E., & Banchs, R. (2008). Categorización de las Aves de la Argentina, según su Estado de Conservación. Aves Argentinas/AOP y Secretaría de Ambiente y Desarrollo Sustentable; (enlace)
- Lowen, J.C., Bartrina, L., Clay, R.P. & Tobias, J.A. (1996) Biological Surveys and Conservation Priorities in Eastern Paraguay: the Final Reports of Projects Canopy ’92 and Yacutinga ’95. CSB Conservation Publications, Cambridge, UK. (enlace)
- Lowen, J.C., Clay, R.P., Brooks, T.M., Esquivel, E.Z., Bartrina, L., Barnes, R., Butchart, S.H.M. & Etcheverry, N.I. (1995) Bird conservation in the Paraguayan Atlantic forest. Cotinga 4: 58–64. (enlace)
- Marini, M.A., Motta-Júnior, J.C., Vasconcello, L.A.S. & Cavalcanti, R. (1997) Avian body masses from the Cerrado region of central Brazil. Orn. Neotropical 8(1): 93–99. (enlace)
- Martínez Gamba, R. (2014). Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones, Argentina. Nótulas Faunísticas, Segunda Serie(163), 1-10. (enlace)
- Militello, E., & Chebez, J.C. (2009). Notas sobre aves del Parque Nacional Iguazú y zona de influencia, Misiones, Argentina. Nótulas Faunísticas, 32, 1-5. (enlace)
- Moura, A.S. & Soares Júnior, F.J. (2010) Ornitofilia (polinização por aves) em Aechmea maculata L.B. Smith (Bromeliaceae), registrada em um pequeno fragmento florestal no município de Lavras, Minas Gerais, Brasil. Atualidades Orn.158: 57–60. (enlace)
- Narosky, T., & Chébez, J.C. (2002). Guía para la Identificación de las Aves de Iguazú. (1o ed.). Vazquez Mazzini Editores. p. 64 (92)
- Narosky, T. & Yzurieta D. (2010) Guía de identificación Aves de Argentina y Uruguay. Buenos Aires; Vázquez Mazzini Editores: 204
- Olrog, C.Ch. (1959). Las Aves Argentinas. Una Guía de Campo. (1o Ed.). Universidad Nacional de Tucumán. Instituto «Miguel Lillo»; 161
- Parker, T.A. & Goerck, J.M. (1997) The importance of national parks and biological reserves to bird conservation in the Atlantic Forest region of Brazil. Pp. 527–541 in: Remsen (1997). (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Zafiro capirotado · Thalurania glaucopis · (Gmelin, JF, 1788). Recuperado de https://www.xeno-canto.org/species/Thalurania-glaucopis el 19/01/2020.
- Rocca, M.A. & Sazima, M. (2008) Ornithophilous canopy species in the Atlantic rain forest of southeastern Brazil. J. Field Orn. 79(2): 130–137. (enlace)
- Saibene C.A., Castelino M.A., Rey N.R, Herrera J., & Caló J. (1996) Inventario de las Aves del Parque Nacional «Iguazú», Misiones, Argentina. Ed. L.O.L.A. Monografía 9: 36
- Santos, Caio Graco Machado. Distribuição espacial, fenologia e polinização de bromeliaceae na Mata Atlantica do Alto da Serra de Paranapiacaba, SP. 2000. 98p. Tese (doutorado) – Universidade Estadual de Campinas, Instituto de Biologia, Campinas, SP. Disponível em: <http://www.repositorio.unicamp.br/handle/REPOSIP/315184>. Acesso em: 27 jul. 2018. (enlace)
- Sick, H. & Teixeira, D.M. (1981) Nocturnal activities of Brazilian hummingbirds and flycatchers at artificial illumination. Auk 98(1):191–192. (enlace)
- Sick H. (1997) Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro: 460
- Snow, D.W. & Snow, B.K. (1986) Feeding ecology of hummingbirds in the Sierra do Mar, southeastern Brazil. El Hornero 12(4): 286–296. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A. & Moskovits, D.K. (1996) Neotropical Birds, Ecology and Conservation. University of Chicago Press, Chicago & London.
- Violet-capped Woodnymph (Thalurania glaucopis), In Neotropical Birds Online (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. retrieved from Neotropical Birds Online: https://neotropical.birds.cornell.edu/Species-Account/nb/species/vicwoo2
- Weller, A.A., Kirwan, G.M. & Boesman, P. (2020). Violet-capped Woodnymph (Thalurania glaucopis). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (retrieved from https://www.hbw.com/node/55463 on 31 January 2020).
- Willis, E.O. (1992) Zoogeographical origins of eastern Brazilian birds. Orn. Neotropical 3(1): 1–15. (enlace)
-
-
Picaflor de corona violácea | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOREspecie con rango extremadamente amplio, por lo tanto no se aproxima a los umbrales de Vulnerabilidad bajo criterio de tamaño del rango (extensión < 20.000 km² combinado con declinación o fluctuación del tamaño del rango, extensión/calidad del hábitat, o tamaño de la población y número pequeño de localizaciones o fragmentación severa). Se desconoce la tendencia de la población, pero que no es lo suficientemente rápida como para alcanzar los umbrales de los criterios de tendencia de la población (declinación > 30% en 10 años o 3 generaciones). El tamaño de la población no ha sido cuantificado, pero no se cree que que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (< 10.000 individuos maduros con una declinación continua estimada ( > 10% en 10 años o 3 generaciones, o con una estructura poblacional específica). Por estas razones la especie es considerada como: Preocupación menor.
El tamaño de la población global no ha sido cuantificado, pero esta especie se describe como “común” (Stotz et al., 1996)
En Argentina: Ha sido citado en dos áreas protegidas de Misiones: Iguazú y San Antonio (Chébez, 2012).
MADS-AA-NA: No Amenazada según MADS&AA 2015 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas) Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 pp (2015)
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable) López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable) Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010.
-
Picaflor de corona violácea | Distribución
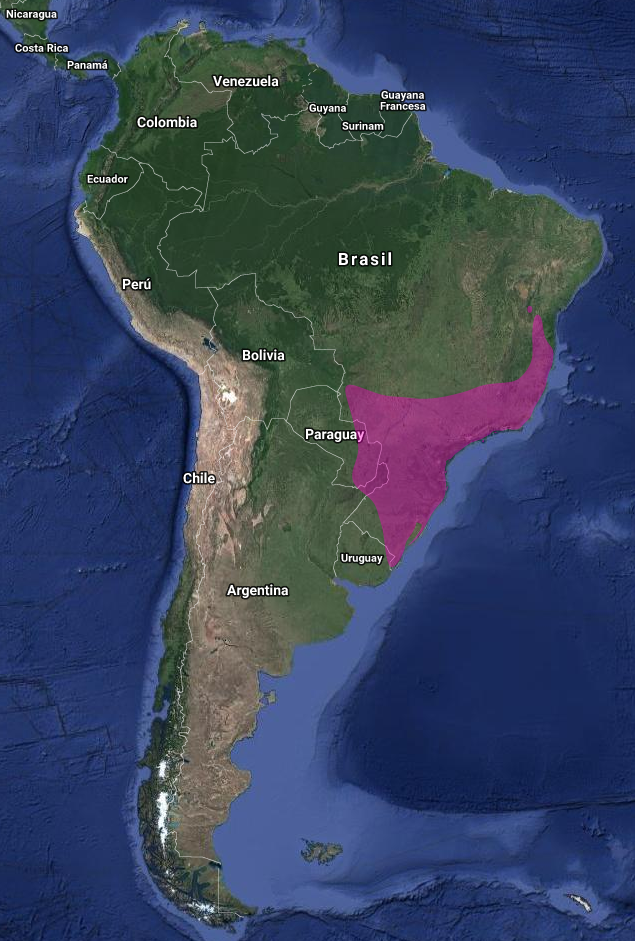
InfoNatura: Animals and Ecosystems of Latin America 2007 América: Brasil, residente y moderadamente común en el este y centro (Willis 1992), a lo largo del litoral norte y extremo norte (Belton, 1984); Paraguay, residente permanente; poco común en la región central (un registro en Asunción) y Alto Paraná; raro en Ñeembucú (Lowen, Clay, Brooks, Esquivel, Bartrina, Barnes, Butchart, & Etcheverry, 1995; Hayes, 1995); y extremo noreste de Argentina (Misiones) (Olrog, 1959; De la Peña, 1999, 2015, 2016)
En Argentina: Misiones, común, residente y nidificante en PN Iguazú (Stotz et al., 1996; Saibene et al., 1996; de la Peña 1999, 2015, 2016; Barnett & Pearman, 2001)
Ecorregiones: Selva Paranaense (Stotz et al., 1996; Parker & Goerck, 1997; Barnett & Pearman, 2001).
Hábitat: Bosque virgen, bordes del bosque, matorral, bosque secundario. También se encuentra en áreas suburbanas como parques y jardines, e incluso dentro de los centros urbanos. Se extiende desde cerca del nivel del mar hasta 1200 msnm (Stotz et al., 1996)
-
Picaflor de corona violácea | Comportamiento
Endémico, residente, nidificante del sistema de selva que abarca el sudeste del Brasil y provincia de Misiones (Saibene et al., 1996)
Migrante de corta distancia (Snow & Snow, 1986).
VOCALIZACIONESCanto: serie monótona, metálica y rápida de “chip..chip..chip…”
Llamada: “chip” secos, cortos que a veces se repiten durante el vuelo.
ALIMENTACIÓNSe alimentan principalmente de néctar en una gran variedad de plantas nativas e introducidas, desde el nivel bajo hasta el dosel (Stotz et al., 1996) El macho defiende agresivamente sus fuentes de néctar de los intrusos, incluso de los observadores humanos; la hembra es menos agresiva y pasa desapercibida cuando se alimenta (Snow & Snow, 1986)
En áreas boscosas, las familias de plantas incluyen epífitas como Bromeliaceae (Santos & Machado, 2000; Cestari & Pizo, 2008; Moura & Soares Júnior, 2010), Orchidaceae, Marantaceae, Musaceae, Passifloraceae, Leguminosae , Rubiaceae, Bombacaceae, Vochysiaceae, Strelitziaceae, Heliconia (una de las principales fuentes de néctar para los machos) (Snow & Snow, 1986)
Varias especies de árboles, incluyendo Citrus , Anacardium, Dombeya y Eucalyptus, Erythrina falcata (pollinizador secundario-Aximoff & Freitas, 2009); Spirotheca rivieri y P . dichrous (Rocca & Sazima, 2008)
Se alimenta también de pequeños insectos (incluyendo Diptera y Lepidoptera) (Lima, Siqueira, Gonçalves, Vasconcelos & Leite, 2010) Inician y finalizan sus actividades diurnas a una cierta intensidad de luz, pero se ha constatado que con luz artificial extienden el periodo de actividad significativamente, especialmente en áreas tropicales (Sick & Teixeira, 1981)
REPRODUCCIÓNSe reproduce entre septiembre y febrero. Localizados en Misiones nidos en el mes de octubre (De la Peña, 2016)
Nido en forma de cuenco colgante construido con fibras vegetales enlazados con telas de araña. Por fuera trozos de helechos y líquenes.
Sobre ramas horizontales entre 1.5-3 m del suelo.
Puesta de 2 huevos elípticos y blancos. Son incubados durante 15 días por la hembra.

© Martín Rodolfo de la Peña Nido. Puerto Iguazú. Misiones Octubre 1981. Algunos derechos reservados -
Picaflor de corona violácea | Descripción
Dimorfismo sexual en cuanto a tamaño y plumaje (Narosky & Chébez, 2002; Chébez, 2012; Snow & Snow, 1986; Marini, Motta-Jr, Vasconcello, & Cavalcanti, 1997)
Moderadamente largo (Belton, 1984).
Pico recto, de tamaño mediano, negruzco. Relativamente más corto en los machos (Snow & Snow, 1986)
Macho: Frente y corona azul-violeta brillante. Nuca y lados de la cara verde-oscuro que al mirarlo de frente parecen negras. Iris oscuro
Dorso, hombros y cubiertas alares verde-dorado oscuro que se vuelve más brillante en las supracaudales. Ventralmente verde-amarillento brillante (incluyendo las plumas subcaudales).
Alas : pardo-azuladas. Cola bifurcada color azul oscuro. Tarsos marrones rojizos a negros (Belton, 1984; Olrog, 1959; Narosky & Chébez, 2002; Chébez, 2012)
Hembra: Dorso verde dorado con plumas ribeteadas de oscuro que le da un aspecto escamado. Zona ventral y subcaudales blancuzcas a amarillo pálido; cola con punta externa blanca (Narosky & Chébez, 2002; Chébez, 2012)
Alas iguales al macho. Cola ligeramente bifurcada con timoneras centrales y porción basal de las externas verde metálico que se vuelven azul oscuro con manchas blancas en los extremos.

© Luis Carlos Rocha Beija flor de fronte violeta – Thalurania glaucopis Abril 2007. Algunos derechos reservados -
Picaflor de corona violácea | Taxonomía
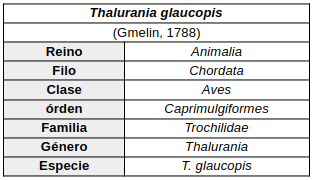
Monotípico
-
Picaflor de corona violácea (Thalurania glaucopis)


Histoire naturelle des oiseaux-mouches. Lesson R.P. (1829) Láminas 58 y 59 Es uno de los picaflores más comunes en el sureste de Brasil, donde son frecuentes tanto en áreas boscosas como semiabiertas; se lo encuentra en muchas áreas protegidas, por ejemplo, los parques nacionales de Serra dos Orgãos e Itatiaia. En Paraguay, conocido solo en la región del Alto Paraná; En Argentina, se encuentra en tierras bajas húmedas de Misiones.
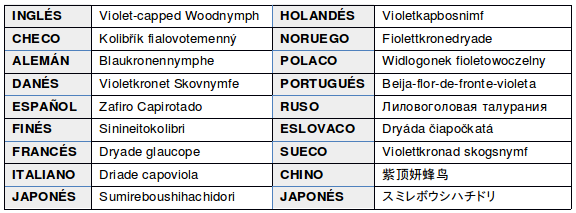
NOMBRES COMUNES: Picaflor corona violácea (Argentina, Paraguay y Uruguay); Picaflor frente violácea (Uruguay); Zafiro capirotado; Picaflor verde de frente azul; Beija-flor-de-fronte-violeta, tesoura-de-fronte-violeta (Brasil); en guaraní: Mainumby; Maino i (Cebolla Badie, 2000)
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS
- Histoire naturelle des oiseaux-mouches : ouvrage orné de planches dessinées et gravées par les meilleurs artistes … Lesson, R. P. (René Primevère) Paris :Arthus Bertrand,[1829-1830]; Texto y Láminas LVIII y LIX (L’oiseau-mouche violet a queue fourchue)
- A monograph of the Trochilidæ, or family of humming-birds. Gould, John, Richter, Henry Constantine, lithographer. Hullmandel & Walton, printer of plates. Walter & Cohn printer of plates. (1861); Vol II: texto y Lámina IC (Thalurania glaucopis)
- An introduction to the Trochilidae : or family of humming-birds. Gould, John. London:Printed by Taylor and Francis, 1861; 76 (Thalurania glaucopis)
- Histoire naturelle des oiseaux-mouches, ou, Colibris constituant la famille des trochilidés. Mulsant, Martial Étienne. Lyon :Au Bureau de la Société Linnéenne, 1874-1877. Voll III: 59 (La Thaluranie glaucope)
- Catalogue of the birds in the British Museum. British Museum (Natural History). Department of Zoology. London, 1874-98; Vol 16: 77 (Thalurania glaucopis)
- The Humming bird. Boucard, Adolphe. London [etc.] :A. Boucard,1891-1895. Vol III: 100 (Thalurania glaucopis)
-
Picaflor zafiro | Bibliografía
- Abrahamczyk, S. & Kessler, M. (2009) Ecological and distributional notes on hummingbirds from Bolivian lowland forests. Bull. Brit. Orn. Club 130(1): 8–12. (enlace)
- Abrahamczyk, S. & Kessler, M. (2010) Hummingbird diversity, food niche characters, and assemblage composition along a latitudinal precipitation gradient in the Bolivian lowlands. J. Orn. 151(4): 615–625. (enlace)
- Administración de Parques Nacionales. Sistema de Información de Biodiversidad. Argentina. (s.f.) Ficha: Thalurania furcata. Recuperado de https://sib.gob.ar/especies/thalurania-furcata el 13/01/2020.
- Antelo, C.M., & Fernández, Z.J.B. (2013). Las aves no passeriformes de Tucumàn, Argentina. Fundacion Miguel Lillo. (enlace)
- Araújo-Silva, L.E. & Bessa, E. (2010) Territorial behaviour and dominance hierarchy of Anthracothorax nigricollis Vieillot 1817 (Aves: Trochilidae) on food resources. Revista Brasileira de Ornitologia 18(2): 89–96. (enlace)
- Argentina nativa. (2011) Picaflor zafiro (Thalurania furcata). Recuperado de http://faunayfloradelargentinanativa.blogspot.com/search?q=thalurania+furcata el 19/01/2020.
- Argentavis. (s.f.) Picaflor zafiro (Thalurania furcata). Recuperado de http://argentavis.org/2012/sitio/especie_co.php?id=641 el 19/01/2020.
- Ayala R, A.V. (1986) Aspectos de la relación entre Thalurania furcata colombica (Aves Trochilidae) y las flores en que liba, en un bosque subandino. Caldasia. Vol 14, N.º 68/70: 549-562 (enlace)
- Barnett J.M., & Pearman M. (2001) Lista Comentada de las Aves Argentinas. Editorial Lynx, Barcelona: 49
- BirdLife International (2020) Species factsheet: Thalurania furcata. Downloaded from http://www.birdlife.org on 31/01/2020.
- Blake, E.R. (1950) Birds of the Acary Mountains southern British Guiana. Fieldiana Zool. 32(7): 419–474. (enlace)
- Bodrati, A., Areta J.I., & White, E. (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves, 57, 63-80. (enlace)
- Bond, J. & Meyer de Schauensee, R. (1943) The birds of Bolivia. Part II. Proc. Acad. Nat. Sci. Philadelphia 95: 167–221. (enlace)
- Burgos, F.G., Baldo, J.L., & Cornell, F.M. (2009). Lista de las aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. S. S. de Jujuy. (enlace)
- Burton, P.J.K. (1973) Non-passerine bird weights from Panama and Colombia. Bull. Brit. Orn. Club 93(3): 116–118. (enlace)
- Chebez, J.C. (1996). Fauna Misionera. A systematic and Zoogeographical Catalogue of the vertebrate Fauna of the Province of Misions (Argentina): Vol. Monografía No 5 (1o ed.). L.O.L.A. (Literature of Latin America); 136
- Cintra, R. & Yamashita, C. (1990) Habitats, abundância e occorência das espécies de aves do Pantanal de Poconé, Mato Grosso, Brasil. Pap. Avuls. Dept. Zool. São Paulo 37(1): 1–21. (enlace)
- Coelho C.P. & Barbosa A.A. (2004) Biologia reprodutiva de Psychotria poeppigiana Mull. Arg.(Rubiaceae) em mata de galeria. Acta Botanica Brasilica; 18(3): 481-489 (enlace)
- Coconier, E.G., López Lanús, B., Roesler, I., Moschione, F., Pearman, M., Blendinger, P., Bodrati, A., Monteleone, D., Casañas, H., Pugnali, G., & Alvarez, M.E. (2007). Lista comentada de las aves silvestres de la unidad de gestión Acambuco. En Las aves silvestres de Acambuco, Provincia de Salta, Argentina. Coconier, E. G. (Ed.) (enlace)
- Cory, C.B. (1918) Catalogue of Birds of the Americas and Adjacent Islands. Publications of the Field Museum of Natural History (Zoological Series) 197, 13 pt. 2. 315 pp.(enlace)
- De la Peña M.R. (1999) Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. Buenos Aires, Argentina; 97 (450)
- De la Peña M.R. (2015). Aves Argentinas. Buenos Aires EUDEBA, Vol.1: 349
- De la Peña M.R., & Salvador S. (2016). Aves Argentinas: Descripción, comportamiento, Reproducción y Distribución. Charadriidae a Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), 20(1), 627 pp.
- Eco Registros. Picaflor Zafiro Thalurania furcata (Gmelin, 1788). Ficha de la especie. Recuperado de http://www.ecoregistros.org/ficha/Thalurania-furcata el 19/01/2020.
- Enciclopedia Británica (1998). Vol 15; Macropedia: Birds: 1-108
- Escalante, P. & Peterson, A.T. (1992) Geographic variation and species limits in Middle American wood-nymphs (Thalurania). Wilson Bull. 104(2): 205–219. (enlace)
- Fork-tailed Woodnymph (Thalurania furcata), In Neotropical Birds Online (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. retrieved from Neotropical Birds Online: https://neotropical.birds.cornell.edu/Species-Account/nb/species/fotwoo1
- Friedmann, H. (1948) Birds Collected by the National Geographic Society’s Expeditions to Northern Brazil and Southern Venezuela. Proceedings of the US National Museum 97. Smithsonian Institution, Washington, D.C. 197 pp. (enlace)
- Krauczuk, E.R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Christi, San Ignacio, Misiones, Argentina. Lundiana, 9(1), 21-31. (enlace)
- Gilliard, E.T. (1941) The birds of Mt. Auyan-Tepui, Venezuela. Bull. Amer. Mus. Nat. Hist. 77(9): 439–508. (enlace)
- Greeney, H.F., Gelis, R.A. & White, R. (2004) Notes on breeding birds from an Ecuadorian lowland forest. Bull. Brit. Orn. Club 124(1): 28–37. (enlace)
- Greeney, H.F. & Gelis, R.A. (2008) Further breeding records from the Ecuadorian Amazonian lowlands. Cotinga 29: 62–68. (enlace)
- Hayes, F.E. (1995) Status, Distribution and Biogeography of the Birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association. Albany & Colorado Springs. 224 pp. (pp: 67) (enlace)
- Hellmayr, C.E. (1929) A contribution to the ornithology of northeastern Brazil. Field Mus. Nat. Hist. (Zool. Ser.) 12(18): 235–501. (enlace)
- Krauczuk, E.R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Chriti, San Ignacio, Misiones, Argentina. Lundiana, 9(1), 21-31. (enlace)
- Lasprila L.R. & Sazima M. (2004) Interacciones planat-colibrí en tres comunidades vegetales de la parte suboriental del Parque nacional Natural Chiribiquete, Colombia. Ornitología Neotropical 15 (Suppl.):183-190 (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Zafiro Golondrina. Thalurania furcata (Gmelin, JF, 1788). Recuperado de https://avibase.bsc-eoc.org/species.jsp?lang=ES&avibaseid=EB8F11B5962D476F el 19/01/2020.
- López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo & R. Banchs (2008) Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. (enlace)
- Marini, M.A., Motta-Júnior, J.C., Vasconcello, L.A.S. & Cavalcanti, R. (1997) Avian body masses from the Cerrado region of central Brazil. Orn. Neotropical 8(1): 93–99. (enlace)
- Martínez Gamba, R. (2014). Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones, Argentina. Nótulas Faunísticas, Segunda Serie(163), 1-10. (enlace)
- Moschione, F., Spitznagel, O., & González, M. (2012). Lista de aves de Salta. Ministerio de Cultura y Turismo; (enlace)
- Nara A.K & Webber A.C. (2002). Floral biology and pollination of Aechmea Beeriana (Bromeliaceae) in vegetation along stream margins in Central Amazonia. Acta Amazonica 32(4): 571-588 (enlace)
- Narosky, T. & Yzurieta D. (2010) Guía de identificación Aves de Argentina y Uruguay. Buenos Aires; Vázquez Mazzini Editores: 204
- Ortiz D. & Aráoz R. (2015) El Picaflor Zafiro (Thalurania furcata) y el Colibrí Mediano (Colibri serrirostris) en la provincia de Tucumán, Argentina. EcoRegistros Revista, 5(7(: 15-17 (enlace)
- Pagano, L.G. & Salvador, S.A. (2017) Datos de pesos de aves argentinas. Parte 4. Historia Natural 7(1): 21–43. (enlace)
- Perry, A., Kessler, M. & Helme, N. (1997) Birds of the central Rio Tuichi Valley, with emphasis on dry forest, Parque Nacional Madidi, Dpto. La Paz, Bolivia. Orn. Monogr. 48: 557–576. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Zafiro golondrina · Thalurania furcata · (Gmelin, JF, 1788). Recuperado de https://www.xeno-canto.org/species/Thalurania-furcata el 19/01/2020.
- Poulin, B., Lefebvre, G. & McNeil, R. (1994) Diets of land birds from northeastern Venezuela. Condor 96(2): 354–367. (enlace)
- Saibene C.A., Castelino M.A., Rey N.R, Herrera J., & Caló J. (1996) Inventario de las Aves del Parque Nacional «Iguazú», Misiones, Argentina. Ed. L.O.L.A. Monografía 9: 36
- Savigny, C. (2010). Aportes al conocimiento de la avifauna del Parque Nacional Iguazú y alrededores. Nuestras Aves, 55, 20-22. (enlace)
- Short, L.L. (1975) A zoogeographic analysis of the South American Chaco avifauna. Bull. Amer. Mus. Nat. Hist. 154(3): 165–352. (enlace)
- Sick Helmut. (1997) Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro: 460
- Soares-Filho, Britaldo & Nepstad, Daniel & Curran, Lisa & Cerqueira, Gustavo & Garcia, Ricardo & Azevedo Ramos, Claudia & Voll, Eliane & Pittman, Alice & Lefebvre, Paul & Schlesinger, Peter. (2006). Modelling Conservation in the Amazon Basin. Nature. 440. 520-3. 10.1038/nature04389. (enlace)
- Stiles, F.G., Kirwan, G.M. & Boesman, P. (2020). Fork-tailed Woodnymph (Thalurania furcata). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (retrieved from https://www.hbw.com/node/55461 on 31 January 2020).
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A. & Moskovits, D.K. (1996) Neotropical Birds, Ecology and Conservation. University of Chicago Press, Chicago & London; pp: 180-181, 319
- Walther, B.A. (2002) Grounded ground birds and surfing canopy birds: variation of foraging stratum breadth observed in Neotropical forest birds and tested with simulation models using boundary constraints. Auk 119(3): 658–675. (enlace)
- Willard, D.E., Foster, M.S., Barrowclough, G.F., Dickerman, R.W., Cannell, P.F., Coats, S.L., Cracraft, J.L. & O’Neill, J.P. (1991) The birds of Cerro de la Neblina, Territorio Federal Amazonas, Venezuela. Fieldiana Zool. 65: 1–80. (enlace)
- Willis, E.O. (1992) Zoogeographical origins of eastern Brazilian birds. Orn. Neotropical 3(1): 1–15. (enlace)
- Wolf L.L, Hainsworth F.R. & Stiles F.G. (1972) Energetics of foraging: rate and efficiency of nectar extraction by hummingbirds. Science; Vol 176: 1351-1352 (enlace)
- Wunderle, J.M., Willig, M.R. & Henriques, L.M.P. (2005) Avian distribution in treefall gaps and understorey of terra firme forest in the lowland Amazon. Ibis 147(1): 109–129. (enlace)
- Zimmer, J.T. (1950) Studies of Peruvian birds 58. The genera Chlorostilbon, Thalurania, Hylocharis and Chrysuronia. Amer. Mus. Novit. 1474: 1–31. (enlace)
-
Picaflor zafiro | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOREspecie con rango extremadamente amplio, por lo tanto no se aproxima a los umbrales de Vulnerabilidad bajo criterio de tamaño del rango (extensión < 20.000 km² combinado con declinación o fluctuación del tamaño del rango, extensión/calidad del hábitat, o tamaño de la población y número pequeño de localizaciones o fragmentación severa). A pesar del hecho de que la población tiene tendencia a disminuir, no se cree que la declinación sea lo suficientemente rápida para alcanzar los umbrales de Vulnerabilidad según los criterios de tendencia de la población ( declinación > 30% en 10 años o 3 generaciones). El tamaño de la población no ha sido cuantificado, pero no se cree que que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (< 10.000 individuos maduros con una declinación continua estimada ( > 10% en 10 años o 3 generaciones, o con una estructura poblacional específica). Por estas razones la especie es considerada como: Preocupación menor
El tamaño de la población no se ha cuantificado, pero esta especie se describe como “común” (Stotz et al., 1996)
Se sospecha que estas especies pierden un 15.9-17.6% de su hábitat, dentro de su área de distribución en 3 generaciones (12 años), basado en un modelo de de deforestación de la Amazonia (Soares-Filho, Nepstad, Curran, Cerqueira, García, Azevedo-Ramos, Voll, Pittman, Lefebvre & Schlesinger, 2006). Por lo tanto es probable que su población decline al menos un 25% en 3 generaciones.
Comunes en la mayor parte de su extremadamente amplio rango, pero las poblaciones en algunas áreas están o pueden estar pronto amenazadas por la deforestación, especialmente en partes de Brasil , Colombia y Paraguay.
En Argentina: de distribución restringida dentro de Parques Nacionales (P.N. Baritú en Salta y Calilegua en Jujuy), en general asociada a tipos de hábitats muy especiales. Escasamente representada en el resto del país (Formosa, Misiones- PN Iguazú, rara aunque posible residente -(Saibene et al., 1996), Tucumán (De la Peña 1999 y 2016); observado en Corrientes sin determinación de subespecie (Contreras & Contreras et al. 1990, citado en De la Peña, 1999, p.97 (450)
En Argentina:
Estado de conservación
MADS-AA-NA: No Amenazada según MADS&AA 2015 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas) Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p 2015
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable) López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable) Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010
-
Picaflor zafiro | Distribución
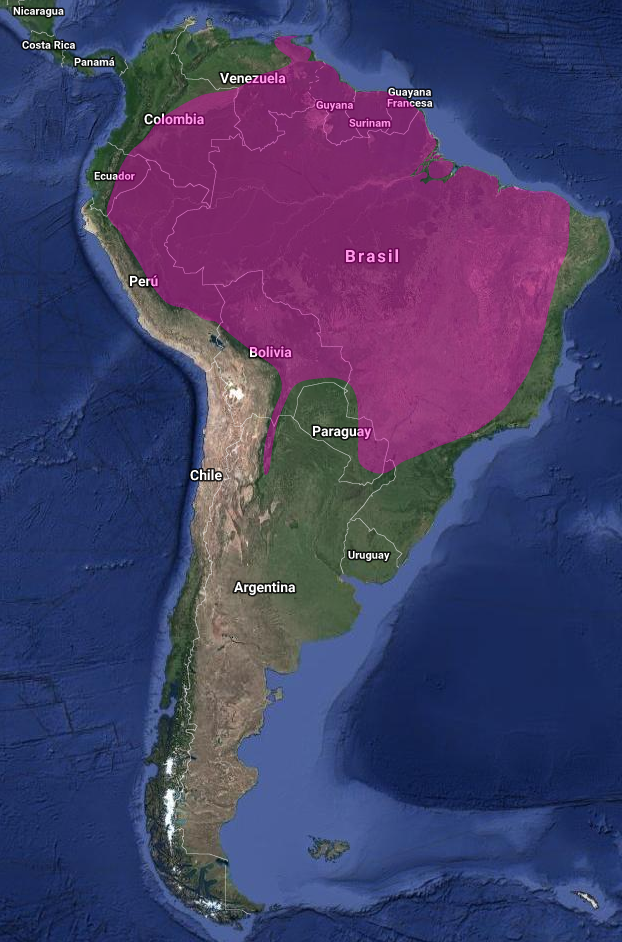
InfoNatura: Animals and Ecosystems of Latin America 2007 América: Extensa área de distribución desde el norte de Sudamérica hasta norte de Argentina (De la Peña, 2016), comprendiendo:
Bolivia (Stotz et al., 1996). Dto La Paz: bastante común; habita bosque seco y semideciduo (Bond & Meyer de Schauensee, 1943; Perry, Kessler & Helme, 1997) y Tarija (Abrahamczyk & Kessler, 2009)
Brasil (Stotz et al., 1996), Pantanal-Mato Grosso, común en mata ciliar, semidecidua y cerrado; estacional: de abril a septiembre (Cintra & Yamashita, 1990), Pará y zona inferior del amazonas (Hellmayr, 1929), y al este en el bosque atlántico (Willis, 1992)
Ecuador; French Guayana (Cory, 1918); Guayana (Blake, 1950); Paraguay –Chaco- (Short, 1975); residente, nidificante, poco común en Alto Paraná y común en centro, Ñeembucú, alto y bajo Chaco, campos cerrados y región matogrosense (Hayes, 1995) ; Perú; Surinam; Venezuela – Cerro Neblina- (Willard, Foster, Barrowclough, Dickerman, Cannell, Coats, Cracraft & O’Neill, 1991) y Colombia (Stotz et al.,1996)
En Argentina: Formosa (Contreras, (1987) y Contreras et al., (2014), citados en De la Peña 2016:553)
Misiones: PN Iguazú, raro, aunque posible residente (Saibene et al., 1996); (Chébez (2009), citado en Bodrati et al., 2012:67); (Bodrati, Areta & White, 2012). Isla San Martín (Savigny, 2010)
Citado para los Departamentos de Candelaria, Apóstoles, San Ignacio e Iguazú por Chébez (1996). Posada Puerto Bemberg (Bodrati et al, 2012)
Citado para la localidad de Corpus Christi, San Ignacio, Avistado por Krauczuk (2008) en Cuenca Baja y Media del Arroyo Santo Pipó (Dto. de San Ignacio) y en el Parque Natural Municipal Monte Seguín (Martínez-Gamba, 2014)
En Parque Provincial de las Sierras Ing. Raúl Martínez Crovetto (Obs. F. Gandoy in litt. (2011), citado en Bodrati et al, 2012:67-68); Reserva Privada Tupá Pojá (Krauczuk, (2006), citado en Bodrati et al., 2012:67-68); Barra Concepción (Campo Prates) (Krauczuk, 2006, AB obs. pers. 2005) y Gobernador Roca (citados en Bodrati et al (2012:67-68); Localidad de puerto Rico (En Krauczuk in litt. (2012), citado en Bodrati et al., 2012:67-68) Salta: (De la Peña, 1999);(De la Peña & Salvador, 2016); (Ortiz & Aráoz, 2015); (Bodrati,et al., 2012);(Moschione et al., (2012) lo citan en las Yungas; (Olrog, (1959) – lo considera probablemente Thalurania furcata baeri-). Coconier et al. (2007) lo consideran raro y visitante ocasional.
Corrientes: observado sin determinación de subespecie (Contreras & Contreras et al. 1990, citado en De la Peña, 1999:97)
Jujuy: citado por Burgos, Baldo & Cornell (2009) para la región de las Yungas.
Tucumán: (Olrog (1953), (Lucero (1983), citados en Ortiz & Aráoz, 2015:15). Registro en Tafí del Valle (Ortiz & Aráoz, 2015)
Ecorregiones: Chaco húmedo, Selva de Yungas, Selva paranaense (Barnett & Pearman, 2001)
Thalurania furcata baeri: noreste y centro de Brasil, sureste de Bolivia y norte de Argentina (Jujuy, Salta, Tucumán-Tafí del Valle) (Ortiz & Aráoz, 2015; Olrog, 1959; Burgos, Baldo & Cornell, 2009) y Formosa (Contreras, 1987 y Contreras et al., 2014, citados en De la Peña 2016:553)
Thalurania furcata eriphile: sureste de Brasil, este de Paraguay y noreste de Argentina (Misiones y norte de Corrientes?)
Hábitat: Selvas, Bosque húmedo (tanto bosque de tierra firme como en área en la Amazonia, donde muestra una preferencia notable por las brechas de luz) y borde del bosque, bosque secundario y semi-abierto, bosque montano, plantaciones y jardines sombreados; posiblemente en hábitats más frondosos en algunas partes del rango pero falta información más detallada. Tierras bajas hasta 1700 msnm (Stotz et al., 1996)
