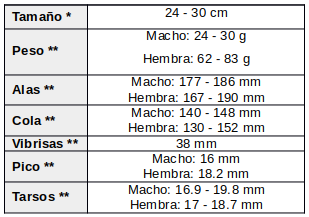
Es una especie bastante común que se distribuye en gran parte del este de América del Sur, desde la cuenca del Amazonas central hacia el sur, hasta el centro de Argentina. A pesar de que esta especie está muy extendida, apenas se conocen muchos aspectos de su biología.
NOMBRES COMUNES: Atajacaminos tijera (Argentina); Chotacabras de cola tijereta (Perú); Atajacaminos tijereta (Paraguay); Dormilón cola larga, Dormilón tijereta (Uruguay); Atajacaminos coludo chico, Chumuluco, Chumulucuco, Dormilón coludo, Ibiyaú cola de tixera, Yanarca, Ñañarca; Bacurau-tesoura, curiango-tesoura (Brasil); En guaraní le dicen “Yvyja’u jetapa, Ateí-yetapá” (de la Peña, 2020:238; Chébez, 1996:135)
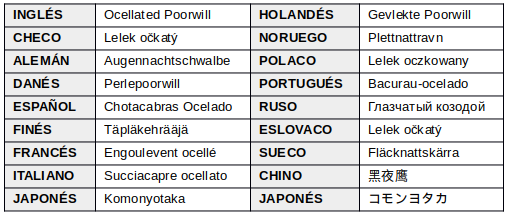
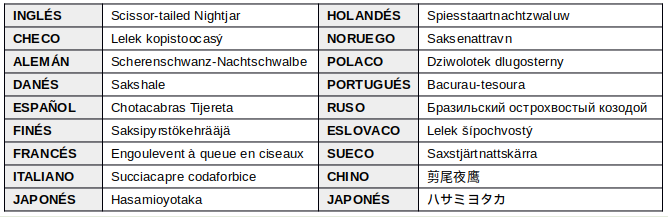
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS
- Ornithologie, ou, Méthode contenant la division des oiseaux en ordres, sections, genres, especes & leurs variétés : a laquelle on a joint une description exacte de chaque espece, avec les citations des auteurs qui en ont traité, les noms quils leur ont donnés, ceux que leur ont donnés les différentes nations, & les noms vulgaires. Brisson, Mathurin-Jacques, Martinet, François Nicolas. Parisiis: Ad Ripam Augustinorum, apud Cl. Joannem-Baptistam Bauche, bibliopolam, ad Insigne S. Genovesae, & S. Joannis in Deserto,1760. Vol 2: 481-483(Le Tette-Chèvre du Brèsil)
- Nouveau recueil de planches coloriées d’oiseaux : pour servir de suite et de complément aux planches enluminées de Buffon, édition in-folio et in-4⁰ de l’Imprimerie royale, 1770. Temminck, C. J., Buffon, G.L. Huet, N. Laugier de Chartrouse, Guillaume Michel Jerôme Meiffren, Baron, Prêtre, J. G. A Strasbourgh; Chez Legras Imbert et Comp., 1838. Vol 4: 209-211; lámina 158 (Caprimulgus psalurus)
- Apuntamientos para la historia natural de las Paxaros del Paraguay y Rio de la Plata. Azara Félix de. Madrid, 1802-1805. Vol 2: 538 (Ibiyaú cola de tixera)
- Nouveau dictionnaire d’histoire naturelle, appliquée aux arts, à l’agriculture, à l’économie rurale et domestique, à la médecine, etc. Par une société de naturalistes et d’agriculteurs. Paris,Chez Deterville,1816-19. Vol 10 (1817): 238 (Caprimulgus torquatus)
- Conspectus generum avium. Bonaparte, Charles Lucian. Lugduni Batavorum: Apud E.J. Brill,1850-1857. Vol 1: 59 (Hydropsalis psalurus)
- Zur Ornithologie Brasiliens : Resultate von Johann Natterers Reisen in den Jahren 1817 bis 1835. Pelzeln, August von, Natterer, Johann. Wien: A. Pichler’s Witwe & Sohn, 1871: pp 11. (Hydropsalis torquata)
- Catalogue of the birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London, 1874-98. Vol 16(1892): 598-599 (Hydropsalis torquata; hydropsalis furcifera)
- Argentine ornithology. A descriptive catalogue of the birds of the Argentine Republic. Sclater, P.L., Hudson, W. H. London: R. H. Porter, 1888-89. Vol 2:15-16; Lámina XII (Hydropsalis furcifera)