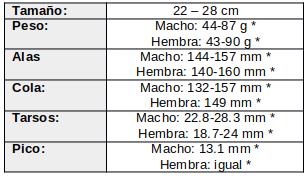
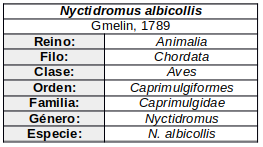
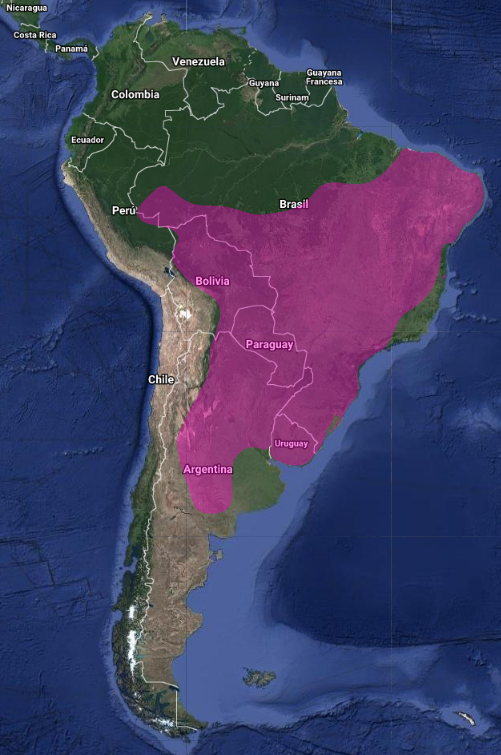
De hábitos crepusculares y nocturnos, excepto cuando se ve perturbado durante el día (Contreras et al., 2014:309; de la Peña, 2020:228). Los individuos se desplazan de forma aislada (ffrench, 1991:209) o en pequeños grupos familiares (Skutch, 1972:20; Quesnel, 1990:13), si bien es común que se produzcan aglomeraciones mayores durante la búsqueda de alimento (Reichholf & Reichholf, 1973; citados por Latta & Howell, 2015)
Se ha observado que, tanto las llamadas como la actividad nocturna, aumentan en la primavera a medida que la luna crece, y durante las noches iluminadas por la luna (Quesnel, 1990:14; Thurber, 2003:102).
Durante el día, los individuos descansan en el suelo entre la maleza y la cubierta del suelo; su plumaje crÍptico hace que su detección sea extremadamente difícil (Contreras et al., 2014:309). Cuando descansan, tienen la cabeza encogida y el cuerpo tendido, como otros caprimúlgidos, pero cuando se les acerca, pueden extender la cabeza y luego retraerla o levantar el cuerpo y luego volver a caer. Cuando se les molesta, los pájaros parecen muy alertas y se espantan fácilmente o, más raramente, caminan unos pasos. Ocasionalmente, después de ser espantados, se posan en un tronco o una rama baja, donde descansan en posición longitudinal para ayudar a ocultarse (Wetmore, 1968:210). No se conocen cambios en los patrones de actividad con la reproducción. A menudo está inactivo en climas fríos y por lo tanto se cree que está ausente (Peterson, 1960:135). Los sitios de descanso incluyen plantaciones, claros arbustivos, matorrales, bordes de bosques sobrecrecidos y aberturas hechas por humanos en regiones densamente boscosas (Slud, 1964:137). En la temporada de lluvias y cuando las áreas bajas están inundadas, generalmente seleccionan lugares de descanso ligeramente elevados a 3-10 m sobre el suelo (Wetmore, 1968:210). En la temporada de no reproducción, muchos individuos pueden instalarse en el mismo matorral o parche de maleza.
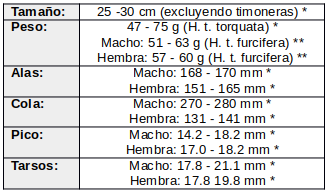
Con patas cortas pero bien desarrolladas, y más largas que las de sus parientes inmediatos, salta verticalmente 0.5 m del suelo (o ocasionalmente desde una percha en una roca o tronco) para atrapar insectos voladores bajos; también puede mover las alas durante el salto (Dickey & van Rossem, 1938:243). Ocasionalmente corre en el suelo para forrajear (Hartert, 1897:32) o puede caminar una corta distancia (Edwards, 1983:590). Mientras canta, puede levantarse “ligeramente en sus pies” sin perder contacto con la superficie de apoyo (Skutch, 1972:4). También se observó que flexionaba las piernas repetidamente en un movimiento de balanceo mientras estaba en el suelo (Hartman, 1961:11).
Durante el vuelo generalmente se mantiene a una distancia de 3 m del suelo (Oberholser 1974:478). Vuela al atardecer desde los sitios de nidificación diurnos hasta los terrenos de alimentación. Ocasionalmente realiza picadas circulares, para atrapar insectos por la noche, desde terrenos abiertos, rocas o postes de alambrado. Estos vuelos cortos generalmente terminan en el punto de partida o cerca de él (Skutch, 1972:4). Cuando son asustados, los individuos se alejan de forma errática y silenciosa (Oberholser 1974:478, Ridgely & Gwynne, 1989:194). El vuelo continúa a través o debajo de árboles y arbustos, no sobre ellos, hasta que el ave se posa en el suelo, a menudo cerca de su posición original (Skutch, 1972:4), a 15-20 m de distancia (Edwards, 1983:590-591), u ocasionalmente en una percha baja (Stiles & Skutch, 1989:201).
Los adultos, cuando incuban, es raro que se acicalen mientras están en el nido (quizás para mantener la discreción). Un individuo empapado por la lluvia salió del nido para acicalarse y rascarse cuando salió el sol (Skutch, 1972:13). El pie tiene los dedos altamente modificados que pueden ser usados para peinar las vibrisas (Edwards, 1983:590). Bostezan durante la incubación exponiendo el interior de la boca (Skutch, 1972:13).
VOCALIZACIONES
Las vocalizaciones de esta especie suelen ser emitidas casi exclusivamente durante la noche, especialmente al atardecer y al amanecer (Quesnel, 1990:14); raramente se escuchan llamadas durante el día (Wetmore, 1968:210). La vocalización aumenta en las noches claras de luna llena (Oberholser 1974:478; Quesnel, 1990:14); sin embargo, se reduce con la ausencia de luna, el frío, las nubes, la lluvia y el viento (Oberholser 1974:478). El canto, parecido a un silbido, está formado por 4 sílabas emitidas rápidamente en modulación ascendente de frecuencia y luego marcadamente descendente hacia el final que repiten esporádicamente (de la Peña, 2020:228)
Se presume que se producen desde el suelo o desde una percha baja. Pueden usar senderos para emitir sus cantos o usar otras perchas favoritas (Dickey & van Rossem, 1938:243).
Varios tipos de vocalizaciones. El llamado más distintivo de la especie, generalmente se describe como un grito extraño y afligido, o un silbido áspero o ronco, traducido como “¿Who are you?”….“Whaup, whaup-hoo-yoo”, generalmente traducido como “¿Quién eres?” (Snyder, 1966:126, ffrench, 1991:209) o “hip-hip hip-hip hip-hip-hooray”, pero existe una variación sustancial en las descripciones. No se sabe si la variación refleja diferencias geográficas en la canción o en las interpretaciones humanas.
Los diferentes autores lo describen así: en Texas, como un silbido áspero y brumoso, “pur pur perp pur-wheeeeeer”, que se acelera a medida que avanza la noche (Oberholser 1974:478); en Costa Rica, un ronco o tembloroso “who-whick who-whick whick wick-wick-wik wik wip WHEEEEUR” o “kw-kw, kw-kw, kw-kw. kw, kw, kwah-REE-O”, o un repetido, incesante y ronco “krrweeo” o “cuyeer” (Stiles & Skutch, 1989:201); en Venezuela, un áspero y fuertemente acentuado “whoo-oo-WE-oo” y un repetido “whip-whip-whip-whip” (Meyer de Schauensee & Phelps, 1978:125; Cleere, 1998:184); en Trinidad, un similar, agudo “hip-hip-hip” (ffrench, 1991:209); en Surinam, un silbido sibilante, “wook, wook, wook, wook, wook-a-whee-ooh, a-wee-ooh, a-wee-ooh, a-wee-ooh” (Haverschmidt & Mees 1994:166); y en Brasil, la canción se describe como “go-bee-oo, gril-woo, cohrianGOO” (Sick, 1997:418). En Costa Rica se estudiaron canciones de 17 machos individuales y los autores demostraron que variaban significativamente en frecuencia y otras características; algunos machos cantaban solos, otros como parte de grupos (Sandoval & Escalante, 2011:182). Aunque intentaron controlar todas las posibles causas externas de variación en las características de la canción durante el diseño de la muestra y las sesiones de grabación, no llegaron a conclusiones definitivas porque no compararon la canción del mismo individuo entre múltiples sesiones de grabación, como se propone en el nuevo enfoque para demostrar la singularidad individual. La variación masculina que encontraron podría usarse como una señal para permitir el reconocimiento de machos individuales porlas hembras o por otros machos. Encontraron que los machos en grupos tienden a cantar canciones con características más similares que con grupos distantes. Se necesitan más estudios con machos marcados para determinar si las hembras prefieren características de canción masculina particulares, y si las preferencias femeninas podrían explicar las diferencias estructurales y los patrones de canción de los machos de esta especie. También es importante determinar el papel de la canción en las interacciones macho-macho, cómo los machos forman los grupos y si estos grupos son estables a través del tiempo.
De acuerdo con Thurber (2003:101), existe una aparente imitación de canciones entre vecinos en El Salvador. Esta afirmación necesita ser confirmada en otros lugares.
Emiten diferentes “llamadas”, a menudo descritas como gruñidos, notas guturales y gargarismos similares al croar de una rana (Slud, 1964:137), pero también un “waa-oo” nasal de tono más bajo y “ba-bacoorau” en Brasil. Asimismo, se registra un “whoo” soprano de tono alto y claro, además de un “llamado muy diferente”, descrito como “muy bajo” y que seguramente se pierde a distancias mayores a 3 metros (Snyder, 1966:126; Stiles & Skutch, 1989:201; ffrench, 1991:209; Sick, 1997:418; Skutch, 1972:16; Latta & Howell, 2015). No se conoce la función de estos sonidos.
Emplean un llamado bajo y cacareante para atraer a los polluelos (Bent, 1940:201; Cleere, 1998:184).
Durante la época de apareamiento, la mayoría de las vocalizaciones están relacionadas con los eventos reproductivos (Wetmore, 1968:210; Quesnel, 1990:12; Cleere, 1998:184 ). Tienden a disminuir sus cantos durante la muda y la temporada no reproductiva (Oberholser, 1974:478; Thurber, 2003:102; Bodrati, 2004:34), especialmente entre julio y septiembre (Quesnel, 1990:12) o julio y octubre (Skutch, 1972:6). En América Central, parecen ser particularmente sensibles a la temporada de lluvias, cuya duración varía según la región, con poco canto incluso en las noches más luminosas de luna llena (Skutch, 1972:6).
TERRITORIALIDAD
No se observó comportamiento territorial interespecífico. El uso de caminos puede estar asociado con el establecimiento de territorios (Quesnel 1990:12), pero la falta de predominio de los machos sugiere otros usos como el de alimentación (Quesnel, 1990:14).
ALIMENTACIÓN
Se alimenta principalmente de coleópteros, comúnmente conocidos como escarabajos. Principalmente de la familia Scarabaeidae, pero también otros como cascarudos (Elateridae), escarabajos tigre (Cicindelinae), escarabajos barrenadores de la corteza (Ostomidae), escarabajos de cuernos largos (Cerambycidae), luciérnagas (Lampyridae), barrenadores de ramas (Bostrichidae).
Insectos como la hormiga león (Myrmeleontidae), chinches (Pentatomidae), langostas (Acrididae), mariposas y polillas (Lepidoptera) y abejas y avispas (Hymenoptera) (Bent, 1940:203). En Panamá, Surinam y Costa Rica, también se alimenta coleópteros como “bessbugs” (Passalidae), escarabajos picudos o gorgojos (Curculionidae), e insectos como moscas (Diptera), mantis religiosa (Mantispidae), saltamontes (Acrididae), zancudos (Tipulidae) y escarabajos del barro (Heteroceridae) (Wetmore, 1968:210; Haverschmidt & Mees, 1994:166; Edwards, 1983:591). En Yucatán, un joven Pauraque fue encontrado ingiriendo piedras (Jenkinson & Mengel, 1970:237), mientras que en Panamá se hallaron cabezas duras e indigeribles de escarabajos y “pequeñas semillas blancas duras” en dos estómagos. Estas semillas y piedras pueden servir para ayudar a triturar los alimentos.
Generalmente se alimenta en claros y áreas abiertas al anochecer y durante la noche, incluyendo carreteras (Van Rossem, 1927:27; Quesnel, 1990:12), sabanas (ffrench, 1991:208), campos de maíz (Van Rossem, 1927:27), bordes de arroyos, y ocasionalmente en huecos en áreas boscosas (Wetmore, 1968:210). Puede haber una variación estacional en los lugares de alimentación en algunas regiones (Foster & Johnson, 1974), ya que en Costa Rica los únicos pájaros observados en julio y agosto se encontraban en el bosque ribereño del río. Reicholf & Reicholf (1973, citados por Latta & Howell, 2015) informaron sobre un gran grupo de aves alimentándose (542 individuos) en Mato Grosso, Brasil, que incluía 5 especies de caprimúlgidos: 20 Hydropsalis brasiliana, 10 Caprimulgus parvulus, 2 C. rufus, 4 Podager nacunda y 2 Nyctibius griseus. Todas estas especies fueron encontradas juntas al anochecer a lo largo de 100 km de un camino de tierra.
Atrapa sus presas y se alimenta principalmente de forma terrestre; vuela muy poco mientras recolecta alimento. Aparece brincando, saltando o, en contadas ocasiones, corriendo por el suelo (Oberholser, 1974:478; Van Rossem, 1927:27; Hartert, 1897:32). Puede lograr saltar más de 0,5 m, con ayuda de un ligero giro de sus alas (Dickey & van Rossem, 1938:243). También puede brincar (Slud, 1964:137) o “sacudirse” (Meyer de Schauensee & Phelps, 1978:124) cerca del suelo para capturar insectos voladores de baja altura, o hacer vuelos cortos, aunque generalmente se limita a recorrer entre 0,3 y 3,0 m en el aire (Oberholser, 1974:478). Cuando forrajea en el aire, generalmente realiza vuelos bajos, breves y circulares para atrapar insectos voladores desde el suelo o desde una percha, roca, tronco, rama o poste cercano. Durante la temporada de lluvias en Panamá, cuando las zonas bajas están inundadas, es más probable que se posen fuera del suelo (3-10 m) (Wetmore, 1968:210). En Trinidad, comienza a cazar aproximadamente 20-25 minutos después del atardecer y parece ser más activo con la luna llena (Quesnel, 1990:14). Sin embargo, en Guatemala se ha observado que es más activo durante los periodos de luna menguante que en los de luna llena o en la oscuridad (Smithe, 1969). Se sabe que también caza bajo luces artificiales (Thurber, 2003:103).
Esta especie se caracteriza por tener una boca con una abertura muy grande, lo que facilita el forrajeo. Se presume que usa la vista para detectar insectos por silueteado o iluminación trasera de la presa contra el cielo. La presencia de un tapetum lucidum (Nicol et al., 1974:351), una estructura reflectante dentro de la coroides del ojo que mejora la visión nocturna al reflejar la luz hacia la retina, sugiere que los ojos están adaptados a condiciones de poca luz. La estructura retiniana del ojo (altamente dominada por bastones) ha sido bien estudiada por Rojas et al. (2004:19), y muestra una sensibilidad retiniana alta. No existen evidencias de que esta especie utilice la ecolocalización para la captura de alimentos.
METABOLISMO
Según Scholander et al. (1950:264) y Lasiewski & Dawson (1964:484), los Pauraques, como algunos otros Caprimúlgidos, tienen tasas metabólicas básicas más bajas que la mayoría de las otras aves de un tamaño comparable. La tasa metabólica basal del Pauraque se ha informado como 1.5-2.3 cc 02/g/h (Scholander et al. 1950:267).
En respuesta al estrés térmico, muchos Caprimúlgidos, incluyendo el Pauraque, aumentan la disipación de calor al jadear (reforzado por la gran apertura de la boca) y con el temblor gular (Skutch, 1972:12).
REPRODUCCIÓN
En Texas, se reproduce desde principios de marzo hasta julio-agosto (Bent, 1940:205; Cleere, 1998:185; Oberholser, 1974:478); en Trinidad y Tobago entre febrero y julio (Belcher & Smooker, 1936, citados por Latta & Howell, 2015; Quesnel, 1990:12; Cleere, 1998:185); entre febrero y mayo/junio en Panamá (Wetmore, 1968:211; french, 1991:209; Cleere, 1998:185); entre enero y mayo en Colombia (Hilty & Brown, 1986:294; Cleere, 1998:185); a principios de abril-mayo en El Salvador (Dickey & van Rossem, 1938:243); entre febrero y abril/mayo en Costa Rica (Stiles & Skutch, 1989:201; Cleere, 1998:185). Huevos encontrados en Surinam en todos los meses excepto febrero; el pico es mayo-septiembre (Haverschmidt & Mees, 1994:166; Cleere, 1998:185); agosto a noviembre en el sureste de Brasil (Vasconcelos et al., 2003:145) y según Cleere, 1998:185 septiembre?-enero?. No se ha registrado una segunda puesta (Harrison, 1978:181).
Esencialmente, no hay estructura de nido, aunque ocasionalmente se puede formar una depresión parecida a un platillo sobre el sustrato; los huevos se depositan simplemente en el suelo, en terrenos desnudos y planos, pero pueden anidar sobre hojas caídas (ffrench, 1991:209; Haverschmidt & Mees, 1994:166; Baicich & Harrison, 1997:193; Vasconcelos et al., 2003:142). Se han observado nidos tanto en la sombra como en el sol directo (Dickey & van Rossem, 1938:243-244; Stiles & Skutch, 1989:201).
Los nidos se encuentran dispersos entre los matorrales, bosques de tierras bajas, pequeños claros en las plantaciones, bordes de campos o a lo largo de los bordes más lejanos de los claros o senderos. No anidan en los matorrales espesos, como los que utilizan como refugio durante el invierno, sino que buscan terrenos más altos y abiertos evitando las colinas rocosas (Bent, 1940:200). En hábitats más abiertos, el nido puede estar oculto por un arbusto, generalmente entre arbustos dispersos y cactus. En El Salvador, los nidos se encuentran tanto en sombra como en sol directo (Dickey & van Rossem, 1938:243-244); en Costa Rica, el nido suele estar en un lugar sombreado de un sitio bastante abierto (Stiles & Skutch, 1989:201).
De acuerdo con Oberholser (1974:478), Howell y Webb (1995:375), Edwards (1983:592), Smithe (1969, citado por Latta y Howell, 2015), ffrench (1991:209), De la Peña (1990) y Hilty y Brown (1986:294), se han registrado puestas, generalmente de dos huevos en, Texas, México, Costa Rica, Guatemala, Trinidad/Tobago, Argentina y Colombia. Por otra parte, Haverschmidt y Mees (1994:166) reportan que, en Suriname, de doce puestas, solo una fue de dos huevos, mientras que las once restantes consistieron en uno solo.
Huevos elípticos o sub-elípticos (Wetmore, 1968:211; Harrison, 1978:181) de superficie lisa, sin brillo o ligeramente brillante. Color crema, salmón o más brillante que el tono vináceo, con marcas dispersas o densas de color marrón rojizo, canela y/o rosa, gris, y lila pálido; ocasionalmente con algunas líneas negras o con marcas concentradas alrededor del extremo más grande. Los detalles se encuentran en Vasconcelos et al. 2003.


El intervalo entre la puesta de los huevos fue de al menos 2 días (Skutch, 1972:8; Skutch, 1976:137). En cuanto a la incubación la información es escasa: en Costa Rica, algunos adultos fueron observados sentados sobre el primer huevo antes de la puesta del segundo (Skutch, 1972:8).
Se estima que el tiempo de incubación es de 10-20 días.
Los huevos se mantienen casi constantemente cubiertos, tal vez para reducir la pérdida de color que los haría visibles a los depredadores (Skutch, 1976:146). Macho y hembra alternan la incubación durante el día, generalmente pasando 2-3 horas en cada turno, pero se han registrado turnos de incubación de 6 horas (Skutch, 1972:9; Skutch, 1976:174; Edwards, 1983:592; Vasconcelos et al., 2003:143). El macho generalmente incuba durante el día, aunque puede descuidar el nido durante horas por la tarde. La incubación nocturna es difícil de observar, pero es realizada principalmente por la hembra (Skutch, 1972:11).
Posicionan los huevos con el pico para luego, mediante movimientos laterales del cuerpo, colocarse sobre ellos. Estos movimientos laterales continúan a intervalos ampliamente espaciados, pero pueden aumentar después de la lluvia o bajo el sol directo. Durante la lluvia, algunos individuos se sientan más alto en el nido. Los párpados del adulto están en constante movimiento, cambiando el diámetro de la pupila mientras incuba (Skutch, 1976:175). Los individuos que incuban también pueden bostezar, abrir y cerrar el pico, hacer temblar la gular o producir sonidos de “clic” (Skutch, 1972:13).
Puede mudar de sitio los huevos si es molestado (Euler, en Alvarenga, 1999:39); sin embargo Skutch (1972:21 y 1976:148) observó que los padres nunca movieron los huevos desde su ubicación original, en respuesta a los múltiples disturbios ocasionados (por ejemplo, visitar el nido, medir los huevos, erigir pantallas cerca de los nidos).
Crías semi-precociales (Skutch, 1976:230; Baicich & Harrison, 1997:193) cubiertos casi completamente por una larga y suave capa de plumón salmón oscuro con puntas negras (Skutch, 1972:15; Bodrati, 2004:35; de la Peña, 2020:229).
No hay datos de crecimiento. Los ojos de los polluelos se abren parcialmente después de la eclosión. Los pichones pueden moverse a corta distancia, incluso el mismo día de haber nacido (Cleere, 1998:185). Cambian de sitio en respuesta a las llamadas de los adultos (Sick, 1997:416; Baicich & Harrison, 1997:193; Cleere, 1998:186). Los polluelos pían a los 2-3 días (Skutch, 1972:16; Cleere, 1998:184).
Los jóvenes son alimentados por la noche, presumiblemente por ambos padres (ffrench, 1991:209). La punta estrecha del pico se inserta en la boca del polluelo, donde los insectos son regurgitados (Harrison, 1978:181). Los jóvenes son capaces de estirar sus cuerpos y cuellos para recibir comida (Skutch, 1972:16).
Son cuidados por ambos adultos. Los polluelos permanecen con sus padres hasta algún tiempo después de que estén completamente crecidos y sean capaces de volar (Skutch, 1972:21). Los jóvenes pueden acompañar a sus padres a áreas de alimentación, como lo ha registrado Quesnel (Quesnel, 1990:12) que observó grupos de 3 aves alimentándose juntas, en pleno verano, en varias ocasiones. Se han observado grupos familiares de 3-4 individuos, a finales de agosto, en El Salvador (Dickey & van Rossem, 1938:244) y Costa Rica (Foster & Johnson, 1974, citados por Latta & Howell, 2015).