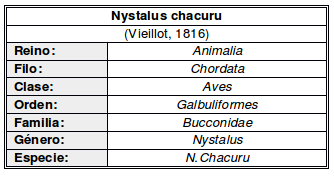
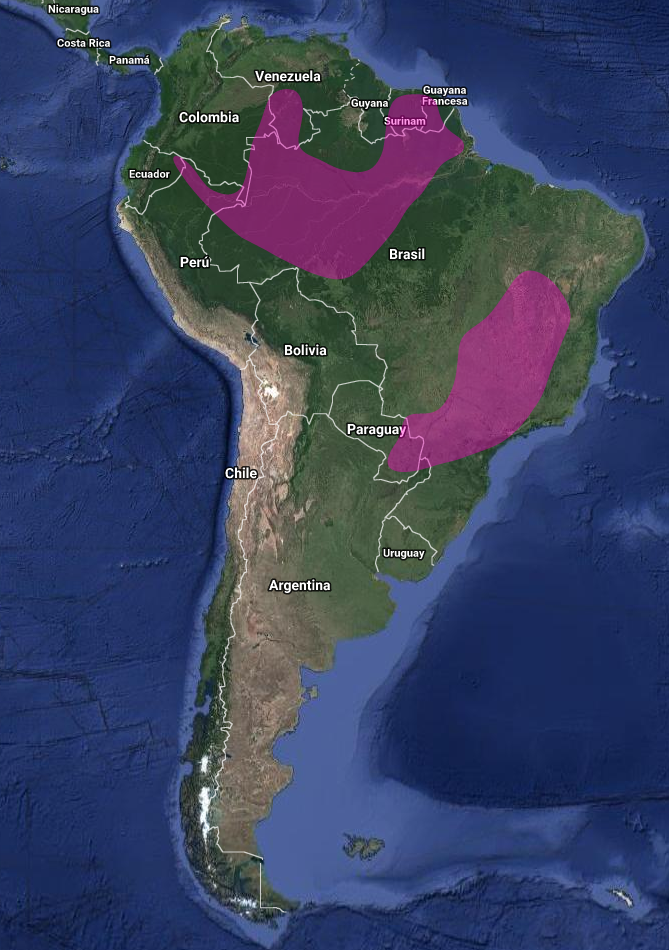
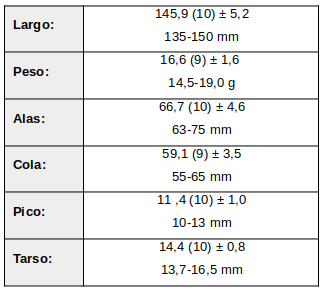
Principalmente residente; aparentemente migratoria en el extremo Sur de Brasil, a veces en bandadas mixtas (Sick, 1993:366; Sick, 1997:487).
Solo o en pareja (Schulenberg et al., 2007:266); especie arbórea, posa en lugares abiertos en ramas altas y expuestas, cables o alambradas (Eckelberry, 1962:1; Sick, 1993:366; Narosky & Chebez, 2002:68). Fácil de detectar. Permite gran aproximación, sin inquietarse. Mueven la cola y se colocan en posición erecta sobre la percha cuando están vigilantes o alerta (Sick, 1993:366; Sick, 1997:487).
Vuelo corto y torpe.
Se ha observado que es capaz de disminuir su temperatura corporal y entrar en letargo durante el tiempo frío (Sick, 1993:328; Rasmussen et al, 2020).
Muda: según los autores, Silveira & Marini (2012:437), reemplaza las primarias en dos series de muda y posiblemente no muda completamente sus secundarias cada año.
Vocalizaciones:
Canción fuerte y silbada que consta de estrofa tri-silábica, trémula y descendente, «Füfü.fefe.füfü.fefe.füfüfü…”, a menudo en pareja a dúo «türü türü türü» emitido en todas las horas del día incluso en las horas de mayor calor, pero más frecuentemente al anochecer, cuando toda la población local participa del coro; el llamado de advertencia es un “rr-rr-rr” (Sick, 1997:487; Straneck, 1990:28; de la Peña, 2020:30). Schulenberg et al., (2007:266), la describen como «dúo antifonal, una agradable serie descendente, grave y silbada de frases “co-lo” respondidas por un “de-le” más alto, por lo tanto “co-lo’de-le co-lo’de-le co-lo’de-le…”. Baten las mandíbulas si están alterados (Sick, 1993:366)
ALIMENTACIÓN
Caza desde perchas de nivel medio en árboles y arbustos, según lo documentado por Sick (1993:366). Se postula que esta especie presenta una dieta oportunista, principalmente insectívora, aunque no se descarta la inclusión de otros invertebrados, así como pequeños vertebrados en su alimentación. Entre los vertebrados capturados, se incluyen lagartos (Squamata) de las especies Polychrus acutirostris y Cnemydophorus sp., así como el mamífero marsupial Monodelphis americana, comúnmente capturados del suelo, según lo indicado por Crozariol & Gomes (2010:4).
Además, se ha observado la inclusión de anfibios, como Rhinella cf. pombalia y especies de los géneros Leptodactylus y Scinax, en la dieta de esta especie (Gomes, 2009:8; Crozariol & Gomes, 2010:4). Se destaca que algunas especies de anfibios consumidos pueden poseer veneno, si bien la especie estudiada parece tener una relativa resistencia al mismo. Asimismo, se han reportado presas de hasta 19 cm de longitud en el contenido del estómago (Schubart et al., 1965:178).
En cuanto a los invertebrados, se ha observado la ingesta de avispas, coleópteros, homópteros, lepidópteros, así como otros insectos grandes atrapados en el aire, larvas de insectos, milpiés, ciempiés, escorpiones e incluso gusanos aterciopelados y cangrejos (Raw, 1997:91; Crozariol & Gomes, 2010:4).
Se ha documentado la ingesta de materia vegetal (Sick, 1993:366), así como el consumo de agua acumulada en hojas. Además, se ha observado la expulsión de pellets con restos de quitina de insectos consumidos (Sick, 1993:366). Por último, Bodrati y Salvador (2015:82) reportaron la ingesta de termitas por parte de esta especie en la Provincia de Misiones, Argentina (de la Peña & Salvador, 2016:30; de la Peña, 2020:30).
REPRODUCCIÓN
En la época reproductiva machos y hembras cantan, respondiéndose uno a otro los llamados y formando coros de varias parejas.
Se reproducen en Brasil, entre septiembre y enero/febrero en el Sureste y al inicio de las lluvias en el Centro (de la Peña & Salvador, 2016:30; de la Peña, 2020:30; Rasmussen et al, 2020)
En Argentina, se localizaron nidos en Misiones San Ignacio, dto San Iganacio (Uranga in litt) y en Capioví (Dto Lib. Gral San Martín) en octubre y noviembre (de la Peña, 2013:217; de la Peña & Salvador, 2016:30; de la Peña, 2020:30)
Nido excavado en el suelo o en un barranco, ocasionalmente en cortes de carreteras o terraplenes de vías férreas. Expuesto. A baja altura. (de la Peña, 2013:217; de la Peña & Salvador, 2016:30; de la Peña, 2020:30)
Puesta de 2 a 4 huevos blancos y brillantes (Dubs, 1992:64; de la Peña & Salvador, 2016:30; de la Peña, 2020:30).

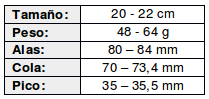 (Belton, 1984:583; Dubs, 1992:64; Schulenberg et al., 2007:266; de la Peña, 2015:372; de la Peña, 2016:30; de la Peña, 2020:30; Rasmussen et al, 2020)
(Belton, 1984:583; Dubs, 1992:64; Schulenberg et al., 2007:266; de la Peña, 2015:372; de la Peña, 2016:30; de la Peña, 2020:30; Rasmussen et al, 2020)