- Abbot, C. G. (1914). City nighthawks. Bird-Lore 16 (1): 10–13. (enlace)
- Aldridge, H. D. J. N. & R. M. Brigham (1991). Factors influencing the foraging time in two aerial insectivores; the bird, Chordeiles minor and the bat, Eptesicus fuscus. Canadian Journal of Zoology 69:62-69. (enlace)
- Antelo, C. M. & Z. J. Brandán Fernández (2013). Las aves no Passeriformes de Tucumán, Argentina. Miscelánea 132. Fundación Miguel Lillo, Argentina. (enlace)
- American Ornithologists’ Union (1983). Check-list of North American Birds. Edition 6. American Ornithologists’ Union, Lawrence, KS, USA. (enlace)
- Armstrong, J. T. (1965). Breeding home range in the nighthawk and other birds; its evolutionary and ecological significance. Ecology 46:619-629. (enlace)
- Babarskas, M., E. Haene & J. Pereira (2003). Aves de la Reserva Natural Otamendi. En Haene, E. y J. Pereira (Eds.). Fauna de Otamendi. Inventario de los animales vertebrados de la Reserva Natural Otamendi, Campana, Buenos Aires, Argentina. Temas de Naturaleza y Conservación. Monografía de aves argentinas 3: 47-113. Aves Argentinas/AOP. Buenos Aires. (enlace)
- Barnett, J. M. & Pearman, M. (2001). Lista Comentada de las Aves Argentinas. Ed. Lynx (1º Ed.). Barcelona, España
- Barrowclough, G. F., J. G. Groth & L. A. Mertz (2006). The RAG-1 exon in the avian order Caprimulgiformes: Phylogeny, heterozygosity, and base composition. Molecular Phylogenetics and Evolution 41 (1):238-248. (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Pt. 1: Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 4:371–631. (enlace)
- Bent, A. C. (1948). Life Histories of North American Cuckoos, Goatsuckers, Hummingbirds, and their Allies. US National Museum Bulletin 176. Smithsonian Institution, Washington, D.C. (Reprinted by Dover Publications, New York). 506 pp. (enlace)
- Binford, L. C. (1989). A Distributional Survey of the Birds of the Mexican State of Oaxaca. Ornithological Monographs 43. American Ornithologists’ Union. Washington, DC, USA. (enlace)
- BirdLife International (2022) Species factsheet: Chordeiles minor. Downloaded from http://www.birdlife.org on 02/10/2022.
- Blem, R. (1972). Stomach capacity in the Common Nighthawk. Wilson Bull.. 84(4): 492-493. (enlace)
- Bodrati, A. & A. Pietrek (2000). Relevamiento de los recursos biológicos del Parque Provincial “Pampa del Indio” (Departamento Libertador Gral. San Martín, Chaco). AOP. Inf. Inéd. Buenos Aires.
- Bodrati, A. (2005a). Notas sobre la Avifauna del Parque nacional Chaco, el Parque Provincial Pampa del Indio y otros sectores de la Provincia de Chaco, Argentina. Revista Nuestras Aves, 49:15-23 (enlace)
- Bodrati, A. (2005b). Parque Nacional Chaco. En A. S. Di Giacomo (editor). Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 98-99. Temas de Naturaleza y Conservación 5. Aves Argentinas/Asociación Ornitológica del Plata. Buenos Aires. (enlace)
- Bodrati, A., E. Mérida, G. Bodrati & E. Sierra (2006). Avifauna del talar de Vuelta de Obligado y de sus ambientes contiguos. San Pedro, Provincia de Buenos Aires, Argentina. Pp.: 117-124, en: Mérida, E. y J. Athor (Editores). Talares bonaerenses y su conservación. Fundación de Historia Natural “Félix de Azara”. Buenos Aires. (enlace)
- Bodrati, A., K. Cockle, J. M. Segovia, I. Roesler, J. I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga 32: 41-64. (enlace)
- Bodrati, A. & J. I. Areta (2010). Dos nuevos dormilones para la avifauna argentina (Chordeiles acutipennis y Caprimulgus maculicaudus) y comentarios sobre hábitat, comportamiento y geonemia en Paraguay. Hornero 25 (2): 67-73. (enlace)
- Bodrati, A., J. I. Areta & E. White (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves 57: 63-80. (enlace)
- Bostwick, K. S. & M. J. Brady (2002). Phylogenetic analysis of wing feather taxis in birds: Macroevolutionary patterns of genetic drift? Auk 119:943–954. (enlace)
- Bowles, J. H. (1921). Nesting habits of the Nighthawk at Tacoma, Wash. Auk. 38: 203-217. (enlace)
- Boyce, M. S. (1980). Possible competitive displacement between Common Nighthawks and bats in southwestern Oregon. Murrelet. 61(1): 35. (enlace)
- Brandán, Z. J. & C. I. Navarro (2009). Lista actualizada de las aves de la provincia de Tucumán. Fundación Lillo. Tucumán. (enlace)
- Braun, M. J. & C. J. Huddleston (2009). A molecular phylogenetic survey of caprimulgiform nightbirds illustrates the utility of non-coding sequences. Molecular Phylogenetics and Evolution 53 (3):948-960. (enlace)
- Browning, M. R. (1978). An evaluation of the new species and subspecies proposed in Oberholser’s Bird Life of Texas. Proceedings of the Biological Society of Washington 91: 85–122. (enlace)
- Brewer, R. G., A. McPeak & R. J. Adams Jr. (1991). The Atlas of Breeding Birds of Michigan. Michigan State University Press, East Lansing, MI, USA.
- Brigham, R. M. (1989). Roost and nest sites of the Common Nighthawk: are gravel roofs important? Condor 91:722-724. (enlace)
- Brigham, R. M. (1990). Prey selection by big brown bats (Eptesicus fuscus) and Common Nighthawks (Chordeiles minor). American Midland Naturalist 124:73-80. (enlace)
- Brigham, R. M. & M. B. Fenton (1991). Convergence in foraging strategies by two morphologically and phylogenetically distinct aerial insectivores. Journal of Zoology (London) 223:475-489. (enlace)
- Brigham, R. M. (1994). Goatsuckers: just feathered bats? Cordillera 1 (2):12-17. (enlace)
- Brigham, R. M. & R. M. R. Barclay (1995). Prey selection by Common Nighthawks: does vision impose a constraint? Écoscience 2 (3):276-279. (enlace)
- Brigham, R. M., K. H. Morgan & P. C. James (1995). Evidence that free-ranging Common Nighthawks may enter torpor. Northwestern Naturalist 76 (3):149-150.
- Brigham, R. M., M. B. Fenton & H. D. J. N. Aldridge (1998). Flight speed of foraging Common Nighthawks (Chordeiles minor): Does the measurement technique matter? American Midland Naturalist 139 (2):325-330. (enlace)
- Brigham, R. M., J. Ng, R. G. Poulin & S. D. Grindal (2020). Common Nighthawk (Chordeiles minor), version 1.0. In Birds of the World (A. F. Poole, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.comnig.01
- Brodkorb, P. (1938). Further additions to the avifauna of Paraguay. Occasional Papers of the Museum of Zoology University of Michigan. N.º 394: 1-5 (enlace)
- Brodkorb, P. (1971). Catalogue of fossil birds, Part 4 (Columbiformes through Piciformes). Bulletin of the Florida State Museum, Biological Sciences 15:163–267 (enlace)
- Bryant, H. C. & A. M. Bryant (1945). Another nighthawk migration on an Arizona desert. Condor 47:268. (enlace)
- Burgos, F. G., J. L. Baldo & F. M. Cornell (2009). Lista de las aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. S. S. de Jujuy (enlace)
- Caccamise, D. F. (1974). Competitive relationships of the Common and Lesser nighthawks. Condor 76:120. (enlace)
- Campbell R. Wayne Campbell, Martin K. McNicholl, R. Mark Brigham & Janet Ng (2006). Wildlife Data center (enlace)
- Cherrie, G. K. (1896). A new Chordeiles from Costa Rica. Auk 13:136. (enlace)
- Cornell Lab of Ornithology (2021). The Clements Checklist. Checklist dataset https://doi.org/10.15468/3jnxf3 accessed via GBIF.org on 2022-04-19.
- Contreras, J. R. (1981). Lista preliminar de la avifauna correntina. I. No Passeriformes. Historia Natural 2: 21-28.
- Contreras, J. R. (1983). Notas sobre el peso de las aves argentinas. I. Historia Natural 3 (1): 16.
- Contreras, J. R. (1987). Lista preliminar de la avifauna de la provincia de Formosa, República Argentina. Historia Natural VII (4): 33-52.
- Contreras, J. R. (1990a). Datos reproductivos de 45 especies de aves passeriformes que anidan en el valle aluvial del Riachuelo, noroeste de Corrientes, Argentina. Nótulas Faunísticas 22: 1-4.
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti, & E. E. Utges (1990b). Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Volumen 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1.
- Contreras, J. R., F. Agnolin, Y. E. Davies, I. Godoy, A. Giacchino & E. Ríos (2014). Atlas ornitogeográfico de la provincia de Formosa, República Argentina. 1o Ed. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 pp (enlace)
- COSEWIC (2007). Status Report on the Common Nighthawk Chordeiles minor in Canada 2007 (enlace)
- Cowles, R. B. & W. R. Dawson (1951). The cooling mechanism of the Texas Nighthawk. Condor 53:19-22. (enlace)
- Cuello, J. P. (1975). Las Aves del Uruguay (Suplemento I). Com. Zool. Mus. Hist. Nat. Montevideo, 10 (139):1-27.
- Cummings, J. L., P. A. Pochop, Jr. Davis, J. E. & D. L. York (2002). Translocating Common Nighthawks at McConnell Air Force Base, Kansas, to reduce aircraft strikes. Paper read at Proceedings of the 4th Bird Strike Committee-USA/Canada Meeting, at Sacramento, CA, 21-24 Oct 2002. (enlace)
- Cummings, J. L., P. A. Pipas, J. C. Luchsinger, Jr. Davis, J. E., M. J. Pipas & J. B. Bourassa (2003). Managing Common Nighthawks at McConnell Air Force Base, Kansas, to reduce aircraft strikes. Paper read at Proceedings of the 10th Wildlife Damage Management Conference. (enlace)
- Chatellenaz, M. L., Cano, P. D., Saibene, C., & Ball, H. A. (2010). Inventario de las aves del Parque Nacional Mburucuyá (Provincia de Corrientes, Argentina). Acta Zoológica Lilloana, 54(1-2), 139–160. Recuperado a partir de http://www.lillo.org.ar/journals/index.php/acta-zoologica-lilloana/article/view/391
- Chatellenaz, M. L., Thomann, M. L. & J. M. Fernández (2021). Avifauna del Parque Provincial San Cayetano, Provincia de Corrientes, Argentina. Nótulas Faunísticas; Segunda Serie, 311: 1-14 (enlace)
- Chébez, J. C. (1996). Fauna Misionera, Catálogo Sistemático y Zoogeográfico de los Vertebrados de la Provincia de Misiones (Argentina). Editorial L.O.L.A. (Literature of Latin America), Buenos Aires, Argentina. 320 pp.
- Chesser, R. T., S. M. Billerman, K. J. Burns, C. Cicero, J. L. Dunn, B. E. Hernández-Baños, R. A. Jiménez, A. W. Kratter, N. A. Mason, P. C. Rasmussen, J. V. Remsen, Jr., D. F. Stotz & K. Winker (2022). Check-list of North American Birds (online). American Ornithological Society. (enlace)
- Darrieu, C. A. & A. R. Camperi (2001). Nueva lista de las aves de la Provincia de Buenos Aires. Cobiobo No 3- Probiota No 2. Sec. de Política Ambiental. UNLP. Buenos Aires. (enlace)
- Darrieu, C. A., Camperi, A. R., Piloni, G. & N. Bogado (2013) Lista actualizada de las aves de la Provincia de Buenos Aires. Fundación de Historia Natural Félix de Azara. p.1-55 (enlace)
- De Graff, K. (1978). Large concentrations of Common Nighthawks. Blue Jay 36:122. (enlace)
- De la Peña, M. R. (1988). Nuevos registros o aves poco citadas para Santa Fe. Nuestras Aves 16: 17-18.
- De la Peña, M. R. (1999). Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. (Literature of Latin America). Monografía 18. Buenos Aires, Argentina
- De la Peña, M. R. (2006). Lista y Distribución de las Aves de Santa Fe y Entre Ríos. Monografía I. Editorial L.O.L.A. (Literature of Latin America). Buenos Aires, Argentina. 137 pp.
- De la Peña, M. R., Laene Silva, R., Capuccio, G. & Bonin, L. M. (2009). Aves del Río Uruguay, Guía Ilustrada de Especies del Bajo Uruguay y el Embalse de Salto Grande. Comisión Administradora del Río Uruguay, CARU. 247 pp. (enlace)
- De la Peña, M. R. (2011a). Atlas ornitogeográfico de la provincia de Santa Fe. Serie Naturaleza y Conservación No 4. Pág. 1-500.
- De la Peña, M. R. & R. F. Tittarelli (2011b). Guía de aves de La Pampa. Santa Rosa. Gobierno de La Pampa.
- De la Peña, M. R. (2015). Aves Argentinas. Incluye nidos y huevos. Ed. U.N.L. (1º Ed.). Buenos Aires, Argentina. 496 pp.
- De la Peña, M. R. (2020). Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Año 2020 | N° 6 | Pág. 1-348| ISSN 0325-3856
- Delhey, R. (1992). Algunas aves nuevas o poco conocidas para la región de Bahía Blanca. Nuestras Aves 27: 31-32 (enlace)
- del Hoyo, J. (2020). All the Birds of the World. Lynx Edicions, Barcelona; 907 pp.
- Dexter, R. W. (1952). Banding and nesting studies of the Eastern Nighthawk. Bird-Banding 23:109-114. (enlace)
- Dexter, R. W. (1956). Further banding and nesting studies of the Eastern Nighthawk. Bird-Banding 27:9-16. (enlace)
- Dexter, R. W. (1961). Further studies on nesting of the Common Nighthawk. Bird-Banding 32:79-85. (enlace)
- Dickerman, R. W. (1990). Geographic variation in the juvenal plumage of the Common Nighthawk (Chordeiles minor) in North America. Auk 107:610-613. (enlace)
- EcoRegistros (2022). Añapero Boreal (Chordeiles minor) – Ficha de la especie. Accedido de http://www.ecoregistros.org el 05/10/2022.
- Eisenmann, E. (1962). Notes on nighthawks of the genus Chordeiles in southern Middle America and a description of a new race of Chordeiles minor breeding in Panama. Amer. Mus. Novit., 2094: 1-21. (enlace)
- Eisenmann, E. (1963). Breeding nighthawks in Central America. Condor 65:165-166. (enlace)
- Ewins, P. J. (1993). Common Nighthawks foraging in large flocks on migration. Ontario Birds 11(2): 75-77. (enlace)
- Fiameni, M. A. (1987). Presencia no habitual de un ave en Necochea. Nuestras Aves 14: 12.
- Fiameni, M. A. (1994). Aves del Partido de Necochea. La Plata. Bs. As. Pág. 1-39.
- Firman, M. C., Brigham, R. M., & Barclay, R. M. (1993). Do free-ranging common nighthawks enter torpor?. The Condor, 95(1), 157-162. (enlace)
- Fisher, R. J., Q. E. Fletcher, C. K. R. Willis & R. M. Brigham (2004). Roost selection and roosting behavior of male Common Nighthawks. American Midland Naturalist 151 (1):79-87. (enlace)
- Fletcher, Q. E., R. J. Fisher, C. K. R. Willis & R. M. Brigham (2004). Free-ranging Common Nighthawks use torpor. Journal of Thermal Biology 29 (1):9-14. (enlace)
- Fowle, C. D. (1946). Notes on the development of the nighthawk. Auk 63:159-162. (enlace)
- Goossen, P. J. (1986). Apparent dichromatism in juvenile Common Nighthawks (Chordeiles minor). Murrelet 67:62-64. (enlace)
- Gramza, A. F. (1967). Responses of brooding Nighthawks to disturbance stimulus. Auk. 84: 72-86. (enlace)
- Grinnell, J. (1905). The Pacific Nighthawk. Condor 7:170 (enlace)
- Gross, A. O. (1940). «Eastern Nighthawk.» In Life histories of North American cuckoos, goatsuckers, hummingbirds, and their allies., edited by A. C. Bent, 206-234. U.S. Natl. Mus. Bull. 176. (enlace)
- Hackett, S. J., R. T. Kimball, S. Reddy, R. C. K. Bowie, E. L. Braun, M. J. Braun, J. L. Chojnowski, W. A. Cox, K. L. Han, J. Harshman, C. J. Huddleston, B. D. Marks, K. J. Miglia, W. S. Moore, F. H. Sheldon, D. W. Steadman, C. C. Witt & T. Yuri (2008). A phylogenomic study of birds reveals their evolutionary history. Science 320(5884):1763–1768. (enlace)
- Hagar, J., S. Howlin & L. Ganio (2004). Short-term response of songbirds to experimental thinning of young Douglas-fir forests in the Oregon Cascades. Forest Ecology and Management 199 (2-3):333-347. (enlace)
- Han, K. L., M. B. Robbins & M. J. Braun (2010). A multi-gene estimate of phylogeny in the nightjars and nighthawks (Caprimulgidae). Molecular Phylogenetics and Evolution 55 (2):443-453. (enlace)
- Hartert, E. (1892). Coraciae, of the families Cypselidae, Caprimulgidae, Podargidae, and Steatornithidae. Catalogue of the Picariae in the Collection of the British Museum 16:437-654. (enlace)
- Hartman, F. A. (1914). The cause of the peculiar sound made by Nighthawks when volplaning. Science (27 febrero 1914); 39 (N.º 1000): 326-327. (enlace)
- Hartert, E. & S. Venturi (1909). Notes sur les oiseaux de la République Argentine. Novit. Zool. 16: 159-267 (enlace)
- Hayes, F. E., S. M. Goodman, J. A. Fox, T. G. Tamayo & N. E. López (1990). North American bird migrants in Paraguay. Condor 92:947–960. (enlace)
- Hayes, F. E. (1995). Status, Distribution and Biogeography of the Birds of Paraguay. Monographs in Field Ornithology, Nº1, 224 pp. American Birding Association, Inc. (enlace)
- Herzog, S. K., Terrill, R. S., Jahn, A. E., Remsen, J. V., Maillard, O. Z., García-Solíz, V. H., … & Fjeldsa, J. (2016). Birds of Bolivia: field guide. Asociación Armonía. (enlace)
- Hiam, A. & Sutherland, M. (1979). Ground-nesting and related behavior of Nighthawks (Chordeiles minor) in Massachusetts. Bird Observer East. Mass. 7(3): 98-105. (enlace)
- Holyoak, D. T. (2001). Nightjars and Their Allies: The Caprimulgiformes. Oxford University Press, Oxford.
- Howell, T. R. (1959). A field study of temperature regulation in young Least Terns and Common Nighthawks. Wilson Bulletin 71:19-32. (enlace)
- Howell, S. N. G., C. Corben, P. Pyle & D. I. Rogers (2003). The first basic problem: a review of molt and plumage homologies. Condor 105:635–653. (enlace)
- Howell, S. N. G., C. Corben, P. Pyle & D. I. Rogers (2004). The first basic problem revisited: reply to commentaries on Howell et al. (2003). Condor 106:206–210. (enlace)
- Humphrey, P. S. & K. C. Parkes (1959). An approach to the study of molts and plumages. Auk 76:1–31. (enlace)
- Juri, M. D. & J. M. Chani (2005). Variación en la composición de comunidades de aves a lo largo de un gradiente urbano (Tucumán, Argentina). Acta Zoológica Lilloana, 49 (1-2): 49-57. (enlace)
- Juri, M. D. (2007). Estudios ecológicos de la comunidad de aves en un gradiente urbano. Tesis doctoral, Facultad Ciencias Naturales e Instituto M. Lillo, Universidad Nacional de Tucumán, 276 pp (enlace)
- Kantrud, H. A. & K. F. Higgins (1992). Nest and nest site characteristics of some ground-nesting, non-passerine birds of northern grasslands. Prairie Naturalist 24:67-84.
- Keith, A. R., J. W. Wiley, S. C. Latta & J. A. Ottenwalder (2003). The Birds of Hispaniola: Haiti and the Dominican Republic. An Annotated Checklist. British Ornithologists’ Union Checklist 21. British Ornithologists’ Union and British Ornithologists’ Club, Tring.
- Knight, E. C., Ng, J. W., Mader, C. E., Brigham, R. M. & Bayne, E. M. (2018). “An inordinate fondness for beetles”: first description of Common Nighthawk (Chordeiles minor) diet in the boreal biome. The Wilson Journal of Ornithology, 130(2), 525–531. (enlace)
- Krauczuk, E. R. (2005). Aves do Inta-Campo Anexo ao Zaiman, e do Campus da Universidade Nacional de Misiones, Posadas, Misiones, Argentina. Atualidades Ornitológicas No 126: 1-22. (enlace)
- Krauczuk, E. R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Chriti, San Ignacio, Misiones, Argentina. Lundiana 9 (1): 21-31. (enlace)
- Laerm, J. & Haney, J. C. (1984). Observations on the thermoregulatory behavior of a roof-nesting Common Nighthawk (Chordeiles minor). Oriole. 49(1): 7-10. (enlace)
- Lane, J. E., R. M. Brigham & D. L. Swanson (2004). Daily torpor in free-ranging Whip-poor-wills (Caprimulgus vociferus). Physiological and Biochemical Zoology 77 (2):297-304. (enlace)
- Larson, E. R. (1970). A nesting study of the Common Nighthawk. Kentucky Warbler 46:3-6. (enlace)
- Lasiewski, R. C. & W. R. Dawson (1964). Physiological responses to temperature in the Common Nighthawk. Condor 66:477-490. (enlace)
- Latta, S. C. & Latta, K. N. (2015). Do urban American Crows (Corvus brachyrhynchos) contribute to population declines of the Common Nighthawk (Chordeiles minor)? Wilson J. Orn.. 127(3): 528–533. (enlace)
- Laubmann, A. (1930). Vögel. En: Wissenschaftliche Ergebnisse der deutschen Gran Chaco Expedition. Strecker y Schröder Verlag, Sttugart, pp. 1-334.
- Lee Jones, H. & Vallely, A. C. (2000). Annoted Checklist of the Birds of Belice. Lynx Edicions. Barcelona, España.
- Lepage, D. (2022). Avibase-La base de datos World Bird; Ficha especie: Chordeiles minor. Recuperado de https://avibase.bsc-eoc.org/species.jsp?avibaseid=24E39ACD5692DA4A el 4 octubre 2022.
- Livezey, B. C. & R. L. Zusi (2007). Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy. II. Analysis and discussion. Zoological Journal of the Linnean Society 149: 1–95. (enlace)
- López-Lanús, B., A. Galimberti, C. Giarduz, H. Luna, M. Manassero, A. A. Pautasso, M. P. Ducommun, A. A. G. Saigo, P. Petracci, G. A. Marteleur & M. R. de la Peña (2013). Inventario focal de fauna de las estancias El Estero, La Norma, El Matrero y La Elena en el sitio piloto San Javier: Santa Fe, Argentina. En pp. 135-169/277-306/331-347/507,511-513: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- Lucero, M. M. (1983). Lista y distribución de aves y mamíferos de la provincia de Tucumán. Miscelánea No 75. Fund. M. Lillo. Tucumán. Págs. 61.
- Lucero, F. (2019). Novedades sobre la Distribución de Aves en la Provincia de San Juan, Argentina. EcoRegistros Revista, 9(2): 4-10 (enlace)
- Manassero, M., H. Luna & L. Acquaviva (2006). Nuevos registros de aves para Santa Fe, Argentina. Parte II. Nuestras Aves 51: 29-31 (enlace)
- Marateo, G., H. Povedano & J. Alonso (2009). Inventario de las aves del Parque Nacional El Palmar, Argentina. Cotinga 31: 47-60. (enlace)
- Mariaux, J. & M. J. Braun (1996). A molecular phylogenetic survey of the nightjars and allies (Caprimulgiformes) with special emphasis on the potoos (Nyctibiidae). Molecular Phylogenetics and Evolution 6 (2):228-244. (enlace)
- Maugeri, F. G. (2003). Aves nuevas o poco conocidas para el sudeste de la Provincia de Buenos Aires, Argentina. Nuestras aves 44: 16-19. (enlace)
- Mayr, G. (2010). Phylogenetic relationships of the paraphyletic ‘caprimulgiform’ birds (nightjars and allies). Journal of Zoological Systematics and Evolutionary Research 48 (2):126-137. (enlace)
- McGowan, K. J. & Woolfenden, G. E. (1986). Aerial rain bathing by Common Nighthawks. Wilson Bull.. 98(4): 612-613. (enlace)
- Mérida, E. & A. Bodrati (2006). Consideraciones sobre la conservación de los talares de barrancas del nordeste de Buenos Aires y descripción de las características de un relicto en Baradero. Pp.: 71-82, en : Mérida, E. y J.Athor (Editores). Talares bonaerenses y su conservación. Fundación de Historia Natural “Félix de Azara”. Buenos Aires. (enlace)
- Miatello, R., V. Cobos & C. Rosacher (1991) 1994. (Reimpresión). Algunas especies de aves nuevas o poco conocidas para la provincia de Córdoba, República Argentina. Nótulas Faunísticas 69: 1-5.
- Miller, A. H. (1925). The boomflight of the Pacific Nighthawk. Condor 27:141. (enlace)
- Miller, A. H. (1937). The nuptial flight of the Texas Nighthawk. Condor 39:42-43. (enlace)
- Monroe, B. L., Jr. (1968). A Distributional Survey of the Birds of Honduras. Ornithological Monographs 7. American Ornithologists’ Union, Washington, DC, USA. 458 pp. (enlace)
- Moschione, F. & L. Bishels (2004). Listado de las aves del Parque Provincial Loro Hablador, Provincia del Chaco. Informe Técnico. Proyecto Elé/DFS. Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F., Spitznagel, O. & González, M. (2014). Lista de Aves de Salta (Birds Checklist). Ministerio de Cultura y Turismo. Salta. (versión mayo 2014). (enlace)
- Narosky, T. & A. G. Di Giacomo (1993). Las aves de la Provincia de Buenos Aires, distribución y estatus. Asoc. Orn. del Plata. Vazquez Mazzini Editores, L.O. L. A., Buenos Aires.
- Narosky, T. & Chébez, J. C. (2002). Aves de Iguazú, guía para la identificación. Ed. Vázquez Mazzini (1º Ed.). Buenos Aires, Argentina. 128 pp.
- Narosky, T. (2010). Birds of Argentina y Uruguay: Guía de Identificación. (16a Ed.). Buenos Aires: Vázquez Mazzini Editores
- Navas, J. R. & N. A. Bó (1988). Aves nuevas o poco conocidas de Misiones, Argentina. III. Rev. Mus. Arg. Cienc. Nat. Zool. 15: 11-37.
- Nebel, S., A. Mills, J. D. McCracken & P. D. Taylor (2010). Declines of aerial insectivores in North America follow a geographic gradient. Avian Conservation and Ecology 5:1. (enlace)
- Nellar Ramonella, M. M. (1993). Aves de la Provincia de San Luis. Lista y distribución. Ed. Mus. Priv. Cienc. Nat. E Inv. Ornit. “G. E. Hudson”. San Luis. Págs. 98.
- Ng, J. W. (2009). Habitat use and home range characteristics of Common Nighthawks (Chordeiles minor) in mixed-grass prairie, University of Regina. (enlace)
- Nicholson, D. J. (1957). The Bahaman Nighthawk (Chordeiles minor vicinus) on the Florida keys. Auk 74:505-507. (enlace)
- Nicol, J. A. C., F. R. S. Arnott & H. J. Arnott (1974). Tapeta lucida in the eyes of goatsuckers (Caprimulgidae). Proc. R. Soc. London, Ser. B 187:349-352. (enlace)
- Nores, M., D. Yzurieta & R. Miatello (1983). Lista y distribución de las aves de Córdoba, Argentina. Boletín de la Academia Nacional de Ciencias de Córdoba. 56: 1-96
- Nores, M. & S. A. Salvador (1985). Nuevos registros de aves para La Rioja, Argentina. Historia Natural 5 (24): 207-208
- Nores, M. (1996). Avifauna de la Provincia de Córdoba. Fauna 1: 255-337.
- Oberholser, H. C. (1914). A Monograph of the Genus Chordeiles Swaison, Type of a New Family of Goatsuckers. US National Museum Bulletin 86. Smithsonian Institution, Washington, D.C. 121 pp. (enlace)
- Olrog, C. Ch. (1959). Las Aves Argentinas. Una Guía de campo. Universidad Nacional de Tucumán. Instituto “Miguel Lillo”. Tucumán, Argentina. 343 pp.
- Ortiz, D. & R. Aráoz (2014). Aves de la Sierra de San Javier. Universidad Nacional de Tucumán.
- Pagano, L. G., U. Ornstein, F. G. Di Sallo & D. E. Oscar (2017). Adiciones y comentarios sobre las aves del Parque Costero del Sur, Buenos Aires. Nuestras Aves 62: 17-23. (enlace)
- Parks, G. H. (1946). Notes on the behavior of a nesting Nighthawk. Bird-Banding. 42: 55-60. (enlace)
- Parmalee, P. W. (1977). The avifauna from prehistoric Arikara sites in South Dakota. Plains Anthropologist 22 (77):129-222. (abstract)
- Parody, J. M., F. J. Cuthbert & E. H. Decker (2001). The effect of 50 years of landscape change on species richness and community composition. Global Ecology and Biogeography 10 (3):305-313.(abstract)
- Pautasso, A. A. (2002a). Nuevos registros para aves poco citadas en Santa Fe, Argentina. Nuestras Aves 43: 19-21. (enlace)
- Pautasso, A. A. (2002b). Aves de la Reserva Urbana de la Ciudad Universitaria UNL “El Pozo”, Santa Fe. Com. Mus. Prov. Cs. Naturales “Florentino Ameghino” (Nueva Serie) Vol 8 Nº1:1-12 (enlace)
- Pereyra, J. A. (1938). Aves de la zona ribereña nordeste de la provincia de Buenos Aires. Memorias del Jardín Zoológico. La Plata. Tomo 9, parte 2: 1-304
- Pidgeon, A. M., N. E. Mathews, R. Benoit & E. V. Nordheim (2001). Response of avian communities to historic habitat change in the northern Chihuahuan Desert. Conservation Biology 15 (6):1772-1788. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Ficha especie: Añapero yanqui (Chordeiles minor) Forster, JR, 1771; Recuperado el 12 octubre 2022 de https://xeno-canto.org/species/Chordeiles-minor
- Poulin, R. G., P. A. Bradshaw & M. D. Graham (1996). Late spring arrival, nesting, and fall departure by Common Nighthawks, Chordeiles minor, in Saskatchewan in 1995. Canadian Field-Naturalist 110 (3):539-540. (enlace)
- Project Nighthawk, The Common Nighthawk (Chordeiles minor) http://nhbirdrecords.org/bird-conservation/Nighthawk-main.htm. NH Audubon, 84 Silk Farm Rd., Concord, NH 03301. www.nhaudubon.org
- Pugnali, G., Ferrari, C., Rimoldi, C., Tagtachian, S., Pagano, L., Chiale M.C. & Vitale, S. (2016). Lista de Aves de la Reserva Ecológica Costanera Sur. Aves Argentinas/AOP. Buenos Aires. (enlace)
- Pyle, P. (1995). Incomplete flight feather molt and age in certain North American non-passerines. North American Bird Bander 20:15–26. (enlace)
- Pyle, P. (2006). Staffelmauser and other adaptive strategies for wing molt in larger birds. Western Birds 37: 179–185. (enlace)
- Raffaele, H., Wiley, J., Garrido, O. Keith, A. & Raffaele, J. (2003). Birds of the West Indies. Princeton University Press. ISBN 0-691-11319-X (Página 104)
- Ridgely, R. S. & Gwynnw, J. A. Jr. (1989). A Guide to the Birds of Panamá, with Costa Rica, Nicaragua and Honduras. Princeton University Press, New Jersey. 534 pp.
- Ridgely, R. S. & P. J. Greenfield (2001) The Birds of Ecuador. Volume 1. Status, Distribution, and Taxonomy. Cornell University Press, Ithaca, New York.
- Ridgway, R. (1914) The birds of North and Middle America. Part VI. Bulletin of the United States National Museum 50, part 6. Bulletin of the United States National Museum 50, part 6. (enlace)
- Riley, J. H. (1903). A new subspecies of nighthawk from the Bahama Islands. Auk 20:431-433. (enlace)
- Ross, C. C. (1963). Albinism among North American birds. Cassinia 47: 2–21. (enlace)
- Roth, A. J. & G. S. Jones (2001). Territorial behavior of Common Nighthawks in an urban habitat. Bird Observer 29:107-114. (enlace)
- Roth, A. J., G. C. Argyros & R. B. Browning (2003). Visual signals in the crepuscular Common Nighthawk (Chordeiles minor). American Midland Naturalist 150:191-193. (enlace)
- Russell, R. W. (1999). Precipitation scrubbing of aerial plankton: Inferences from bird behavior. Oecologia 118 (3):381-387. (enlace)
- Rust, H. J. (1947). Migration and nesting of nighthawks in northern Idaho. Condor. 49(2): 177-188. (enlace)
- Ryan, P. (1989). Common Nighthawk Chordeiles minor and new records of seabirds from Tristan da Cunha and Gough Islands. Bull. Brit. Orn. Club. 109(3): 147–149. (enlace)
- Saibene, C. A., Castelino, M. A., Rey, N. R. & Caló, J. (1996). Inventario de las Aves del Parque Nacional Iguazú (Misiones, Argentina). Ed. L.O.L.A. (Literature of Latin America). Monografía 9. Buenos Aires, Argentina. 68 pp.
- Salvador, S. A. (1983). La avifauna en Villa María y sus alrededores. Escuela Normal “ Víctor Mercante” . Inst. Sec. “Bernardino Rivadavia”. Villa María, Córdoba. Argentina.
- Salvador, S. A., Salvador, L. A., Ferrari, C. & Vitale, S. (2016). Listado de Aves de la Provincia de Córdoba, Argentina. Birds Checklist. Recuperado de https://avesargentinas.org.ar/noticia/nueva-lista-de-las-aves-de-la-provincia-de-c%C3%B3rdoba, el 4 octubre 2022.
- Salvador, S. A., Salvador, L. A. & Ferrari, C. (2017). Aves de la Provincia de Córdoba, Argentina. Distribución e Historia Natural. (1º Ed.) Buenos Aires, Argentina. 301 pp.
- Sauer, J. R., J. E. Hines & J. Fallon (2014). The North American breeding bird survey, results and analysis 1966-2002. Version 02.19.2014 (enlace)
- Saunders, W. E. (1917). City nesting of Nighthawks. Wilson Bull.:29: 105. (enlace)
- Schaldach, W. J. (1963). The Avifauna of Colima and Adjacent Jalisco, Mexico. Proceedings of the Western Foundation of Vertebrate Zoology 1(1). (enlace)
- Schulenberg, T. S., Stotz, D. F., Lane, D. F., O’Neill, J. P., Parker III, T. A. & Brack Egg, A. (2010). Birds of Perú. Revised and Updated Edition ed. Princeton University Press
- Selander, R. K. (1954). A systematic review of the Booming Nighthawks of western North America. Condor. 56: 57-82. (enlace)
- Selander, R. K. & Álvarez del Toro, M. (1955). A new race of Booming Nighthawk from southern Mexico. Condor. 57(3): 144-147. (enlace)
- Sferco, G. D. & Nores, M. (2003) Lista comentada de las aves de la Reserva Natural Chancaní, Córdoba, Argentina. Hornero 018 (01) : 021-029. (enlace)
- Shields, W. M. & Bildstein, K. L. (1979). Birds versus bats: behavioural interactions at a localized food source. Ecology. 60(3): 468-474. (enlace)
- Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina. (S.I.B.) Ficha: Chordeiles minor. Recuperado de https://sib.gob.ar/especies/chordeiles-minor?, el 19/01/2022.
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brasil.
- Skoruppa, M. K., M. C. Woodin & G. Blacklock (2009). Species richness, relative abundance, and habitat associations of nocturnal birds along the Rio Grande in southern Texas. Southwestern Naturalist 54 (3):317-323. (enlace)
- Slud, P. (1964). The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History 128:1–430. (enlace)
- Sooter, C. A. (1947). Flight speeds of some south Texas birds. Wilson Bulletin 59:174-175. (enlace)
- Steullet, A. B. & E. A. Deautier (1935-1946). Catálogo sistemático de las aves de la República Argentina. 1: 1-1006. La Plata.
- Stevenson, H. M., Eisemann, E., Winegarner, C. & Karlin, A. (1983). Notes on Common and Antillean Nighthawks of the Florida Keys. Auk. 100(4): 983-988. (enlace)
- Stevenson, H. M. & B. H. Anderson (1994). The Birdlife of Florida. University Press of Florida, Gainesville, FL, USA. (enlace)
- Stone, W. (1896). The molting of birds with special reference to the plumages of smaller land birds of eastern North America. Proceedings of the Academy of Natural Sciences of Philadelphia 43:108–164. (enlace)
- Stotz, D. F., R. O. Bierregaard, M. Cohn-Haft, P. Peterman & J. Smith (1992). The status of North American migrants in central Amazonian Brazil. Condor 94: 608–621. (enlace)
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker & D. K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA, and London, UK.
- Suomala, R. (2020). Common Nighthawk. Guide to Identification, Monitoring, and Behavior during Nesting. Information recorded and complied by NH Audubon’s Project Nighthawk staff and volunteers (enlace)
- Sutton, G. M. & Spencer, H. H. (1949). Observations at a Nighthawk’s nest. Bird-Banding. 20: 141-149 (enlace)
- Szaro, R. C. & R. P. Balda (1986). Relationships among weather, habitat structure, and ponderosa pine (Pinus ponderosa) forest birds. Journal of Wildlife Management 50:253-260. (enlace)
- Taylor, P. (1996). Apparent decline of migrant Common Nighthawks near Pinawa, Manitoba. Blue Jay. 54: 35-38. (enlace)
- Todd L. D, Poulin R. G & Brigham R. M. (1998). Diet of Common Nigthawks (Chordeiles minor: Caprimulgidae) Relative to Prey Abundance. American Midland Naturalist, Vol 139, Issue 1(Jan, 1998), 20-28 (enlace)
- Tomkins, I. R. (1942). The «injury-feigning» behavior of the Florida Nighthawk. Wilson Bulletin 54:43-49. (enlace)
- Van Rossem, A. J. (1927). Eye shine in birds, with notes on the feeding habits of some goatsuckers. Condor 29:2528. (enlace)
- Wedgwood, J. A. (1973). Nighthawks in the city. Blue Jay 31:82-88. (enlace)
- Wedgwood, J. A. (1992). Common Nighthawks in Saskatoon. Blue Jay. 50(4): 211-217. (enlace)
- Weller, M. W. (1958). Observations of the incubation behavior of a Common Nighthawk. Auk 75:48-59. (enlace)
- Wetmore, A. & B. H. Swales (1931). The birds of Haiti and the Dominican Republic. Bulletin of the Museum of Comparative Zoology 63:340-341. (enlace)
- Wetmore, A. (1968). The Birds of the Republic of Panama. Part 2. Columbidae (Pigeons) to Picidae (Woodpeckers). Smithsonian Miscellaneous Collections 150. Smithsonian Institution, Washington, D.C. 605 pp. (enlace)
- Yzurieta, D. (1995). Manual de reconocimiento y evaluación ecológica de las aves de Córdoba. Ministerio de Agricultura, Ganadería y Recursos Renovables. Córdoba.
- Zotta, A. R. (1937) Lista sistemática de las aves argentinas. Hornero 006 (03) : 531-554 (enlace)
- Zotta, A. R. (1944). Lista sistemática de las aves Argentinas. Mus. Argen. Cienc. Nat. Buenos Aires.
-
-
Añapero boreal | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR.
Esta especie tiene un rango de distribución extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). A pesar que la población muestra tendencia a estar disminuyendo, se cree que esta disminución no es lo suficientemente rápida para alcanzar los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población es extremadamente grande, y por lo tanto no alcanza los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como “común” y de “preocupación menor” (Stotz et al., 1996:196); (del Hoyo, 2020:120).
La población global se calcula en unos 23.000.000 de individuos maduros (Partners in Flight 2019); está sufriendo una disminución significativa de aproximadamente 1.8% por año (entre 1970 y 2017), y las tendencias a corto plazo sugieren que la población en América del Norte ha disminuido un 15% en las últimas 3 generaciones (Pardieck et al., 2018); (Butcher & Niven, 2007).
Esta disminución sustancial en el número de esta especie, tal vez se deba a un aumento de la depredación, al uso indiscriminado de pesticidas que disminuyen el número de insectos , o a la pérdida del hábitat (Wedgwood, 1991:215); (Latta & Latta, 2015:528); (Szaro & Balda, 1986:253); (Pidgeon et al., 2001:1785); (Stevenson & Anderson, 1994:374).
ARGENTINA:
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable ). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1º ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas ). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable ).Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza ). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Añapero boreal | Distribución
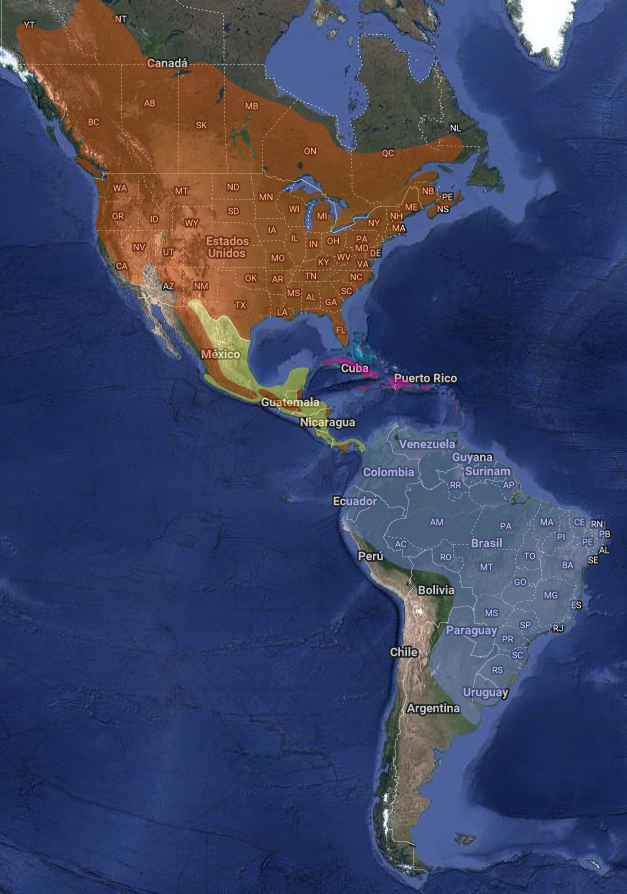
InfoNatura: Animals and Ecosystems of Latin America 2007 Nidifica en centro y sur de Canadá y noreste de EEUU. En invierno boreal migran en bandadas a través de América Central aunque pueden utilizar rutas trans-oceánicas a América del Sur (Norte y Centro de Argentina).
En América: Argentina; Belice (Lee Jones & Vallely, 2000:26); Bolivia; Brasil; Canadá; Colombia; Costa Rica; Cuba; República Dominicana; Ecuador; Guatemala; Belice, Haití; El Salvador; Honduras; Jamaica; México; Nicaragua; Panamá (Ridgely & Gwynne, 1989:193); Paraguay; Perú; Puerto Rico; EEUU; Uruguay (Cuello, 1975:16) y Venezuela. En las islas de Anguilla; Antigua y Barbuda; Aruba; Bahamas; Barbados; Bermuda; Bonaire, San Eustaquio y Saba; Caimán; Dominica; Guadalupe; Martinica; Montserrat; Saint Kitts y Nevis; Santa Lucía; San Martín; Saint Pierre y Miquelon; Saint Vincent; Virgin Islands (Stotz et al., 1996:316).
Argentina: Migratorio de América del Norte.
Dos subespecies son las que migran hacia Sudamérica visitando Argentina, Chordeiles minor minor y Chordeiles minor chapmani (Lucero, 2019:6).
Se observa en Argentina en Jujuy, Salta, Tucumán, La Rioja, Santiago del Estero, Formosa, Chaco, Misiones, Corrientes, Córdoba, Buenos Aires, La Pampa, San Luis, San Juan, Entre Ríos, Santa Fe – Las subespecies C. m. minor y C. m. chapmani, superpondrían sus áreas de distribución en estas dos últimas provincias- según de la Peña, (2006:63). (ver coordenadas y referencias en los enlaces)
* C. minor minor, llega hasta Tucumán, La Rioja, Córdoba Santa Fe y Buenos Aires.
* C. m. chapmanni, llega hasta Formosa, Misiones, Corrientes, Santiago del Estero y Entre Ríos (de la Peña, 1999:90, 415); (Olrog, 1959:155); (de la Peña, 2016b).HÁBITAT
Bosques abiertos, suburbios de ciudades y pueblos. Bordes de carreteras y ferrocarril; sabanas y pastizales abiertos, llanuras, praderas con árboles, pinares, laderas áridas, hábitats quemados. Desde el nivel del mar hasta los 2.500 msnm. (Stotz et al., 1996:172).
Ecorregiones: en Argentina en Chaco seco, Chaco húmedo, Espinal, Esteros del Iberá y Selva Paranaense. -
Añapero boreal | Comportamiento
De hábitos diurnos y crepusculares. Generalmente solitarios (Tomkins, 1942:43), aunque los machos suelen posarse juntos.
Se posa en las ramas de los árboles, paralelo a la rama (Rust 1947:177), muy raramente perpendicular a ella (Fisher et al. 2004).
Los adultos tienen patas cortas y no de desplazan mucho por el suelo. Los juveniles pueden correr, con las alas verticales y boca abierta (Dexter, 1952:112).
Forma grandes bandadas durante los periodos de migración.
Vuelo alto y errático; aleteo continuo seguido de planeos cortos (de la Peña, 2015:327); los machos tienen un patrón de vuelo distintivo que alterna entre varios aleteos normales y varios aleteos rápidos (Suomala, 2020:5).Se alimentan por lo general entre los 15-40 m, pero pueden llegar hasta por encima de los 175 m, descendiendo en grandes círculos hasta encontrar insectos (Rust 1947:177); (Wedgwood, 1973:82).
No son activos durante lluvias fuertes, vientos o temperaturas por debajo de los 5ºC (Wedgwood, 1973:82), siendo en cambio muy activos después de las tormentas (Russell (1999:381), con niebla, lloviznas y temperaturas altas. La velocidad de vuelo durante la alimentación es de unos 5.3 m/s (medida sobre una distancia conocida) (Brigham & Fenton, 1991:478), pero cuando se midieron con radar doppler se registraron velocidades mucho más rápidas: 6.5 m/s (Brigham et al., 1998:327) y 8.9-15.6 m/s (Sooter 1947:175).
La distancia promedio entre los sitios de reposo y alimentación es promedio de 2.7 km (DS ± 0.1, n=284 viajes); en algunas ubicaciones se alimentan en sitios adyacentes a los nidos y sitios de reposo, aunque en otras se alimentan en localizaciones específicas distantes de sus áreas de nidificación (Brigham & Fenton, 1991:480, Ng, 2009).
No vuelan en picado ni erráticamente como lo hacen normalmente mientras se alimentan, aunque algunos individuos vuelven volando en círculos a sus posiciones previas. McGowan & Woolfenden (1986:612) han descrito como baño aéreo bajo la lluvia: durante 10 minutos de vuelo bajo la lluvia, la bandada permanece en la misma área.
Se posan a lo largo de las ramas, postes cercanos, suelo, techos planos de los edificios. Su plumaje críptico hace difícil su detección (Brigham, 1994).
Según Brigham & Fenton (1991:482), los vuelos al crepúsculo comienzan 28.3 min (DS ± 4.2) antes de la puesta del sol y finalizan 68.2 min (DS ± 3.7) después de la puesta del sol. Los vuelos matinales comienzan 54 min (DS ± 6.3) antes del amanecer y se prolongan hasta cerca de 15 min (DS ± 8.7) después de la salida del sol.
Se observan a veces, vuelos nocturnos (probablemente no para alimentarse), y diurnos (generalmente después de una noche lluviosa o fría) (Rust 1947:177; Firman et al. 1993:157; Brigham, 1994). Las horas restantes del día, las hembras están en el nido y los machos posados cerca de él.
Como mecanismo de defensa ante los intrusos, emiten siseos, ahuecan las plumas, elevan las alas y abren la boca. Se lanzan en picado para defender el territorio de mapaches (Procyon lotor), humanos, ciclistas, vehículos todo terrenos y otros individuos de su especie (Armstrong 1965:619; Caccamise 1974:4). Gramza (1967:77), describe distintos tipos de respuestas, maniobras de distracción, cuando sale espantado del nido: abandona el campo visual, vuela cerca del área del nido, se posa a la vista del intruso y deja caer las alas y/o las mantiene extendidas, siempre a la vista del intruso extiende las alas y se lanza hacia él o se mantiene en su sitio.
Suomala (2020:5), comenta que un Añapero que se lanza en picado siempre es un macho, las hembras no se lanzan ni hacen ruido con las alas. Las hembras aunque emiten sonidos, no se oyen habitualmente. Si emite un sonido una o dos veces: podría ser hembra o macho, pero si vuelan en círculo sobre las cabezas y emiten sonidos continuamente, es un macho. Generalmente emiten llamadas muy rápidas cuando otro individuo está cerca. Un macho que está en periodo de reproducción silba rápidamente cuando la hembra está dejando o llega al nido.VOCALIZACIONESEn esta especie no hay distinciones entre cantos y llamadas. Semejan a un zumbido (de la Peña, 2015:327). Sus vocalizaciones son de una estructura simple: “peent” nasal emitido durante el vuelo por ambos sexos. Más frecuentes en vuelo, aunque también sobre la zona de nidada o de apareamiento (Armstrong, 1965:619; Wedgwood, 1973:82; Caccamise, 1974:4). El pico de vocalizaciones se produce entre 30-45 min después del ocaso (Wedgwood, 1973:82; Wedgwood, 1991:214). La hembra emite un “cluck” gutural o un zumbido durante la defensa del nido (Tomkins, 1942:43; Parks, 1946:55; Dexter, 1952:110). Durante el cortejo, el macho emite un graznido “auk, auk, auk” cuando está en presencia de la hembra. Cuando son capturados, ambos sexos emiten un agresivo “wrrrrrroonk” mientras mantienen la boca abierta.
Sonidos no-vocales
Sonido estruendoso (booming sound), presumiblemente solo por el macho, producido por el aire a través de las remeras primarias después de una súbita flexión hacia abajo de las alas durante vuelo en picado (Bowles, 1921:203; Miller, 1925:141-143; Weller, 1958:57). Asociado al cortejo y defensa del territorio (sobre humanos y conespecíficos) (Dexter, 1952:110; Dexter, 1961:83), y no se han registrado fuera del periodo reproductivo.
Se ha registrado al macho batiendo las alas (Weller, 1958:57).TERRITORIALIDADWedgwood (1973:82) y Caccamise (1974:4) comentan que es una especie muy territorial; los machos casi nunca cruzan los límites del territorio, aunque Ng (2009) comprobó mediante seguimiento de individuos equipados con transmisores, que durante 1 año todos (n=5) sobrepasaban los límites.
El tamaño de los territorios varía en los diferentes hábitats (Wedgwood, 1973:82; Armstrong, 1965:619); tienen múltiples centros de actividad dentro de su territorio (descanso, nidificación), por ej. un macho descansa durante la noche en un área diferente de su territorio crepuscular y de su zona de reposo. Por el contrario, Roth & Jones (2001:107) describen en Boston, una defensa agresiva de su territorio ante una bandada migrante de con-específicos, alimentándose fuera de su territorio durante solo 4 de 42 noches. Concluyen que el sistema territorial es dinámico.
Cummings et al. (2003:423) comentan que de 214 individuos marcados y desplazados 44-88 km de una base militar para reducir los impactos con las aeronaves, solo 1 volvió al sitio de captura
Nidifica en solitario (Tomkins, 1942:43), con distancias entre los nidos de unos 75 m en un llano de 10 ha y de 85 m entre esquinas opuestas de un mismo edificio Sutton & Spencer, 1949:141). Pueden nidificar cerca de otras especies.
Pueden ser desplazados y perseguidos activamente por los murciélagos, sobre el agua (Boyce 1980:35) y en los sitios de alimentación (Shields & Bildstein, 1979:468). También son desplazados de áreas desérticas o con escasa disponibilidad de presas por el Chordeiles acutipennis (Caccamise, 1974:5, Skoruppa et al., 2009:317).DEPREDADORESSobre los adultos, los gatos domésticos, y probablemente los cuervos (Corvus corax y Corvus brachyrhynchos) sobre los juveniles y huevos; gaviotas (Larus spp.) (Wedgwood, 1991:216); cernícalos (Falco sparverius) (Gross, 1940); búhos (Strigidae), perros, mofetas (Mustelidae), coyotes (Canis latrans), lobos (Canidae), and serpientes (Squamata) (Marzilli, 1989; Kantrud & Higgins, 1992).
ALIMENTACIÓNInsectívoro aéreo (Brigham, 1994:75); parece ser un cazador oportunista (Caccamise, 1974:6).
Se alimenta durante periodos cortos, en vuelo, y parece que captura más de una presa por ataque, aunque también ataca insectos individuales (Aldridge and Brigham 1991:68). Captura insectos voladores que se alimentan de la vegetación subyacente (Armstrong, 1965:619) o insectos atraídos por la luz (Shields & Bildstein, 1979:468).
Presumiblemente utiliza la visión para detectar y discriminar el tipo de presas (Brigham & Barclay, 1995:3); puede ser ayuda para la visión, la presencia de una tapeta lucidum (estructura reflectante dentro de la coroides, que mejoraría la visión nocturna reflejando la luz hacia la retina) (Nicol et al., 1974:349).
Cuando recién detecta las presas no distingue entre presas comestibles y aquellas que no lo son, aunque es capaz de de discriminarlas bien en los estadios finales de la captura (Brigham & Barclay, 1995:03).
El tiempo de alimentación de esta especie está limitado por la duración de luz tenue (alba y crepúsculo) (Aldridge & Brigham, 1991:62; Brigham & Fenton, 1991:482). No existen evidencias que se alimente durante la noche (Aldridge & Brigham, 1991:67-68; Brigham, 1994:75), aunque ocasionalmente lo hagan durante el día (Rust 1947:177; Firman et al. 1993:157; Russell 1999:381).
En vuelo, aproximadamente 1 m por encima del agua (Brigham, 1990:75) y en el dosel a ≥ 80 m (Boyce, 1980:35); muy raramente sobre el suelo (Rust, 1947:177)
Suelen alimentarse en grandes grupos (el autor observó 110), con una separación de hasta 20 m entre individuos (Ewins, 1993:75), aunque existe registros de bandadas de 50-300 individuos (Brigham & Fenton, 1991:484; Brigham & Barclay, 1995:3) y hasta 1000 individuos en Kansas (Cummings et al, 2003:423).Dieta
Aunque se han descrito que se alimentan de más de 50 especies de insectos, en su mayoría consumen hormigas voladoras, avispas (Hymenoptera, Blem, 1972:42; Caccamise, 1974:8), escarabajos (Coleoptera, Todd et al. 1998:20), moscas (Trichoptera, Brigham, 1990:75), polillas (Lepidoptera, Cummings et al., 2002:39), cigarras (Homoptera, Firman et al. 1993:157), moscas del sábalo (Ephemeroptera), tábanos (Diptera) y saltamontes (Orthoptera) (Brigham, 1990:75; Brigham & Fenton, 1991:484; Firman et al., 1993:157; Todd et al., 1998:22; Blem, 1972 :492-493; Bent, 1940:208; Stevenson, 1933:983; Poole, 1938:511-517).
Esta variabilidad refleja las diferencias en la disponibilidad de presas; comparado con la proporción de insectos disponibles consumen, más de lo esperado, Coleoptera e Hymenoptera mientras que evitan Diptera. Solo Trichoptera y Lepidoptera son consumidos en proporción a su abundancia (Todd et al., 1998:20).
Rust (1947:177), analizó el contenido estomacal de individuos de esta especie y refiere que el 75% de los individuos consumían 100% materia animal (insectos), mientras que el otro 25% consumía 60-90% de materia animal y 10-40% de vegetación y gravilla.
Beben agua en vuelo, a través de la boca, sobrevolando la superficie de los lagos, ríos, etc. Suelen defecar en los alrededores del nido y sitios de posado. También defecan rápidamente en la mano cuando son apresados. Ocasionalmente defecan en vuelo (Brigham et al, 2020).METABOLISMO Y REGULACIÓN DE LA TEMPERATURASegún los autores (Lasiewski & Dawson, 1964:488) tiene un metabolismo estándar de 1.1 ml O2/g/h, que se ajusta a las predicciones de tamaño de la especie. El metabolismo aumenta cuando la temperatura ambiente desciende de los 35º C. Por encima de los 35º C, el metabolismo aumenta asociado al aumento de actividad para aumentar el enfriamiento evaporativo (la pérdida de agua evaporativa aumenta cuando aumenta la temperatura ambiente). A través de la evaporación pueden disipar 1.5 veces el calor producido por el metabolismo. Generalmente mantienen su temperatura corporal en un rango muy estrecho (34-40º C) aún a temperaturas ambiente de muy frías a moderadas (2-35º C).
En respuesta al estrés del calor, aumentan la pérdida evaporativa expandiendo zona gular (Howell, 1959:26); también buscan refugio en posiciones opuestas al sol (posan en pendientes al Norte) y ahuecan las plumas (Weller, 1958:53; Gramza 1967:72; Fisher et al. 2004:83).
Un posible mecanismo de termoregulación, que comienza a los 42º C , es a través de la vasodilatación de la zona interna de la boca (muy vascularizada y relativamente grande, 15% de su superficie corporal) (Cowles & Dawson, 1951:21).
Se ha observado que las hembras, cuando incuban, orientan el cuerpo a lo largo de los ejes de los rayos del sol, con la cabeza alejada de él. Sin embargo en días nublados no repite esta posición (Weller, 1958:53).
En los días de calor los polluelos se acurrucan bajo la vegetación (Fowle, 1946:159). Son homeotermos imperfectos alcanzando una termoregulación efectiva, como la de los adultos, a los 21 días de vida (Howell, 1959:30).
Raramente entran en letargo. No existen evidencias directas de su uso en British Columbia (Firman et al., 1993:157), ocasionalmente en Saskatchewan (Fletcher et al., 2004:11) y un uso anecdótico en Alberta y British Columbia (Brigham et al., 1995:03).REPRODUCCIÓNSuomala (2020:2), describe el cortejo del macho: vuelo en círculos sobre el sitio potencial del nido pronunciando una serie de llamadas ásperas “peent”. A intervalos regulares se lanza hacia el área del posible nido, y bruscamente retoma el vuelo hacia arriba. La vibración de las plumas de sus remeras primarias produce un sonido estridente (booming sound). La intensidad del sonido es más o menos proporcional a la velocidad alcanzada (Miller, 1925:143; Miller 1937:42). Luego, el macho desciende al suelo cerca de la hembra, despliega la cola y se menea de un lado a otro. Sacude el cuerpo y abomba la garganta exponiendo el parche blanco, que combina con notas guturales. El cortejo se repite hasta la copulación (Gross, 1949; Bent, 1940:208).
Estas son las maneras del macho para atraer a su pareja potencial, pero el macho algunas veces se lanza en picado sobre las hembras, otros machos o depredadores (incluyendo personas) que están cerca del nido o de los polluelos (Rust 1947:177). El macho no protege directamente el nido (Dexter, 1952:110); la hembra al sentirse agredida, simula estar herida (se aleja volando y emite sonidos siseantes) (Tomkins, 1942:47).
El sitio de anidamiento lo elige la hembra (Campbell et al., 2006:44), y vuelve a él en años sucesivos (Dexter, 1952:109; Dexter, 1956:10; Dexter, 1961:79), aunque se ha registrado que los machos, durante al menos dos estaciones, eran diferentes.
Se han encontrado nidos en British Columbia desde el nivel del mar hasta los 1.495 m (Campbell et al., 2006:45).
Esta especie deposita los huevos directamente sobre el suelo desnudo (Dexter, 1956:10; Larson, 1970:3; Parks, 1946:55; Campbell et al., 206:45) y no construye ningún tipo de nido (Suomala, 2020:2); a veces los deposita en tocones o terrazas de arena gruesa; en sabanas y campos en zonas de temperatura tropical (American Ornithologist’s Union, 1983:308; Campbell et al., 2006:45; Fowle, 1946:159; Howell, 1959:19). También en alrededores de hábitats humanos (chimeneas, techos y cornisas (Abbot, 1914:10; Bowles 1921: 203; Parks, 1946:55; Sutton & Spencer, 1949:148; Dexter, 1956:10; Weller, 1958:57; Wedgwood, 1973:82).
© Mike Allen. Common Nighthawk Nest
Lakehurst, New Jersey, USA. 2008. Algunos derechos reservadosEl macho se posa durante el día en árboles cercanos al sitio de nidificación (Rust 1947:177; Fisher et al. 2004:83).
Puesta de 2 huevos en días sucesivos (Hiam & Sutherland, 1979:98; Fowle, 1946:159; Dexter, 1952:113; Dexter 1956:10; Dexter, 1961:79; Howell 1959:24; Rust 1947:177), entre los meses de mayo y julio (Cowles & Dawson 1951:19; Dexter, 1952:109; Fowle, 1946:159; Rust, 1947:177).
La hembra deja desatendidos los huevos o los polluelos solo para alimentarse al anochecer (Bowles 1921:208; Rust 1947:177; Dexter, 1952:109; Weller, 1958:52).
Mueven los huevos y polluelos con el pico, pies y plumas del pecho por razones termorregulatorias (Weller, 1958:54).
Si falla la nidada durante la incubación o a la salida del cascarón, la hembra se mueve a una nueva localización y lo intenta nuevamente (hasta 3 veces) (Suomala, 2020:2; Weller, 1958:57).
Huevos elípticos-ovales de color beige a gris-oliva pálido (Hiam & Sutherland, 1979:98), con un extremo ligeramente más pequeño que el otro y profusamente moteado de gris, castaño y negro. La cáscara sólida y moderadamente brillante.
La incubación (16-20 días) la realiza la hembra (Hiam & Sutherland, 1979:98; Tomkins, 1942:43; Rust, 1947:177; Brigham, 1989:723; Larson, 1970:4; Sutton & Spencer 1949:148; Dexter, 1952:109; Howell, 1959:24), aunque ocasionalmente la puede realizar el macho (Dexter, 1961:79).
Las crías son muy activas desde el nacimiento, mantienen la cabeza erguida y la mueven hacia los lados; ojos abiertos. Son capaces de desplazarse el primer día ante los llamados de la hembra (Fowle, 1946:160; Rust, 1947:177; Weller, 1958:56).
Generalmente silenciosos, emiten suaves “peep” cuando son manipulados (Fowle, 1946:160).
Ambos padres cuidan los pichones, que alimentan por regurgitación, al amanecer y atardecer. El macho asume la alimentación de los pichones y de la hembra mientras la hembra incuba la segunda puesta (Weller, 1958:58; Brigham, 1989:723).
En los días de temperaturas extremas las crías encuentran protección bajo su madre.
A los 16 días son capaces de levantarse y acostarse, y a los 18 días son capaces de realizar su primer vuelo (Rust, 1947:177; Dexter, 1952:113; Sutton & Spencer, 1949:148 ), aunque recién entre los 45-50 está completamente desarrollado y es capaz de unirse a la bandada (Rust 1947:177).
Captura su propia comida aproximadamente a los 25 días, aunque permanecen en el área de nidificación durante al menos 40 días (Suomala, 2020:2).
Controlan la temperatura moviéndose hacia sitios de sombra (Dexter, 1952:110) o vegetación (Fowle, 1946:159).MIGRACIÓNMigrante Neártica (Barnett & Pearman, 2001:48). Migran día y noche, aunque la mayoría han sido observados al atardecer en otoño.
Atraviesan grandes distancias entre sus áreas de reproducción áreas de invernada.
Generalmente llegan en primavera al sur de EEUU, y parten hacia el sur a comienzos de julio tanto de las áreas de nidificación del norte y sur de EEUU y Canadá.
Se vuelven gregarios durante la migración de otoño,y se han avistado bandadas de hasta 1.000 individuos (Ewins, 1993:75; De Graff, 1978:122; Bryant & Bryant, 1945:47). Las bandadas forman un rectángulo de 8-10 individuos de ancho y 15-20 de largo; vuelan rápido, aleteando al unísono, sin líder aparente (Rust, 1947:177).
Es una de las especies más tardías en arribar a los sitios de reproducción en primavera y una de las más tempranas en migrar en otoño hacia el sur (Cummings et al., 2003:423).
La mayoría viajan sobre Centroamérica, pasando por zonas centrales de Sudamérica, al este de los Andes, tanto a la ida como a la vuelta. Otro gran número de individuos pasa, en otoño, a través de Florida (Stevenson & Anderson 1994:373) y Cuba y los migrantes de primavera llegan a Florida a principios de abril (Stevenson & Anderson, 1994:373) y Bahamas desde el Golfo de México, lo que indica que esta especie no circunvala el golfo.
Según los datos publicados, en Sudamérica emprenden el regreso hacia sus sitios de reproducción en primavera; marzo en Paraguay y SE de Brasil (Hayes et al., 1990:955; Sick, 1997:417); marzo – abril a través de Colombia (Hilty & Brown, 1986) y a finales de mayo de Ecuador.
Llegan a EEUU entre abril y junio (Stevenson & Anderson, 1994:373; Rust 1947:177; Campbell et al. 2006:32). Las hembras arriban 2-7 días antes que los machos en Idaho, generalmente en grupos pequeños (Rust, 1947:177).
En otoño la migración hacia sudamérica se inicia en el mes de agosto hasta mediados de octubre (Bryant & Bryant, 1945:47; Wedgwood, 1973:82; American Ornithologist’s Union, 1983:308). En Florida desde mediados de julio hasta octubre (Stevenson & Anderson, 1994:373).
Llegan a Colombia y Venezuela desde finales de agosto a noviembre; a Manaos y Río Grande do Sul, en Brasil, de octubre a diciembre (Stotz et al., 1992:614); Paraguay en octubre (Hayes et al., 1990:955). -
Añapero boreal | Descripción

© Mulero, J. Common Nighthawk. Alturas, California. Late afternoon at the Modoc National Wildlife Refuge. Agosto 2021. Algunos derechos reservados De tamaño medio, mide unos 22-24 cm desde la punta del pico al final de la cola; plumaje críptico.
Sexos ligeramente dimórficos. Muy similares, especialmente en vuelo. Aunque el macho tiene una barra blanca al final de la cola, y las hembras carecen de ella, es prácticamente imposible distinguirlos en vuelo. La característica más visible del macho es su garganta blanca brillante, que en la hembra es beige-amarillenta pálida que en vuelo a menudo se observa más oscura. (Suomala, 2020:4); (Narosky, 2010:191); (Narosky & Chébez, 2002:61); (Salvador et al., 2017:48); (de la Peña, 2015:327)
© Andy Reago & Chrissy McClarren. Common Nighthawk. Oregón. Julio 2014. Algunos derechos reservados 
© stevenw12339. (Chordeiles minor). Mayo, 2015. Algunos derechos reservados
Macho: partes superiores castaño-grisáceas, marcadas irregularmente con motas parduzcas y blanquecinas, más tupidas en zona supraescapular y menos frecuentes en corona y espalda que a menudo no tiene marcas.
Cabeza grande, aplanada con grandes ojos; iris marrón oscuro.
Línea superciliar formada por pequeñas manchas blanquecinas en la parte anterior y más oscuras en la posterior.
Lores con vibrisas cortas que se extienden en la base del pico.
Franja malar amplia y lados de la cabeza y cuello castaño negruzco moteada de blanco y canela; ambos lados del cuello profusamente manchado con líneas blanquecinas y castañas claras.
Amplia franja blanca con forma de medialuna que se extiende desde la mitad de la barba hasta los lados de la garganta.
Parte inferior de la garganta y zona superior del pecho castaño grisáceo con llamativas manchas leonadas y blanquecinas
Pecho con manchas y barras quebradas de color beige claro y blanquecinas; el resto de partes inferiores blanquecinas barradas de castaño oscuro que se extiende hasta las cubiertas subcaudales.
Pico corto y ancho, boca grande.
Alas relativamente largas y puntiagudas que se extienden a lo largo del cuerpo hasta apenas más allá del final de la cola. Color castaño con motas blanquecinas.
Las remeras son ligeramente más oscuras que las timoneras; las 6 primarias externas cruzadas por una ancha banda blanca posterior a la punta de p9; la mitad externa del vexilo interno de las remeras secundarias con barras estrechas castaño-grisáceas a blanquecinas; las remeras terciarias con motas castañas claras y blanquecinas; cubiertas alares similares a las primarias con moteado castaño claro a blanquecino pero más irregular.
Tienen 10 remeras primarias funcionales, 12-13 secundarias (incluyendo 3 terciarias) (Bostwick & Brady 2002:948)
Abdomen y flancos profusamente barrados.
Cola corta y ligeramente furcada, castaño-grisácea, cruzada por 7 barras irregulares castaño-blanquecinas y castañas claras (más blancas en las timoneras centrales) y por una amplia banda subterminal blanca sobre las 4 timoneras externas (r2-r5)
con barra blanca (ausente en las hembras) y parche blanco en la garganta (beige -amarillento en las hembras); 10 timoneras (Bostwick & Brady 2002:948)
Patas pequeñas, cortas y débiles.
Roth y col. (2003:191) describieron que en el macho, a medida que aumentaba la edad, aumentaba significativamente el tamaño de la banda de la cola, aunque no el tamaño del parche en la garganta.
Hembra: Similar al macho, pero con (1) parche blanco de las alas (formado por la base blanca de las primarias) más pequeño y moteado; (2) cola sin barra blanca sub-terminal; (3) franja con forma de medialuna en la garganta color beige a ocrácea, a menudo moteada de oscuro; (4)zonas inferiores castañas, o más ocráceas, especialmente en parte posterior; (5) barras ventrales más anchas; y (6) moteado dorsal más grosero.
Se han registrado casos de plumajes aberrantes, como un caso de albinismo de un ejemplar recolectado en Lynchburg (Virginia) (Strother, 1886) y 2 especímenes con albinismo parcial (Ross 1963:11)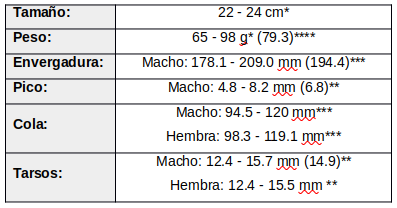
* (Suomala, 2020:4)
** (Oberholser, 1974; Godfrey, 1986)
*** (Selander, 1954:65)
**** (Brigham & Fenton, 1991:477)MUDAS
Ver descripción detallada y variación del plumaje en (Bostwick & Brady, 2002:948); (Ridgway, 1914:490); (Pyle, 1995:21); (Fowle, 1946:159-160); (Selander, 1954:57-59); (Goossen, 1986:62); (Dickerman, 1990:610); (Pyle, 2006:179); (Howell et al., 2003:635 y 645; 2004:209)Variación geográfica
La variación geográfica en esta especie es compleja dado su plumaje críptico, con colores y marcas tan sutiles e intrincadas.
A lo largo de su amplio rango de reproducción (que cubre casi toda América del Norte), existe una amplia variación en el color (saturación) y patrón del plumaje, y en menos medida en el tamaño corporal.
El Chordeiles minor exhibe una dilatada e inusual variación individual, tanto en el color como en el patrón del plumaje (Selander 1954:63); además, la coloración ventral varía de blanquecina en el Este y Centro de América del Norte a blanca en el Oeste.
También se ha descrito variación geográfica en los juveniles (Dickerman 1990:610).
El tamaño tiende a disminuir de norte a sur, aunque en promedio, los individuos más grandes se encuentran en las grandes planicies del norte (Selander 1954:64). -
Añapero boreal | Taxonomía
Protónimo: Caprimulgus minor
NOTA TAXONÓMICA
Existe el debate taxonómico si el orden Caprimulgiforme es monofilético (como tradicionalmente se ha reconocido) (Barrowclough et al., 2006; Livezey & Zusi, 2007:94; Hackett et al., 2008:1765; Braun & Huddleston, 2009:948; Mayr, 2010:126; Mariaux & Braun, 1996:228) o parafilético según estudios moleculares recientes (Braun & Huddleston, 2009:948).
Según Han et al. (2010:443), dentro del género Chordeiles, el C. minor es hermano del C. gundlachii. Estas especies son morfológicamente similares y sobre ésta base fueron tratadas como con-específicas durante muchas décadas, a pesar de la marcada diferencia en sus “llamadas” (Wetmore & Swales, 1931:256; Am. Ornithol. Union, 1957:307; Eisenmann, 1962:10)
Además de las diferencias en las “llamadas”, estas especies, durante la reproducción, se solapan en los Cayos de Florida (simpátricas) (Nicholson, 1957:506) y difieren en sus huevos, plumaje natal, juvenil y enzimas proteicas (Stevenson et al., 1983:983).SUBESPECIES Y DISTRIBUCIÓN
Se reconocen 9 subespecies basándose en el tamaño y coloración del plumaje (Brigham et al, 2020). (Retos de identificación: los nighthawks del género Chordeiles)
La coloración del barrado ventral y el moteado dorsal son diferentes entre los sexos, mucho más notorio en algunas subespecies (por ej., C. m. sennetti, C. m. howelli) que en otras (por ej., C. m. henryi, C. m. minor), siendo el C. m. howelli el que muestra mayor dimorfismo sexual (Selander 1954:58).
Todas las especies migran en invierno a través de América Central hacia Sudamérica, al Este de los Andes y hasta en Norte de Argentina, pero aún se desconoce el alcance específico de esta migración invernal en algunas de las subespecies.* Chordeiles minor minor
Distribución
C . m. minor (Forster, 1771). Incluye a: C. virginianus (Gmelin, 1789), C. popetue (Vieillot, 1807), C. americanus (Wilson, 1812), C. variegatus (Vieillot, 1817), C. jaspideus (Merrem, 1826) y C. wiederspergii (Reichenbach, 1846). Se reproducen desde el Sudeste de Alaska y Sur de Yukón hacia el Este hacia la Bahía de Hudson y Newfoundland y hacia el Sur hasta el Noroeste de Washington a través del Sur de Canadá y Norte de los Grandes Lagos Sur y Este de Oklahoma y Este y Sur de Carolina del Sur; los migrantes han alcanzado el Oeste de Europa al menos en 30 ocasiones.
Identificación
Es el más oscuro de todas las subespecies. Dorso gris castaño oscuro moteado de color beige o blanquecino. Las marcas leonadas, restringidas al pecho. Barras ventrales negras, densas y anchas. Banda alar blanca de tamaño Tamaño medio (envergadura macho:184-208 mm -Cleere, 1998)* Chordeiles minor hesperis
Distribución
C. m. hesperis (Grinnell, 1905). Incluye a C. m. twomeyi (Hawkins, 1948) (Selander 1954:69), y C. m. divisus (Oberholser, 1914) (Browning 1978:89). Históricamente llamado Añapero del Pacífico, se reproduce desde el Sureste de la Columbia Británica hacia el Este hasta el Suroeste de Saskatchewan y a través del centro de Nevada hacia el Oeste de Wyoming y Noroeste de Colorado.
Identificación
Oscuro como el C. m. minor, pero en general menos negruzco, moteado dorsal grisáceo, escaso barrado ventral, las marcas del pecho más tenues (más ocráceas y menos amarillentas), y extensas bandas alares.* Chordeiles minor sennetti
Distribución
C. m. sennetti (Coues, 1888).
Se reproduce en las Grandes Planicies desde el Sur de Saskatchewan y Sur a Este de Manitoba hacia el Noroeste de Iowa.
Identificación
Blanquecino (es la subespecie más pálida). Similar al C. m. hesperis pero con dorso más pálido y más grisáceo que negruzco, barras ventrales estrechas, más tupidas, y castaño-grisáceas; dorso más claro y más grisáceo, barras ventrales estrechas, tupidas, pardo-grisáceas; pecho gris; más grande (envergadura 186-223 mm; Cleere, 1998).* Chordeiles minor howelli
Distribución
C. m. howelli (Oberholser, 1914). Se reproduce al sur de las grandes planicies, desde el centro de Colorado y oeste de Kansas hacia el sur y noreste de Nuevo México, oeste de Oklahoma y norte de Texas.
Identificación
Intermedio entre el C. m. minor (más oscuro) y C. m. sennetti (más claro).* Chordeiles minor henryi
Distribución
C. m. henryi (Cassin, 1855). Llamado Añapero del oeste (Western Nighthawk). Se reproduce en el sudeste árido del sur de Utah y suroeste de Colorado hacia el sur a través del sureste de Arizona, la mayoría de Nuevo México, y montañas del oeste de Texas al este de Sonora, Chihuahua y Durango.
Identificación
Oscuro como el C. m. minor, pero menos grisáceo; más pardo en general con las marcas del pecho más castaño-rojizas.* Chordeiles minor aserriensis
Distribución
C. m. aserriensis (Cherrie, 1896). Se reproduce a lo largo de la costa desde centro y sur de Texas hasta el norte de Veracruz.
Identificación
Similar al C. m. chapmani pero más grisáceo en su conjunto; barras ventrales estrechas pardo-grisáceas, parte externa de la cloaca blanca.* Chordeiles minor chapmanni
Distribución
C. m. chapmanni (Coues, 1888). Llamado Florida o Chapman’s Nighthawk. Se reproduce a lo largo de la pendiente del golfo, desde el este de Texas hasta Florida y, sobre la vertiente atlántica a través del norte de la península de Florida hasta Carolina del sur.
EE. UU. (Florida, Texas, Carolina), este de México, Costa Rica, Nicaragua hasta el S. Brasil (Matto Grosso, Río Grande do Sul), Paraguay, Uruguay, Argentina (Córdoba, Sgo. del Estero, Tucumán, Corrientes, Bs. Aires) (Zotta, 1937:548); (Brodkorb, 1938:4)
Identificación
Similar al C. m. minor pero de menor tamaño (envergadura 178–196 mm), grisáceo (o pardo-grisáceo oscuro), moteado dorsal escaso y beige opaco, vientre blanco.* Chordeiles minor neotropicalis
Distribución
C. m. neotropicalis (Selander & Alvarez del Toro, 1955:144). Se reproduce desde Veracruz hacia centro de Chiapas, Guatemala,hacia suroeste de Honduras.
Identificación
Como el C. m. chapmani con motas dorsales tupidas de color beige, barras ventrales estrechas y pardas, y parte externa de la cloaca beige; ligeramente más grande.* Chordeiles minor panamensis
Distribución
C. m. panamensis (Eisenmann, 1962). Se reproduce en el sur de Centroamérica, desde Nicaragua s. Central America, from Nicaragua, a través de Panamá.
Identificación
Como el C. m. chapmani pero con la banda alar blanca mucho más pequeña, dorso más castaño-rojizo con moteado más amarillento-oscuro y vientre más beige. -
Añapero boreal (Chordeiles minor)

© Louis Agassiz Fuertes Birds of New York (New York State Museum). Common Nighthawk, Chordeiles minor. Dominio público El Añapero Boreal pertenece a la familia Caprimugidae, son aves activas al amanecer y anochecer, tanto en áreas rurales como urbanas.
El añapero boreal sigue siendo una especie poco conocida, sobre todo en lo que concierne a sus hábitos en la zona sur de su área de reproducción y áreas de invernada en Sudamérica.
Estudios recientes sugieren que, se está produciendo una disminución sustancial en el número de individuos de esta especie, tal vez debido a aumento de depredación, el uso indiscriminado de pesticidas que determina una disminución en el número de insectos, o pérdida del hábitat. En Canadá se supone que esta disminución es del 50% en las últimas 3 generaciones, por lo que se la considera como especie “amenazada” (Suomala, 2020:2).
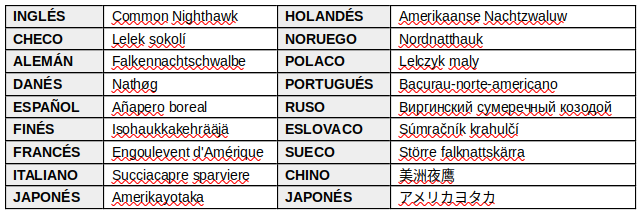
NOMBRES COMUNES: Añapero (Argentina, Uruguay); Añapero boreal (Argentina, Paraguay); Añapero migratorio, Añapero Yanqui (Bolivia); Gallina ciega boreal (Chile); Chotacabras migratorio, Chotacabras norteño, Gallinaciega norteño, Guardacaminos migratorio, Guardacaminos norteño (Colombia); Añapero zumbón (Costa Rica); Querequeté Americano (Cuba); Querebebé migratorio (República Dominicana); Pucuyo común (Honduras); Chotacabras mayor, Chotacabras zumbón (México); Chotacabras migratorio (Perú); Dormiloncito añapero (Uruguay); Aguaitacamino migratorio (Venezuela); Bacuaru-americano, Bacurau-de-bando, Bacurau-migrador, Bacurau-norte-americano (Brasil); En guaraní le dicen “Yvyja’u mi”
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS
- Catalogue of a collection of American birds. Sclater, Philip Lutley. London: N. Trubner and Co.,1862: 279 (Chordeiles minor)
- Museum ornithologicum Heineanum. Cabanis, Jean Louis, Heine, Ferdinand. Halbertstadt: In Commission bei R. Frantz,1850-1863. Vol 3: 86 (Chordeiles minor)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London,1874-98. Vol 16: 613 (Chordeiles minor)
- A history of North American birds. Baird, Spencer Fullerton, Brewer, T. M., Ridgway, Robert. Boston:Little, Brown,1905. Vol 2: 400 (Chordeiles popetue, var. minor)