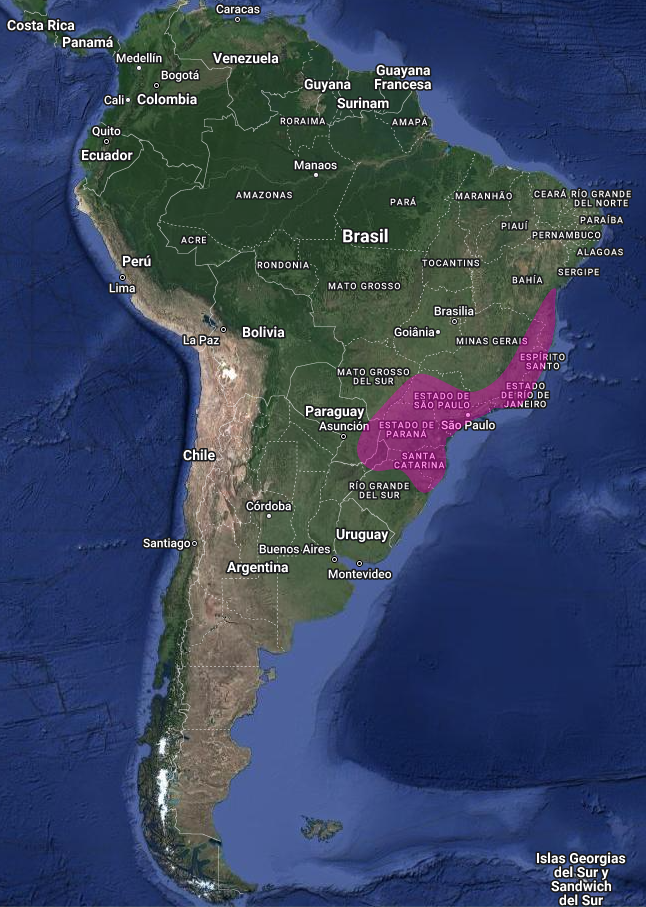
Se lo encuentra en vegetación de estrato abierto o cerrado de especies arbóreas que superan una altura de dosel de 15 m. Evita áreas degradadas, lo cual puede indicar una posible sensibilidad de la especie a las zonas deforestadas, ya que sí se las observa en áreas reforestadas (Saibene et al., 1996:23; Kuhnen et al., 2012:81; Coutinho Sangy Dias et al., 2016:890). Andan en pareja (Sick, 1993:95).
Esta especie es especialmente activa a lo largo del día (06:00 – 17:00 hs), aunque se observan 2 picos de actividad uno temprano por la mañana y otro al atardecer que se relacionan con el descenso de los pájaros de las perchas al amanecer y su retorno a las perchas al acabar el dia (Bokermann 1991, en Coutinho Sangy Dias et al., 2016:890; Kuhnen et al., 2013:80). Al atardecer se posa en ramas poco elevadas donde pernocta (generalmente en ramas bajas no menos de 2 m por encima del suelo, frecuentemente a 4 m o más). Se sube ruidosamente. Una vez alcanzada la percha, donde se posa sobre los tarsos (no utiliza los pies). Se baña en agua y al sol (Sick, 1993:95).
La muda, en periodo postnupcial, consume gran cantidad de energía; este proceso afecta su comportamiento, aislamiento térmico y vuelo resultando en una reducción de su actividad diaria (Coutinho Sangy Dias et al., 2016:892)
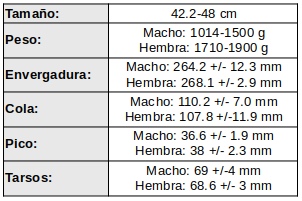
El vuelo es una mezcla de vuelo activo con aleteos rápidos, seguido de periodos de planeo. Vuelan una docena de metros y vuelven al suelo. Esta debilidad no se debe a mal desarrollo muscular sino a un inadecuado flujo sanguíneo arterial para el esfuerzo prolongado. Pulmones pequeños. El corazón, respecto al tamaño y peso total, es el más pequeño de todos los pájaros; alcanza sólo el 0.16-0.3% del peso total. Esta deficiencia en la circulación sanguínea dá un color verdoso-blanquecino la carne del tinamú, que al igual que el plumaje, se desintegra al menor impacto (Sick, 1993:102).
Vocalizaciones:
Cantan (ambos sexos) al amanecer y al caer la tarde (raro durante el día).
Emiten un silbido melancólico, repetido, uniforme, emitido y sustentado con firmeza.
Bajo, monosilábico «fohn», usando notas bajas o altas y manteniendo nota a lo largo de un tiempo variable; El macho llama menos y parece no repetir; lo hace posado. En época de reproducción, ambos emiten un «shororo» (llamada melodiosa, prolongada y trémula); la del macho es suave, corta, y con tremolar más rápido que el de la hembra. Lo emiten posados. Se pueden distinguir una media docena de vocalizaciones diferentes (Straneck, 1990:1; Sick, 1993:95 y 102; Sick, 1997:162; Cabot et al., 2020)
ALIMENTACIÓN
Semillas de muchas especies de plantas, incluidas las de las familias Rutaceae, Euphorbiaceae, Annonaceae, también frutas pequeñas, bayas y otras materias vegetales (Guimarães, 1944: 212; Guimarães & Lane, 1937:7; Guimarães, 1948:165; Guimarães, 1950:339; Kéler, 1938:323; Kéler, 1939:250; Schubart et al., 1965:102; Valim & Silveira, 2014:126); algunos insectos y otros invertebrados, y quizás ocasionalmente anfibios pequeños. Principalmente se alimenta por al atardecer. Busca semillas caídas en hojarasca (utilizan sus picos para voltear las hojas) (Sick, 1993:95)
REPRODUCCIÓN
Existen pocos datos sobre la época de reproducción que suele coincidir con la época de lluvias (Coutinho Sangy Dias et al., 2016:891)
El macho se ocupa de la construcción del nido (consiste una ligera depresión en el suelo forrada de hojas), incubación y cuidado de los pichones (Sick, 1993:95).
Deposita de 6-7 huevos azul-verdosos o turquesa por estación (Sick, 1993:95). ; la hembra deposita los huevos a intervalos de 3-4 días, cuando deja el nido los cubre con hojas. Incubación 19-20 días; no existen datos sobre el periodo de dependencia de las crías (Dabbene, 1919:260; de la Peña & Montalti, 2015:10; de la Peña, 2015:22; de la Peña, 2020:26-28)