| Cathartes aura jota (Molina, 1782) | |||
|---|---|---|---|
| Localidad | Partido/Departamento | Coordenadas | Citaciones |
| Citado para la provincia | (Darrieu & Camperi, 2001:12); (Darrieu, et al., 2013:14); (Roesler & Agostini, 2012:107); (Narosky & Di Giacomo, 1993:34) | ||
| Punta Rasa | Partido de la Costa | 36°22’S, 56°43’O | (Bremer & Bremer, 1987) |
| Sierra de la Ventana | Torquinst | 38°08’S, 61°47’O | (Doiny Cabré & Lejarraga, 2007) |
| Reserva Natural Integral de Selva Marginal de Punta Lara | Berazategui y Ensenada | 34°47’S, 58°01’O | (Klimaitis & Moschione, 1986); (Klimaitis & Moschione 1987) |
| Bahía Blanca | Bahía Blanca | 38°44’S, 62°16’O | (Marelli, 1933:194) |
| Monte Veloz | Punta Indio | 35°27′00″S, 57°17′00″O | (Pagano & Mérida, 2009: 210) |
| Reserva Costanera Sur | CABA | 34°38’S-59°28’O | (Pugnali, et al., 2016:3) |
| Saladillo | Saladillo | 35º45’S, 59º47’O | (Roda & Danti, 2015:33) |
-
-
Jote cabeza negra | Bibliografía
- Acerbo, P. E. (2000). Aves del río Neuquén. Autoridad Interjurisdiccional de Cuencas de los ríos Limay, Neuquén y Negro. 180 pp.
- Acevedo, D. & F. Bruno (2007). Lista de Aves del Parque Don Tomás. Santa Rosa, La Pampa. Editorial L. y M. Gral. Acha. La Pampa. (enlace)
- Acosta, J. C. & F. Murúa (2001). Inventario de la avifauna del Parque Natural Ischigualasto, San Juan, Argentina. Nótulas Faunísticas. Segunda Serie Nº 3: 1-4.
- Acreche, N., Núñez, H.A. & M.V. Albeza (1998).Vulnerabilidad de la avifauna del Parque Nacional Los Cardones, Salta, Argentina. Revista de Biología Tropical 46(3): 811-816. (enlace)
- Administración de Parques Nacionales. S.I.B. Ficha: Coragyps atratus; Recuperado el 10/01/2020 de https://sib.gob.ar/especies/coragyps-atratus
- Administración de Parques Nacionales (2017). Plan de Gestión. Parque Nacional Laguna Blanca. (Revisor del documento: Chehebar, C.).; 222 pp. (enlace)
- Alabarce, E. A., C. Laredo, R. Vides & M. Lucero (1990). Análisis de la estructura de una comunidad de aves en la localidad de Las Juntas, provincia de Catamarca. Estudio preliminar. Acta Zool. Lilloana, 39: 45-52. (enlace)
- Albert, L. A., C. Barcenas, M. Ramos, & E. Iñigo (1989). Organochlorine pesticides and reduction of eggshell thickness in a Black Vulture –Coragyps atratus- population of the Tuxtla Valley, Chiapas, Mexico. In Raptors in the Modern World. pp. 473–475. (enlace)
- Alonso, J. M., & Ronchi-Virgolini, A. L. (2008). Avifauna del Parque Nacional Pre-Delta, Entre Ríos, Argentina. Cotinga, 29(1), 126-134. (enlace)
- Alvarenga, H. M. F. (1985). Notas sobre os Cathartidae (Aves) e descrição de um novo gênero do cenozóico brasileiro. Anais da Academia Brasileira de Ciências 57:349–357. (enlace)
- Antelo, C. M. (1999). Análisis del impacto de las plantaciones de Pinus elliotti sobre la avifauna de Yungas (Tucumán-Argentina). Tesis de Maestría U.N.C., Centro de Zoología Aplicada.
- Antelo, C. M., Z. J. Brandán, C. I. Navarro & N. L. Marigliano (2006). Avifauna de un sector de bosque en Las Tipas (Tucumán-Argentina). Acta Zoológica Lilloana. 50 (1): 41-46. (enlace)
- Antelo, C. M. & Z. J. Brandán Fernández (2013). Las aves no Passeriformes de Tucumán, Argentina. Miscelanea 132. Fundación Miguel Lillo, Argentina. (enlace)
- Antelo, C. M. & C. I. Navarro (2017). Avifauna de un camino rural de montaña en las Yungas de Tucumán (Argentina). Acta Zoológica Lilloana. 61 (1): 3-14. (enlace)
- Anziano, A. (1962). Aves observadas, asi como coleccionadas en el Parque Nacional Nahuel Huapi. (S.I.B.)
- Apochian, C. (2000). Lista adicional de aves observadas durante la realización del Censo Neotropical de Aves Acuáticas. Secc. Río Grande. P.N. Los Alerces. (enlace)
- Aramburú, R. (1983). Lista preliminar de la avifauna de la Laguna Llancanello. Informe inédito, 12 pp
- ArgentAvis (s.f.) Ficha: Jote Cabeza Negra (Coragyps atratus); Recuperado 19/01/2021 de http://argentavis.com.ar/2012/sitio/especie_co.php?id=954
- Athanas, N., Greenfield, P. J., Campbell, I., Cervantes-Daza, P., Spencer, A. & S. Woods (2016). Birds of Western Ecuador. Princeton University Press; 430 pp.
- Aubry, Y., & R. Yank (1993). Quebec region. American Birds 47 (3):393. (enlace)
- Avise, J. C, Nelson, W. S., Sibley, C. G. (1994). DNA sequence support for a close phylogenetic relationship between some storks and New World vultures. Proceedings of the National Academy of Science 91: 5173-5177. (enlace)
- Babarskas, M., J. O. Veiga & F. C. Filiberto (1995). Inventario de Aves del Parque Nacional El Rey, Salta, Argentina. Monografía Especial L. O. L. A. Buenos Aires; Nº 6, 44 pp.
- Babarskas, M. & J. C. Chebez (1999). Notas breves sobre aves de la Argentina y países vecinos. Nuestras Aves 39: 12-14.
- Babarskas, M., E. Haene & J. Pereira (2003). Aves de la Reserva Natural Otamendi. En Haene, E. & J. Pereira (Eds.) Temas de Naturaleza y Conservación. Monografía de aves argentinas 3: 47-113. Aves Argentinas/AOP. Buenos Aires. (enlace)
- Balabusic, A. M., et al. (2001). Plan de Manejo del Parque Nacional Talampaya. Fase II. Administración de Parques Nacionales; 62 pp. (enlace)
- Baliño, J. (1984). Aves del Parque Nacional El Palmar, lista sistemática y otras contribuciones a su conocimiento. Rev. Mus. Arg. Cs. Nat. Zool. 13: 499-511.
- Ballejo, F., & L. J. M. De Santis (2013). Dieta estacional del Jote Cabeza Negra (Coragyps atratus) en un área rural y una urbana en el noroeste patagónico. El Hornero 028 (01):007–014. (enlace)
- Bang, B. G. (1972). The nasal organs of the Black and Turkey vultures: a comparative study of the Cathartid species Coragyps atratus atratus and Cathartes aura septentrionalis. Journal of Morphology 115:153–184. (enlace)
- Bang, B. G., & S. Cobb (1968). The size of the olfactory bulb in 108 species of birds. Auk 85:55–61 (enlace)
- Barnett, J.M., & Pearman, M. (2001). Annotated checklist of the birds of Argentina. Lynx Edicions. 164 pp.
- Barrionuevo, C. A., Julio, L. F. & Carma, M. I. (2002). Determinación de la Composición Especifica y Trófica de la Fauna Ornitológica en el Norte del Valle Central, Dto. Capital, Provincia de Catamarca. Congreso Regional de Ciencia y Tecnología NOA 2002. Secretaría de Ciencia y Tecnología, Universidad Nacional de Catamarca (enlace)
- Bauni, V., R. E. Carini, S. Bogan, J. M. Meluso, T. N. Abad, M. Homberg & A. Giacchino (2017). Inventario de vertebrados del “Paisaje protegido Delta Terra”, primera sección de islas del delta de Tigre, provincia de Buenos Aires, Argentina. Nótulas Faunísticas. Segunda Serie. 210: 1-11. (enlace)
- Beddard, F. E. (1898). The structure and classification of birds. London: Longmans, Green and Co. (enlace)
- Bechard, M. J., Sarasola, J. H. & Helbig, A. J. (2004). Morphometric Measures of male and female Spot‑winged Falconets- Spiziapteryx circumcinctus- sexed using PCR Amplification Methods. Raptors Worldwide. BirdLife Hungary, Budapest. (enlace)
- Belenguer, C. & S. M. Zalba (1997). Primera cita de nidificación del Jote de cabeza negra (Coragyps atratus ) para Buenos Aires. Hornero 014 (04): 247-248. (enlace)
- Beletzky, A. (1979a). Informe de ascenso al Cerro Millaqueo, Parque Nacional Nahuel Huapi. Nota No. 247.
- Beletzky, A. (1979b). Lista estacional de aves, Isla Victoria, P.N. Nahuel Huapi. (S.I.B.)
- Beletzky, A. (1979c). Observación de aves en el P.N. Los Alerces, mes de mayo de 1979. (S.I.B.)
- Beletzky, A. (1981). Lista de aves, Seccional Traful, Parque Nacional Nahuel Huapi. (S.I.B.)
- Beletzky, A. (1984a). Informe de recorridas a la zona del Río Ñirihuau (costa de lago) y Ea. Fortín Chacabuco. P.N. Nahuel Huapi. Nota No. 1570. (S.I.B.)
- Beletzky, A. (1984b). Transecta Costa Sur Lago Traful, lista de flora avistada. Parque Nacional Nahuel Huapi. (S.I.B.)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part I. Rheidae through Furnariidae. Bulletin of The American Museum of Natural History; Vol. 178, article 4: 369-636 (enlace)
- Beltzer, A. H. (1981). Lista preliminar de las aves del departamento La Paz (Entre Ríos, Argentina). I. No Passeriformes. Historia Natural 2: 53-56.
- Beltzer, A. H. (1986). Estudio preliminar de la avifauna de la Laguna del Cristal (Cuenca del río Saladillo, Santa Fe, Argentina). Historia Natural 8: 65-74.
- Beltzer, A. H., P. A. Collins & M. A. Quiroga (2006). Atlas ornitogeográfico de la provincia de Entre Ríos. Serie Climax Nº 13. Ceride-Conicet. Santa Fe
- Bendire, C. E. (1892). Life histories of North American birds with special reference to their breeding habits and eggs, with twelve lithographic plates. U.S. National Museum Special Bulletin 1. (enlace)
- Bent, A. C. (1937). Life Histories of North American Birds of Prey. Order Falconiformes. Part I. US National Museum Bulletin 167. (enlace)
- Bertolini, M. P. (1992). Listado de aves del Pasaje Palos Blancos, Ledesma, Jujuy. Inf. Inéd. APN-DTRNO. 2 págs. (S.I.B.)
- Bianchini, M. (2017). Contribuciones al conocimiento de la nidificación de aves en la Patagonia, Argentina. Historia Natural 7:69–83. (enlace)
- Biancucci, L. (1995). La comunidad de aves de la Pampa de Achala. Variación durante el ciclo anual. Cátedra de Diversidad Animal II, FCEF y N, UNC – UNC. 27 pp. (S.I.B.)
- BirdLife International (2020); Ficha: Coragyps atratus. Recuperado de http://www.birdlife.org el 07/10/2021.
- Blake, E. R. (1977). Manual of Neotropical Birds. Vol. 1. Spheniscidae (Penguins) to Laridae (Gulls and Allies). The University of Chicago Press, Chicago & London; 724 pp
- Blendinger, P. G. & M. E. Alvarez (2002). Ensamble de aves de los bañados de Carilauquen (Laguna Llancanello, Mendoza, Argentina) consideraciones para su conservación. Hornero 17: 71-83. (enlace)
- Blendinger, P. G., P. Capllonch & M. E. Alvarez (2004). Abundance and distribution of raptors in the Sierra de San Javier Biological Park, Northwestern Argentina. Ornitología Neotropical. 15: 501-512. (enlace)
- Blendinger, P. G. (2005). Especies de aves observadas en la Reserva Nacional El Nogalar, enero-marzo 2005. Proyecto «Dinámica del reclutamiento de Pino del Cerro (Podocarpus parlatorei): bases ecológicas para su manejo en bosques de montaña del noreste argentino». Informe inéd. a APN-DRNO. 4 pp. (S.I.B.)
- Bodrati, A., Casañas, H. & A. Pietrek (2000). Resultados del primer relevamiento ornitológico del Parque Provincial “Pampa del Indio” (Dto. Lib. Gral. San Martín, Chaco). AOP. Inf. Inéd. Buenos Aires.
- Bodrati, A. & Cockle, K. (2003). Lista de las aves registradas en Villa Unión, Banda Florida y el P.N. Talampaya, Provincia de La Rioja, entre el 25 y 30 de junio de 2003, 3 pp. (enlace)
- Bodrati, A., Mérida, E., Bodrati, G., & Sierra, E. (2006). Avifauna del talar de Vuelta de Obligado y sus ambientes contiguos. San Pedro, Pcia. de Buenos Aires, Argentina. E. Mérida & J. Athor J (Eds.) Talares bonaerenses y su conservación, 117-124. (enlace)
- Bodrati, A., K. Cockle, J. M. Segovia, I. Roesler, J. I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga 32: 41-64. (enlace)
- Bodrati, A., J. I. Areta & E. White (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves 57: 63-80. (enlace)
- Bonkewitzz, A. N. (1990). Fauna de vertebrados de la laguna Guatraché. Universidad Nacional del Sur. Dto. de Biología. Bahía Blanca, 103 pp.
- Braco, M. (1982). Lista de vertebrados observados en Seccional Falkner, Parque Nacional Nahuel Huapi. Nota No. 467. (S.I.B.)
- Brandán, Z. J. (2005). Avifauna de un sector del Bosque de transición Tucumano, en diferentes condiciones de uso. Acta Zoológica Lilloana, 49 (1-2): 3-8. (enlace)
- Brandán, Z. J., N. L. Marigliano, C. I. Navarro & C. M. Antelo (2006). Estructura y composición específica de la comunidad de aves de un área suburbana de la provincia de Tucumán, Argentina. Acta Zoológica Lilloana, 50 (1-2): 47-53 (enlace)
- Brandán, Z. & C. Antelo (2009). Composición y variaciones estacionales de la avifauna de un ambiente antropizados (San Pablo, Tucumán, Argentina). Acta Zoológica Lilloana, 53 (1-2): 98-103. (enlace)
- Brandán, Z. J. & C. I. Navarro (2009). Lista actualizada de las aves de la provincia de Tucumán. Fundación Lillo. Tucumán. (enlace)
- Brandán Fernández, Z. J. & N. L. Marigliano (2019). Lista comentada de las aves del río Nío/Tajamar, Dto. Burruyacu, Tucumán, Argentuna. Nótulas Faunísticas. Segunda Serie. 275: 1-3. (enlace)
- Brandolín, P., R. Martori & M. Ávalos (2007). Variaciones temporales de los ensambles de aves de la Reserva Natural de Fauna Laguna La Felipa (Córdoba, Argentina). Hornero 022 (01): 001-008. (enlace)
- Brandolin, P., Blendinger, P., Ramírez, R., Márquez, J., Miguel, Á. & Cantero, J. (2016). Birds of a wildlife reserve in the South American Pampa (Córdoba, Argentina). Check List, 12, 1. (enlace)
- Brooks, T. M., Barnes, R., Bartrina, L., Butchart, S. H. M., Clay, R. P., Esquivel, E. Z., Etcheverry, Ni. I., Lowen, J. C. & J. Vincent (1993). Project CANOPY’92: Final Report. (enlace)
- Brown, L. H., & D. Amadon (1968). Eagles, Hawks, and Falcons of the World. McGraw-Hill, New York, NY, USA; 945 pp.
- Brown, W. H. (1976). Winter population trends in the Black and Turkey Vultures. American Birds 30:909–912. (enlace)
- Bruno, F., Güller, R., Güller, P. & Erro, M. (2008). Aves observadas y consideraciones sobre el estado actual del AICA Victorica, Provincia de La Pampa, Argentina. Informe interno, Aves Argentinas /AOP, 6 pp.
- Brunton, D. F., & T. Pratt (1986). Sightings of a Black-throated Sparrow, Amphispiza bilineata, and a Black Vulture, Coragyps atratus, in British Columbia. Canadian Field-Naturalist 100:256–257. (enlace)
- Buckley, N. J. (1996). Food finding and the influence of information, local enhancement, and communal roosting on foraging success of North American vultures. Auk 113:473–488. (enlace)
- Buckley, N. J. (1997). Experimental tests of the information-center hypothesis with Black Vultures (Coragyps atratus) and Turkey Vultures (Cathartes aura). Behavioral Ecology and Sociobiology 41:267–279. (enlace)
- Buckley, N. J. (1998). Interspecific competition between vultures for preferred roost positions. Wilson Bulletin 110:122–125. (enlace)
- Buckley, N. J. (2020). Black Vulture (Coragyps atratus), version 1.0. In Birds of the World (A. F. Poole and F. B. Gill, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.blkvul.01
- Budin, E. (1931). Lista y notas sobre aves del N. O. Argentino (Prov. de Jujuy). Hornero 4: 401-411. (enlace)
- Bullock, D. S. (1956). Vultures as disseminators of anthrax. Auk 73:283–284. (enlace)
- Burgos, F. G., J. L. Baldo & F. M. Cornell (2009). Lista de las aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. S. S. de Jujuy. (enlace)
- Cabido, M., Anton, A., Cabrera, M., Cingolani, A., Diaz, S., Di Tada I. & Falczuk V. (2003). Informe Final de Linea de Base de la Biodiversidad y Programa de Monitoreo del P.N. Quebrada del Condorito y Reserva Hidrica Provincial Pampa de Achala. (S.I.B.)
- Camperi, A. R. (1998). Avifauna Andinopatagónica, lista comentada de especies. Physis Sec. C. 56 (130-131): 33- 46
- Camperi, A. R. & C. A. Darrieu (2000). Avifauna de Catamarca: Lista comentada de especies (No passeriformes). Physis Sec. C. 58 (134-135): 67-78.
- Camperi, A., Darrieu, C., Grilli, P., & Burgos, F. (2012). Avifauna de la provincia de Jujuy, Argentina: lista de especies (no Passeriformes). Acta zoológica lilloana, 56 (1-2): 82-140. (enlace)
- Canavelli, S., M. E. Zaccagnini, J. Torresín, N. Calamari , M. de la Paz Duccomun & P. Capllonch (2004). Monitoreo extensivo de aves en el centro-sur de Entre Ríos. Insugeo, Miscelánea 12: 349-362. (enlace)
- Capllonch, P. (1998). La avifauna de los bosques de Transición del Noroeste Argentino. Tesis doctoral, Facultad de Ciencias Naturales e Instituto M. Lillo, Universidad Nacional de Tucumán, 157 pp.
- Capllonch, P., Lobo, R., Ortiz, D. & R. Ovejero (2005). La avifauna de la selva de galería en el noreste de Corrientes, Argentina: Biodiversidad, patrones distribución y migración. Insugeo, Miscelánea, 14: 483-498. (enlace)
- Capllonch, P. (2007). Aves de Tafí del Valle. Tucumán. Argentina. (enlace)
- Capllonch, P., Ortiz, D., & Soria, K. (2008). Importancia del litoral fluvial argentino como corredor migratorio de aves. Insugeo, Miscelánea: 17: 107-120. (enlace)
- Capllonch, P., D. Ortiz & I. Ferro (2011). Notas sobre la avifauna de las Cumbres Calchaquíes, Tucumán, Argentina. Acta Zoológica Lilloana 55 (1): 50-63. (enlace)
- Capmourteres, V., V. Bauni, J. M. Meluso, S. Bogan & M. Homberg (2015). Aves de la Reserva Natural Campo San Juan, Misiones: descripción e implicancias para su conservación. Nótulas Faunísticas. Segunda Serie. Nº 171: 1-14. . (enlace)
- Carma, M. I. (2007). Relevamiento de aves de la provincia de Catamarca. (1º Ed.). Consejo Federal de Inversiones, CABA, Argentina, 2009; 500 pp. (enlace)
- Casares, J. (1944). Aves de Estanzuela. San Luis. Hornero 008 (03): 379-463. (enlace)
- Castellanos, A. (1932). Aves del valle de los Reartes (Córdoba). Hornero 005 (01): 1-40. (enlace)
- Cebolla-Badie, M. (2000). El conocimiento mbya-guaraní de las aves. Nomenclatura y Clasificación. Suplemento Antropológico. Universidad Católica. Revista del Centro de Estudios Antropológicos. Vol XXXV, Nº2. ISSN 0378-9896. (enlace)
- Ciarmiello, D., Fabri., S. & Gil, G. (2005). Campaña de prospección del estado de conservación de un sector del río Iguazú Superior (S.I.B.)
- Cingolani, A. & V. Falczuk (2003). Elaboración Plan de Manejo Integrado del P.N. Quebrada del Condorito y la Reserva Hídrica Provincial de Achala. Cuarto informe de Consultoría; 222pp.
- Clapp, R. B., M. K. Klimkiewicz, & J. H. Kennard (1982). Longevity records of North American birds: Gaviidae through Alcidae. Journal of Field Ornithology 53:81–208. (enlace) (enlace)
- Claramunt, S. & Cuello, J. P. (2004). Diversidad de la biota uruguaya. Aves. An. Mus. Hist. Nat. y Antropología, 10(6), 1-76. (enlace)
- Clark, R. G., & R. D. Ohmart (1985). Spread-winged posture of Turkey Vultures: single or multiple functions? Condor 87:350–355. (enlace)
- Clay, T. (1951). The mallophaga and relationships within the Falconiformes. Ibis 93:628. (enlace)
- Coconier, E. G., López Lanús, B., Roesler, I., Moschione, F., Pearman, M., Blendinger, P., Bodrati, A., Monteleone, D., Casañas, H., Pugnali, G. & M. E. Alvarez (2007). Lista comentada de las aves silvestres de la unidad de gestión Acambuco. Pp: 32-103. En Coconier, E. G. (Ed.). Las aves silvestres de Acambuco, Provincia de Salta, Argentina. Temas de Nat. y Cons. Nº 6. Nuestras Aves A.O.P. (enlace)
- Coleman, J. S. J.D. Fraser & C. A. Pringle (1985) Salt eating by Black and Turkey Vultures. Condor 87:291-292. (enlace)
- Coleman, J. S. & J. D. Fraser (1986). Predation on Black and Turkey vultures. Wilson Bulletin 98:600–601. (enlace)
- Coleman, J. S. & Fraser, J. D. (1987). Food habits of Black and Turkey vultures in Pennsylvania and Maryland. Journal of Wildlife Management; 51: 733–739. (enlace)
- Coleman, J. S., J. D. Fraser, & P. F. Scanlon (1988). Hematocrit and protein concentration of Black Vulture and Turkey Vulture blood. Condor 90:937–938. (enlace)
- Coleman, J. S., & J. D. Fraser (1989a). Age estimation and growth of Black and Turkey Vultures. Journal of Field Ornithology 60:197–208. (enlace)
- Coleman, J. S., & J. D. Fraser (1989b). Habitat use and home ranges of Black and Turkey vultures. Journal of Wildlife Management 53:782–792. (enlace)
- Coleman, J. S., & J. D. Fraser (1990). Black and Turkey vultures. In Proceedings of the Southeast Raptor Management Symposium and Workshop. National Wildlife Federation, Washington, DC, USA. pp. 78–88.
- Comisso, E. (2012). Informe de especies de fauna observadas en el Parque Nacional Los Alerces 2007-2012. (S.I.B.)
- Contaldi, M. D. M. B., Bildstein, K. & Fernandez, G. J. (2019). Ecología del jote cabeza negra (Coragyps atratus) en Patagonia. (enlace)
- Contino, F. (1980). Aves del Noroeste Argentino. U.N.S., Secretaría de Estado de Asuntos Agrarios, Dirección General de Recursos Naturales Renovables, 135 pp.
- Contreras, J. R. (1977). La avifauna del Valle del río Collón Curá, provincia del Neuquén. Idia. Suplemento 34: 250-270.
- Contreras, J. R. (1979). Lista faunística preliminar de los vertebrados de la Reserva Ecológica de Ñacuñan, Cuaderno Técnico (IADIZA) 1: 39-47.
- Contreras, J., Roig, V. & Giai, A. (1980). La avifauna de la Cuenca del Río Manso Superior y la orilla sur del Lago Mascardi, P.N. Nahuel Huapi, Provincia de Río Negro Historia Natural. Vol.1. (8):41-48. 1980
- Contreras, J. R. (1981). Lista preliminar de la avifauna correntina. I. No Passeriformes. Historia Natural 2: 21-28.
- Contreras, J. R. (1987). Lista preliminar de la avifauna de la provincia de Formosa, República Argentina. Historia Natural VII (4): 33-52.
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti & E. E. Utges (1990). Atlas ornitogeográfico de la provincia del Chaco. República Argentina. I. No passeriformes. Cuad. Téc. Félix de Azara Nº 1. 164 pág.
- Contreras, J. R., F. Agnolin, Y. E. Davies, I. Godoy, A. Giacchino & E. Ríos (2014). Atlas ornitogeográfico de la provincia de Formosa, República Argentina. 1º Ed. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 pp. (enlace)
- Coria, O. R., J. Heredia, R. Torres, J. Lima, P. Araujo, H. Zerda, M. Palacio & E. Roger (2017). Lista de aves de la sierra de Guasayán, Santiago del Estero, Argentina. Nótulas Faunísticas. Segunda Serie. 212: 1-14. (enlace)
- Chalukian, S. C. (1989). Relevamiento ecológico del Parque Nacional El Rey: Fauna. Informe de beca interna. Administración de Parques Nacionales. 100 pp. (S.I.B.)
- Chalukian, S., de Bustos, S., Saravia, M., Lizárraga, R. L., Serapio, R., Sola, M. F. & M. Romano (2002). Recategorización de Áreas Protegidas en el Corredor Transversal Sur, Salta, Argentina. Informe final. Secretaría de Medio Ambiente y Desarrollo Sustentable de la Provincia de Salta (SeMADeS) y Wildlife Conservation Society (WCS). 63 pp. Localización física del documento: DRNO (S.I.B.)
- Chatellenaz, M. L. (2004). La avifauna del bosque de Quebracho colorado y Urunday del noroeste de Corrientes, Argentina. Facena, 20: 3-12. (enlace)
- Chatellenaz, M. L. (2005). Aves del Valle del Río Paraná en la Provincia del Chaco, Argentina: riqueza, historia natural y conservación. Insugeo, Miscelánea 14: 527-550. (enlace)
- Chatellenaz, M. L., P. Cano, C. Saibene & H. A. Ball (2010). Inventario de las aves del Parque Nacional Mburucuyá (provincia de Corrientes, Argentina). Acta Zool. Lilloana 54: 139-160. (enlace)
- Chebez, J. C., N. R. Rey, M. Babarskas & A. G. Di Giacomo (1998). Las aves de los Parques Nacionales de la Argentina. Monografía Especial L.O.L.A. Nº 12; 126 pp. Bs.As.
- Chebez, J. C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía Nº 5. Págs. 320. L. O. L. A. Bs.Aires.
- Chebez, J., Bosso, A., Heinonen, S., Liva, A. & Chavez, H. (2001). Aves del Parque Natural Municipal Dr. Luis Honorio Rolón. Puerto Iguazú, Misiones.
- Chebez, J. C. (2005). Guía de las Reservas Naturales de la Argentina. Noroeste. Ed. Albatros, Buenos Aires; 288 pp.
- Chebez, J. C. & N. S. Morandeira (2007). Parque Nacional El Palmar. En A. S. Di Giacomo (editor). Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 168-170. Temas de Naturaleza y Conservación 5. Aves Argentinas/Asociación Ornitológica del Plata. Buenos Aires. (enlace)
- Chehebar, C., E. J. Ramilo & S. A. Mazzuchelli (1992). Parque Nacional Laguna Blanca. Plan General de Manejo. Documento preliminar para discusión. Delegación técnica regional. Informe inédito. Administración Parques Nacionales. (enlace)
- Chehebar, C. & E. J. Ramilo (1992). Fauna del Parque Nacional Nahuel Huapi. Administración de Parques Nacionales y Asociación Amigos del Museo de la Patagonia “Francisco Pascasio Moreno”, San Carlos de Bariloche, 38 pp.
- Chesser, R. T., S. M. Billerman, K. J. Burns, C. Cicero, J. L. Dunn, A. W. Kratter, I. J. Lovette, N. A. Mason, P. C. Rasmussen, J. V. Remsen, Jr., D. F. Stotz, & K. Winker (2020). Check-list of North American Birds (online). A.O.S.(enlace)
- Chester, S. (2008). A Wildlife Guide to Chile. (1º Ed.). Published by Princeton University Press, 41 William Street, Princeton, New Jersey 08540. 392 pp.
- Christie, M. (1984). Informe de evaluación del interés biológico del area de Villa Traful. Actual Comisión de fomento, antes: Parque Nacional Nahuel Huapi. (S.I.B.)
- Christie, M. I., E. J. Ramilo & M. D. Bettinelli (2004) Aves del noroeste patagónico. Atlas y guía. L. O. L. A. pp. 328
- Cid, D. F. & Caviedes-Vidal, E. (2005). Avifauna da Represa “La Florida” (San Luis, Argentina). Atualidades Ornitológicas N.125:10. (enlace)
- Daciuk, J. (1968). Estación biológica de Puerto Radal, Isla Victoria, para la investigación de la vida silvestre. P.N. Nahuel Huapi. Exp. No. 5814/68. (S.I.B.)
- Dardanelli, S., Serra, D. A., & Nores, M. (2006). Composición y abundancia de la avifauna de fragmentos de bosque de Córdoba, Argentina. Acta zoológica lilloana, 50(1-2), 71-83. (enlace)
- Darrieu, C.A. & A.R. Camperi (2001) Nueva lista de las aves de la provincia de Buenos Aires. Cobiobo Nº 3-Probiota No 2. Sec. de Política Ambiental. UNLP. Buenos Aires. (enlace)
- Darrieu, C. A., A. R. Camperi, & S. Imberti (2008). Avifauna (no Passeriformes) of Santa Cruz province, Patagonia (Argentina): annotated list of species. Revista del Museo Argentino de Ciencias Naturales 10:111–145. (enlace)
- Darrieu, C. A., A. R. Camperi, J. J. Maceda & F. Bruno (2011). Avifauna de la provincia de La Pampa, Argentina: lista de especies (no passeriformes) Acta Zoologica Lilloana. 55: 64 – 108. (enlace)
- Decker, M. D., P. G. Parker, D. J. Minchella, & K. N. Rabenold (1993). Monogamy in Black Vultures: genetic evidence from DNA fingerprinting. Behavioral Ecology 4:29–35. https://doi.org/10.1093/beheco/4.1.29
- De la Peña, M. R. (1987). Nidos y huevos de aves argentinas. (Ed. del autor). Santa Fe, Argentina.
- De la Peña, M. R. (1999). Aves argentinas. Lista y distribución. L.O.L.A. (Literature of Latina America). Buenos Aires. 244 pp.
- De la Peña, M. R. (2001). Observaciones de campo en la alimentación de las aves. Rev. FAVE. Vol. 15 N° 1: 99- 107. (enlace)
- De la Peña, M. R. (2006) Lista y distribuciónde las aves de Santa Fe y Entre Ríos. Monografía Nº 15; L.O.L.A. (Literature of Latin America), Buenos Aires; 138 pp.
- De la Peña, M. R., F. C., Laene Silva, R., Capuccio, G. & Bonín, L. M. (2009) Aves del Río Uruguay. Guía Ilustrada de Especies del Bajo Uruguay y el Embalse de Salto Grande. Comisión Administradora del Río Uruguay. CARU. 247 pp. (enlace)
- De la Peña, M. R. & S. A. Salvador (2010). Manual de la alimentación de las aves argentinas. UNL. (Digital) (enlace)
- De la Peña, M. R. & R. F. Tittarelli (2011a). Guía de aves de La Pampa. Santa Rosa. Gobierno de La Pampa
- De la Peña, M. R. (2011b). Atlas ornitogeográfico de la provincia de Santa Fe. Serie Naturaleza y Conservación No 4. Pág. 1-500
- De la Peña, M. R. (2012). Distribución y citas de aves de Entre Ríos. Serie Naturaleza y Conservación Nº 6. Pág. 1- 206.
- De la Peña, M. R. (2013). Nidos y reproducción de las aves argentinas. Ediciones Biológica. Serie Naturaleza, Conservación y Sociedad N° 8. Santa Fe, Argentina. 590 pp. (enlace)
- De la Peña, M. R. (2015) Aves argentinas (1º Ed.) Santa Fe; Ediciones U.N.L. C.A.B.A.: EUDEBA; Vol 1: 496 pp.
- De la Peña, M. R. (2020). Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución (Actualización). Comunicaciones del Mus. Prov. de Ciencias. Nat. “Florentino Ameghino” (Nueva Serie) Año 2020 | N° 4 | Pág. 1-255
- del Hoyo, J. (2020). All the Birds of the World. Lynx Edicions, Barcelona.
- De Lucca, E. R. (2016). Reproducción del Jote cabeza negra (Coragyps atratus) en un nido construido por Loros barranqueros (Cyanoliseus patagonus) en un acantilado del litoral patagónico, Argentina. Nótulas Faunísticas 194: 1-6. (enlace)
- De Lucca, E. R. & J. P. De Lucca (2017). Aves de presa diurnas que nidifican en estructuras construidas por el hombre en la Argentina. Nuevos aportes y una revisión. Nótulas Faunísticas. Segunda Serie. 220: 1-10. (enlace)
- de Viana, M. L., Garrido, J. L., Regidor, H., Núñez, A. & R. Acosta (1998). El ambiente biótico de la obra. Pp. 109-142. En: Estudio de Impacto Ambiental. Ruta Provincial No. 33. Tramo El Carril – Payogasta. Sector Piedra de Molino a Cajoncillo y Cajoncillo acceso a Tonco. Dirección de Vialidad, Gobierno de la Provincia de Salta. IRNED – UNSa. 186 pp. (S.I.B.)
- Dieguez, A. & Sijovich, C. (1997). Conteo de aves rapaces (Accipitridae-Falconidae-Cathartidae-Strigidae) en la Reserva Natural Otamendi, Pdo. de Campana, Pcia de Bs. As. Aprona. Boletín Científico, nov. 1997. (enlace)
- Di Giacomo, A. G. (2005). Aves de la Reserva El Bagual. En Di Giacomo, A. G. y S. F. Krapovickas (Eds.). Historia natural y paisaje de la Reserva El Bagual, provincia de Formosa, Argentina. Inventario de la fauna de vertebrados y de la flora vascular de un área del Chaco Húmedo. Temas de Naturaleza y Conservación 4: 201-465. Aves Argentinas/AOP. Buenos Aires. (enlace)
- Echevarria, A. L., Marigliano, N. L., & Chani, J. M. (1998). Composición y variaciones anuales de la diversidad de aves de una localidad de Bosque Chaqueño Serrano (Ticucho, El Cadillal, Tucumán, Argentina). Acta Zoológica Lilloana, 44(1), 207-217. (enlace)
- Echevarría, A. L. & J. M. Chani (1999). Lista de aves del embalse El Cadillal, provincia de Tucumán. Acta Zoológica Lilloana 45 (1): 141-145. (enlace)
- Echevarría, A. L. & J. M. Chani (2000). Estructura de las comunidades de aves acuáticas del embalse El Cadillal, Tucumán, Argentina. Acta Zoológica Lilloana 45 (2): 219-232. (enlace)
- Echevarria, A. L. (2001). Estudios ecológicos de las aves acuáticas del embalse El Cadillal, provincia de Tucumán. Tesis doctoral, Facultad Ciencias Naturales e Instituto M. Lillo, Universidad Nacional de Tucumán, 206 pp.
- Echevarría, A. L. & J. M. Chani (2006). Aves migratorias, la importancia del embalse El Cadillal, (Tucumán, Argentina) como sitio de tránsito e invernada. Acta Zoológica Lilloana 50 (1-2): 97-108. (enlace)
- Echevarria, A., Marano, C. & Fanjul, E. (2008a). Comunidades de aves del embalse Escaba y sus alrededores, Tucumán. Resumen de XII Reunión Argentina de Ornitología, 5 al 8 de marzo 2008, San Martín de los Andes, Neuquén, Argentina. (enlace)
- Echevarría, A. L., C. F. Marano, J. M. Chani & M. C. Cocimano (2008b). Composición de la comunidad de aves del embalse La Angostura, Tafí del Valle, Tucumán. Acta Zoológica Lilloana 52 (1-2): 98-105. (enlace)
- Echevarría, A. L., C. F. Marano, M. C. Cocimano, M. E. Fanjul & M. A. Cormenzana (2014). Composición y variación de la comunidad de aves del embalse El Tunal, Salta, Argentina. Acta Zoológica Lilloana 58 (1): 80-93. (enlace)
- Echevarria, A. L., & Fanjul, M. E. (2016). Estructura, composición y variación estacional de la avifauna del Embalse Escaba (selva montana subtropical), Tucumán, Argentina. Acta zoológica lilloana, 101-115. (enlace)
- Echevarría, A. L., M. E. Fanjul, M. V. Martínez & A. Benavidez (2019). Avifauna de los bañados de Añatuya, área de importancia para la conservación de las aves (AICA) de Santiago del Estero, Argentina. Hornero 34 (2): 43-49. (enlace)
- EcoRegistros (2020). Ficha: Jote Cabeza Negra (Coragyps atratus) (Bechstein, 1783); Recuperado de https://www.ecoregistros.org/ficha/Coragyps-atratus, el 19/01/2020
- Eisenmann, E. (1963). Is the Black Vulture migratory? Wilson Bulletin 75:244–249. (enlace)
- Elias, D. J., & G. D. Valencia (1982). Unusual feeding behavior by a population of Black Vultures. Wilson Bulletin 94:214. (enlace)
- Emslie, S. D. (1988). An early condor-like vulture from North America. Auk 105:529–535. (enlace)
- Ericson, P.G.P., Anderson, C.L.A., Britton, T., Elzanowski, A., Johansson, U.S., Källersjö, M., Ohlson, J. I., Parsons, T. J., Zuccon, D. & Mayr, G. (2006). Diversification of Neoaves: integration of molecular sequence data and fossils. Biology letters, 2(4), 543-547 (enlace)
- Fandiño, B., & Giraudo, A. R. (2010). Revisión del inventario de aves de la provincia de Santa Fe, Argentina. U.N.L. (enlace)
- Fandiño, B. & A. A. Pautasso (2011). Avifauna del AVP La Salamandra, pp.: 62-105. En: Pautasso, A. A. 2011. La fauna y su conservación en los Bajos Submeridionales. Ediciones Biológica. Serie Naturaleza, Conservación y Sociedad No 5. Santa Fe, Argentina, 278 pp. (enlace)
- Fandiño, B., L. A. Leiva, A. A. Pautasso, H. Luna & M. Manassero (2015). Avifauna de las reservas natural manejada “El Fisco” y privada de uso múltiple “Isleta linda”, Santa Fe, Argentina. Nuestras Aves 60: 39-45. (enlace)
- Fandiño, B., J. M. Fernández, M. L. Thomann, R. Cajade & A. B. Hernando (2017). Comunidades de aves de bosques y pastizales en los afloramientos rocosos aislados del Paraje Tres Cerros, Corrientes, Argentina. Revista de Biología Tropical Vol. 65 (2): 535-550. (enlace)
- Fandiño, B. (2020). Inventarios de aves de la Reserva Natural Estricta La Loca y la Reserva Natural Manejada Potrero 7B, en la “Cuña Boscosa”(Chaco Húmedo) de Santa Fe, Argentina. Acta Zoológica Lilloana, 130-147. (enlace)
- Farinaccio, F. M. (2008). Determinación de la estructura del ensamble de aves de un sector de humedal periurbano de la ciudad de Plottier, provincia de Neuquén. Tesis de Grado. Universidad Nacional de Comahue (enlace)
- Fariñas Torres, T., Rios, A., Schiappacasse, E., Mañez, M., Beruhard, J. & Morales, R. (2019). Relevamiento de fauna para la puesta en valor de la Reserva Natural de Usos Múltiples Cerro del Cóndor, departamento Pocho, Córdoba, Argentina. (enlace)
- Fava, G., Acosta, J. C., Laspiur, J. A. & Moreno, M. V. (2012). Avifauna del Valle de Calingasta y sus alrededores, provincia de San Juan, Argentina. Acta zoológica lilloana, 66-81. (enlace)
- Fava, G. A., J. C. Acosta G. & M. Blanco (2017). Efecto de la estacionalidad y lluvias en la avifauna del Chaco Serrano Austral, Argentina. Rev. Biol. Trop. Vol. 65 (3): 953-961. (enlace)
- Feduccia, A. (1996). The Origin and Evolution of Birds. Yale University Press, New Haven, CT, USA.
- Ferguson-Lees, J. & D. A. Christie (2001). Raptors of the World. Christopher Helm, London, United Kingdom.
- Fernandez, J. M., Thomann, L., Fandiño, B., Cajade, R. & Hernando, A. (2021). An annotated checklist of birds of Paraje Tres Cerros, Corrientes province, Argentina. Check List, 17, 415. (enlace)
- Fernández, V., & Borghi, C. E. (2010). Nuevos registros y comentarios sobre la avifauna del noreste de la provincia de San Juan y el Parque Provincial Ischigualasto. (enlace)
- Ferrer, D., R. Olivera, A. Elías, M. Pérez & P. Isola (2019). Lista actualizada de aves registradas en la provincia de Mendoza, Argentina. Historia Natural , Tercera Serie. Vol. 9 (2): 81-106. (enlace)
- Ferreyra, M. & Vidoz, F. (2007). Exploración de la flora, vegetación y fauna altoandinas en el Parque Nacional Lago Puelo. Informe Final. Año 2007. (enlace)
- Fiora, A. (1939). Distribución geográfica de las especies de aves capturadas en la provincia de Jujuy y zonas limítrofes. Physis 16: 272-289.
- Fiori, S. M. & S. M. Zalba (1999). Plan de Manejo de la Reserva Provincial Auca Mahuida, Neuquén. GEKKO Grupo de estudios en Conservación y Manejo. Departamento de biología, Bioquímica y Farmacia, Universidad Nacional del Sur-Bahía Blanca; 260 pp. (enlace)
- Fisher, H. I. (1939). Pterylosis of the Black Vulture. Auk 56:407–410. (enlace)
- Floria, M. P. (2014). Monitoreo de aves en el Parque Nacional Los Alerces. Zona Sur. Proyecto Eólico Futaleufú. Informe semestral ( enero-junio 2014) (S.I.B.)
- Fraga, R. M. (2001). The avifauna of Estancia San Juan Poriahú, Iberá marshes, Argentina: check-list and some natural history notes. Cotinga 16: 81-86. (enlace)
- Frenzel, J. (1891). Uebersicht uber die in der Provinz Córdoba (Argentinien) vorkommenden Vogel. J. F. Orn., 194: 113-127. (enlace)
- Friedmann, H. (1950). The Birds of North and Middle America. Part XI. Cathartidae to Falconidae. U.S. National Museum Bulletin no. 50. Smithsonian Institution, Washington, DC, USA. (enlace)
- Gallardo, J. M. (1987). Observaciones sobre Coragyps atratus (Aves, Cathartidae) en semilibertad. Revista del M. A.C.N., Bernardino Rivadavia. Zoología, 14 (1).
- Garrahan, P. (1980). Aves observadas en la Isla Victoria, PN Nahuel Huapi. (S.I.B.)
- Garrido, O. H. & A. Kirkconnell (2000). Field Guide to the Birds of Cuba. Cornell University Press, Ithaca, NY, USA.
- Gelain, M. A. (1984). La avifauna del Cerro Otto. Nuestras aves 3: 4-5.
- Gelain, M. A. (2001). Lista sistemática de las aves del Municipio de San Carlos de Bariloche, Río Negro, Argentina. Ed. Grupo Naturalista Sur Patagonia.
- Gelain, M. A., L. Sympson & F. F. Vidoz (2003). Aves de Bariloche. Lista comentada de aves del departamento Bariloche, Provincia de Río Negro, Argentina. Libros del Mediodía. San Carlos de Bariloche.
- Gelain, M. A. (2010). Aves de la patagonia argentina: atlas ornitológico de Río Negro. San Juan
- Gelain, M. A. & J. Tolosa (2011a). Aves de la provincia de Río Negro. Lista sistemática. Xolmis CRO 6: 1-37
- Gelain, M. A. & R. Pereyra Lobos (2011b). Lista de aves de la provincia de San Juan, Argentina. Xolmis CRO 3: 1- 12.
- Gelain, M. A. (2014). Lista preliminar de aves del departamento Angaco, provincia de San Juan, República Argentina. Xolmis 35: 1-27.
- Giacchino, H., Posadas, C. & Williams, D. (1980). Informe de la recorrida realizada a la cabecera O. del lago Martin, Seccional Inacayal. Nota No. 263. (S.I.B.)
- Giai, A. G. (1950). Notas de viajes. Por el norte occidental de Santa Fe y por el norte de Misiones. Hornero 9: 121- 164. (enlace)
- Gil, G. (1996). Primer relevamiento expeditivo del Parque Nacional Campo de los Alisos. Inf. Inéd. APN-DTRNO. 36 p gs. (S.I.B.)
- Giraudo, A. R., J. L. Baldo & R. R. Abramson (1993). Aves observadas en el sudeste, centro y este de Misiones (República Argentina), con la mención de especies nuevas o poco conocidas para la provincia. Nótulas Faunísticas 49: 1-13. (enlace)
- Giraudo, L., M. Kufner, R. Torres, D. Tamburini, V. Briguera & G. Gavier (2006). Avifauna del Bosque Chaqueño Oriental en la provincial de Córdoba, Argentina. Ecología Aplicada 5: 127-136. (enlace)
- Girini, J. M. (2014). Informe de avance de proyecto: «Cambios en las poblaciones de aves ante la presencia de visón americano Neovison vison en lagos y lagunas del Parque Nacional Lanín, Neuquén». (S.I.B.)
- Gómez, V. E. (2006). Aves del Parque General San Martín (Mendoza). Distribución y características. Multequina, 15 (2): 81-95, versión on line. (enlace)
- Gómez, A. & F. Vocos (1992). Especies detectadas en el Parque Nacional El Rey (Salta, Rep. Arg.). Inf Inéd. APN-DTRNO. 4 pp. (S.I.B.)
- Gorgoglione, C. E. (2005). Guía de campo para la identificación de las aves del Neuquén. Edición del autor. 3º Edición. Junín de los Andes. 279 p.
- Gorleri, F., M. C. Gorleri & M. Murdoch (2011). Aves de la Reserva de Biosfera Laguna Oca, Formosa, Argentina. Universidad Nacional de Formosa/SPU Programa de Voluntariado Universitario. Ideas Gráficas. Formosa. 158 pp.
- Gorleri F. & Di Giácomo A.G. (2011) Lista sistemática de las aves de la Reserva de Biosfera Laguna de Oca del Río Paraguay, Formosa. Aves argentinas (enlace)
- Greeney, H. F., R. A. Gelis, & R. White (2004). Notes on breeding birds from an Ecuadorian lowland forest. Bulletin of the British Ornithologists’ Club 124:28–37. (enlace)
- Greider, M., & E. S. Wagner (1960). Black Vulture extends breeding range northward. Wilson Bulletin 72:291. (enlace)
- Greiner, E. C., G. F. Bennett, E. M. White, & R. F. Coombs (1975). Distribution of avian hematozoa of North America. Canadian Journal of Zoology 53:1762–1787. (enlace)
- Griffiths, C. S. (1994). Monophyly of the Falconiformes based on syringeal morphology. Auk 111 (4):787-805. (enlace)
- Grube, G. E. (1953). Black Vulture breeding in Pennsylvania. Wilson Bulletin 65:119. (enlace)
- Grunberg, H. (1984). The autumn migration: Northwest Canada region. American Birds 38:223–224
- Haene, E. & Gill G. (1991). El Proyecto Parque Nacional Sierra de las Quijadas (Provincia de San Luis, República Argentina). Informe inédito APN. 100pp. (S.I.B.)
- Haene, E. (2007). Parque Nacional Sierra de las Quijadas. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 400-101. Temas de Naturaleza y Conservación 5. CD-ROM. Ed. Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Hartert, E. & S. Venturi (1909). Notes sur les oiseaux de la République Argentine. Novit. Zool. 16: 159-267. (enlace)
- Hartman, F. A. (1955). Heart weight in birds. Condor 57:221–238. (enlace)
- Haverschmidt, F. (1947). The Black Vulture and the Caracara as vegetarians. Condor 49:210. (enlace)
- Haverschmidt, F. (1977). Allopreening in the Black Vulture. Auk 94:392. (enlace)
- Hayes, F. E. (1995). Status, Distribution and Biogeography of the Birds of Paraguay. Monographs in Field Ornithology, Nº1; 224 pp. (enlace)
- Hecker E. & F. Vidoz (1998). Aves del Lago Escondido. 95 pp. Hidden Lake S.A.
- Henckel, E. (1976). Turkey Vulture banding problem. North American Bird Bander 1:126. (enlace)
- Heredia, G. & M. Funes (1987). Informe técnico sobre el Parque provincial Tromen-Los Barros y Reserva Provincial Lagunas de Epu Lauquen. Subsecretaría de la Producción y Recursos Naturales de la Provincia del Neuquén. Infome Inédito.
- Heredia, J. (2006). Aves de las Sierras de Córdoba. Guía de campo. 50 p. La Falda. Córdoba
- Hervas, J. M., Gallo, Arias & F. Villafañe (2004). Informe Técnico. Registro ocasional de especies en el P.N. Talampaya Nº 2. 5 pp.
- Hill, J. R., III, & P. S. Neto (1991). Black Vultures nesting on skyscrapers in southern Brazil. Journal of Field Ornithology 62:173–176. (enlace)
- Hilty, S. L., Tudor, G. & Gwynne, J. A. (2003). Birds of Venezuela. (2º Ed.). Princeton University Press; 875 pp.
- Hudson, G. E. (1948). Studies on the muscles of the pelvic appendages in birds II: the heterogenous order Falconiformes. American Midland Naturalist 39:102-127. (enlace)
- Houston, D. C. (1985). Evolutionary ecology of Afrotropical and Neotropical vultures in forests. Ornithological Monographs 36:856–864. https://doi.org/10.2307/40168321. (enlace)
- Houston, D. C. (1986). Scavenging efficiency of Turkey Vultures in tropical forest. Condor 88:318–323. (enlace)
- Houston, D. C. (1988). Competition for food between Neotropical vultures in forest. Ibis 130:402–417. (enlace)
- Houston, D. C., & J. E. Cooper (1975). The digestive tract of the whiteback griffon vulture and its role in disease transmission among wild ungulates. Journal of Wildlife Diseases 11:306–313. (enlace)
- Hutton, J. & Schimff, S. (2001). Lista de Aves. Parque Nacional Mburucuyá (S.I.B.)
- Iñigo Elías, E. E. (1987). Feeding habits and ingestion of synthetic products in a Black Vulture population from Chiapas, Mexico. Acta Zoológica Mexicana 22:1–15. (enlace)
- Jackson, J. A. (1975). Regurgitative feeding of young Black Vultures in December. Auk 92:802–803. (enlace)
- Jackson, J. A., I. D. Prather, R. N. Conner & S. P. Gaby (1978). Fishing behavior of Black and Turkey Vultures. Wilson Bulletin 90:141–143. (enlace)
- Jackson, J. A. (1983). Nesting phenology, nest site selection, and reproductive success of Black and Turkey vultures. In Vulture Biology and Management (S. R. Wilbur and J. A. Jackson, Editors). University of California Press, Los Angeles, CA, USA; 245–270.
- Jones, H. L. & Vallely, A. C. (2001) Annotated Checklist of th Birds of Belize. Lynx Edicions. Barcelona; 71 pp.
- Juri, M. D. & J. M. Chani (2005). Variación en la composición de comunidades de aves a lo largo de un gradiente urbano (Tucumán, Argentina). Acta Zoológica Lilloana, 49 (1-2): 49-57. (enlace)
- Juri, M. D. (2007). Estudios ecológicos de la comunidad de aves en un gradiente urbano. Tesis doctoral, Facultad Ciencias Naturales e Instituto M. Lillo, Universidad Nacional de Tucumán, 276 pp. (enlace)
- Kiff, L. F., D. B. Peakall, M. L. Morrison, & S. R. Wilbur (1983). Eggshell thickness and DDE residue levels in vulture eggs. In Vulture Biology and Management (Wilbur & Jackson, Eds.). University of California Press, Los Angeles, CA, USA. pp. 440–458. (enlace)
- Kirk, D. A. (1988). Ecological separation of small Cathartid vultures in South America. Ph.D. dissertation, University of Glasgow, Glasgow, Scotland. (enlace)
- Kirk, D. A., & J. E. P. Currall (1994). Habitat associations of migrant and resident vultures in central Venezuela. Journal of Avian Biology 25:327–337. (enlace)
- Kirk, D. A., & A. G. Gosler (1994). Body condition varies with migration and competition in migrant and resident South American vultures. Auk 111:931–942. (enlace)
- Klimaitis, J. F. & F. N. Moschione (1986) Cartilla sistemática de las aves de la Reserva Integral de selva subtropical marginal de Punta Lara y sus alrededores (Provincia de Buenos Aires). (enlace)
- Klimaitis, J.F. & F. N. Moschione (1987) Aves de la Reserva Integral de Selva Marginal de Punta Lara y sus alrededores. Minist. Eco. Prov. Bs. Aires.
- Kovacs, C., O. Kovacs, Z. Kovacs & C. M. Kovacs (2005). Manual ilustrado de las aves de la patagonia, Antártica Argentina e islas del Atlántico Sur; 368 pp. El Bolsón
- Krabbe, N. (2000). Comparación entre ambientes con distintos tipos de intervención. P.N. Calilegua y alrededores. Inf. Inéd. APN-DRNO. (S.I.B.)
- Krauczuk, E. R., & Baldo, J. D. (2004). Contribuição para o conhecimento da avifauna de um fragmento de floresta com araucária em Misiones, Argentina. Atualidades Ornitológicas, 119(6). (enlace)
- Krauczuk, E. R. (2005). Aves do Inta-Campo Anexo ao Zaiman, e do Campus da Universidade Nacional de Misiones, Posadas, Misiones, Argentina. Atualidades Ornitológicas Nº 126: 1-22. (enlace)
- Lambertucci, S. A., Barbar, F., Cabrera, C., & Bertini, M. (2009). Comentarios sobre las aves de la Sierra de Pailemán, Río Negro, Argentina. Nuestras Aves, 54, 81-87. (enlace)
- Larochelle, J., J. Delson, & K. Schmidt-Nielsen (1982). Temperature regulation in the Black Vulture. Canadian Journal of Zoology 60:491–494. (abstract)
- Lemon, W. C. (1991). Foraging behavior of a guild of Neotropical vultures. Wilson Bull.. 103(4): 698–702. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Zopilote Negro (Coragyps atratus) (Bechstein, 1793). Recuperado el 19/01/2020 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=4FF7DE80F4192276
- Ligon, J. D. (1967). Relationships of the cathartid vultures. Occas. Pap. Mus. Zool. Univ. Mich. 651. (enlace)
- Lindsay, D. S., D. S. Zarlenga, H. R. Gamble, F. Al-Yaman, P. C. Smith, & B. L. Blagburn (1995). Isolation and characterization of Trichinella pseudospiralis Garkavi, 1972 from a Black Vulture (Coragyps atratus). Journal of Parasitology 81:920–923. (enlace)
- López Lanús, B. (1997). Inventario de las aves del Parque Nacional “Río Pilcomayo” Formosa, Argentina. Monografía Especial L.O.L.A. Nº 4, 76 págs. Bs.As.
- López-Lanús, B., Grilli, P., Di Giácomo, A. S., Coconier, E., & Banchs, R. (2008). Categorización de las Aves de la Argentina, según su estado de conservación. Informe de Aves Argentinas/AOP y la Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina.
- López-Lanús, B., A. Galimberti, C. Giarduz, H. Luna, M. Manassero, A. A. Pautasso, M. P. Ducommun, A. A. G. Saigo, P. Petracci, G. A. Marteleur & M. R. de la Peña (2013a). Inventario focal de fauna de las estancias El Estero, La Norma, El Matrero y La Elena en el sitio piloto San Javier: Santa Fe, Argentina. En pp. 135-169/277-306/331-347/507,511-513: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- López-Lanús, B., A. S. Di Giacomo, A. Azpiroz, P. Haynes, A. Galimberti, A. Keyel, A. Ocampo, R. Güller, R. Moller Jensen, M. Mattalia, H. Cardoso, C. Giarduz, G. Papini & A. G. Di Giacomo (2013b). Inventario focal de fauna de las estancias La Higuera, María Concepción, La Serena y Virocay en el sitio piloto Aguapey: Corrientes, Argentina. En pp. 179-223/277-293/307-319/331-347/490,494-506: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas Nº 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- López-Lanús, B. & P. Mencia (2017). Diversidad, abundancia y estado de conservación de las aves de los riachos Monte Lindo y Pilagá en el este de la provincia de Formosa, Argentina. Nótulas Faunísticas 228: 1-29. (enlace)
- Lovell, H. B. (1947). Black Vultures kill young pigs in Kentucky. Auk 64:131–132. (enlace)
- Lucero, M. M. (1983). Lista y distribución de aves y mamíferos de la provincia de Tucumán. Miscelánea No 75. Fund. M. Lillo. Tucumán. Págs. 61.
- Lucero, M. M., J. M. Chani, Z. J. Brandán, A. L. Echevarría & M. D. Juri (2002). Lista de aves de San Miguel de Tucumán y Yerba Buena. Acta Zool. Lilloana 46 (1 y 2): 131-135. (enlace)
- Lucero, M. M., Z. J. Brandán & J. M. Chani (2005). Composición y variación anual de la avifauna de los tres grandes parques urbanos de San Miguel de Tucumán (Tucumán, Argentina). Acta Zool. Lilloana 49 (1 y 2): 43-48.
- Lucero, F. (2013). Listado de las aves observadas en la Reserva Natural Municipal Articulada: Laguna Guanacache, Laguna del Toro y Bañados del Carau, provincia de San Juan y Laguna Seca y los Bañados del Tulumaya, provincia de Mendoza, Argentina. Nótulas Faunísticas (segunda serie), 137: 1-16. (enlace)
- Lucero, F. (2020). Primeras evidencias para especies y subespecies de aves en la Provincia de San Juan, Argentina. EcoRegistros Revista, 10 (8): 38-52. (enlace)
- Llanos, F., Failla, M., García. G., Giovine, P., Carbajal, M., Gonzaléz, P., Paz Barreto, D., Quillfeldt, P. & Masello, J. (2011). Birds from the endangered Monte, the Steppes and Coastal biomes of the province of Río Negro, northern Patagonia, Argentina. Check List and Authors. Journal of species list and distribution. (enlace)
- Maceda, J. J., M. Mero, H. Riesco & M. Dolsan (2001). Lista de las aves de la reserva Parque Luro, La Pampa. Rev. Fac. Agr. UNL La Pampa. Vol. 12 Nº 2: 47-59. (enlace)
- Mactavish, B. (1993). The autumn migration: August 1 to November 30-1992, Atlantic Provinces region. American Birds 47:55–59. (enlace)
- Malizia, L. R., P. G. Blendinger, M. Eva Alvarez, L. O. Rivera, N. Politi & G. Nicolossi (2005). Bird communities in Andean premontane forests of Northwestern Argentina. Ornitología Neotropical 16: 231-251. (enlace)
- Mamaní, J. C., O. B. Quiroga, S. Aveldaño & T. G. Moreno Ten (2018). La avifauna de Yavi, provincia de Jujuy, Argentina. Nótulas Faunísticas. Segunda Serie 245: 1-19. (enlace)
- Marateo, G., Povedano, H., & Alonso, J. (2009). Inventario de las aves del Parque Nacional El Palmar, Argentina. Cotinga, 31(1), 47-60. (enlace)
- Marchant, S. (1960). The breeding of some S.W. Ecuadorian birds. Ibis 102(2):349–382. (enlace)
- Marelli, C.A. (1933) Aves observadas en el sur de la provincia de Buenos Aires. Hornero 5: 193-199. (enlace)
- Marigliano, N. L., C. M. Antelo, Z. J. Brandán Fernández & C. I. Navarro (2017). Avifauna asociada a sectores de bosques ribereños con modificaciones antropogénicas (Tucumán, Argentina). III. Composición y cambios estacionales del ensamble. Acta Zoológica Lilloana. 61 (1): 15-26. (enlace)
- Marone, L. (1992). Estatus de residencia y categorización trófica de las especies de aves en la Reserva de la Biosfera de Ñacuñan, Mendoza. El Hornero 13: 207-210. (enlace)
- Márquez, J., Chébez, J. C., Flores, A., Haene, E. & Sánchez, E. (1991) Sistema de Áreas Naturales Protegidas de la Provincia de San Juan (República Argentina). (enlace)
- Márquez, J. (1999). Las áreas protegidas de la provincia de San Juan. Multequina, (8), 1-10. (enlace)
- Martínez Gamba, R. (2014). Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones, Argentina. Nótulas Faunísticas. Segunda Serie. 163: 1-10 (enlace)
- Masramón, D. O. de (1983). Lista de aves del nordeste de San Luis. Hornero extraordinario 77-87. (enlace)
- Matarasso, H. F. (2007). Checklist. Aves del Neuquén. (enlace)
- McHargue, L. A. (1977). Nesting of Turkey and Black Vultures in Panama. Wilson Bulletin 89:328–329. (enlace)
- McHargue, L.A. (1981). Black Vulture nesting, behaviour and growth. Auk. 98(1): 183–185. (enlace)
- McIlhenny, E. A. (1939). Feeding habits of Black Vulture. Auk 56:472–474. (enlace)
- McIlhenny, E. A. (1945). An unusual feeding habit of the Black Vulture. Auk 62:136–137. (enlace)
- Melo, M. A., A. F. Batisteli, R. Guillermo-Ferreira, & A. J. Piratelli (2018). “Wanted dead or alive:” Black Vultures (Coragyps atratus) feeding on a live Capybara (Hydrochoerus hydrochaeris). Ornitología Neotropical 29:91–93. (enlace)
- Mérida, E. & A. Bodrati (2006). Consideraciones sobre la conservación de los talares de barrancas del nordeste de Buenos Aires y descripción de las características de un relicto en Baradero. Pp.: 71-82, en: Mérida, E. & J.Athor (Editores). Talares bonaerenses y su conservación. Fundación de Historia Natural “Félix de Azara”. Buenos Aires. (enlace)
- Miatello, R., J. Baldo, M. Ordano, C. Rosacher & L. Biancucci (1999). Avifauna del Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala. Córdoba. Argentina. Secretaría de Agricultura, Ganadería y Recursos Renovables. Córdoba; 193 pp.
- Miatello, R. & Fernandez, F. (2015). Informe de comisión a la Reserva de la Defensa La Calera y relevamiento de Fauna Silvestre (S.I.B.)
- Monroe, B. L., Jr. (1968). A Distributional Survey of the Birds of Honduras. Ornithological Monographs 7. American Ornithologists’ Union, Washington, DC, USA. 458 pp. (enlace)
- Morici, A. (2012). Las aves del Área Natural Protegida “Dique Roggero” (Buenos Aires, Argentina). Biológica 15; 24-36. (enlace)
- Moschione, F. & L. Bishels (2005). Listado de las aves del Parque Provincial Loro Hablador, provincia del Chaco. Informe Técnico. Proyecto Elé/DFS. Secretaría de Ambiente y Desarrollo Sustentable de la Nación
- Moschione, F. N. & Segovia, J. (2005). Listado de las aves de la Reserva Natural Las Lancitas, Santa Bárbara, Jujuy. Informe técnico Proyecto Elé/DFS, Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F.N. & M. A. González (2007). Aves de la Reserva Natural General Pizarro. Departamento Anta, Provincia e Salta. Lista preliminar de la RN en formación, actualizada a marzo de 2007. Inf. Inéd. APN-DRNO.12 pp. (S.I.B.)
- Moschione, F., Spitznagel, O. & M. Gonzalez (2014). Lista de Aves de Salta (Birds Checklist). Ministerio de Cultura y Turismo de Salta. Argentina. 47 p. (enlace)
- Mouchard, A. (2017). Interacción agonística de un Águila mora (Geranoaetus melanoleucus) seguida de consumo de un Jote cabeza negra (Coragyps atratus). Nuestras Aves 62:31-32. (enlace)
- Mrosovsky, N. (1971). Black Vultures attack live turtle hatchlings. Auk 88:672–673. (enlace)
- Narosky, T. & L. M. Lozzia (1988). Aves de la Reserva El Bagual. Nuestras Aves 15: 7-9. (enlace)
- Narosky, T. & A. G. Di Giacomo (1993) Las aves de la provincia de Buenos Aires, distribución y estatus. Asoc. Orn. del Plata. Vazquez Mazzini Editores, L.O.L.A., Buenos Aires
- Narosky, T., & Chebez, J. C. (2002) Guía para la identificación de las aves de Iguazú. Buenos Aires: Vázquez Mazzini. 128 pp.
- Narosky, T. & D. Yzurieta (2010). Aves de Argentina y Uruguay: guía de identificación. (16ª Ed.). Vázquez Mazzini Editores, Argentina; 432 pp.
- Navarro, C. I., Z. J. Brandán, C. M. Antelo & N. L. Marigliano (2000). Avifauna invernal en una localidad del Bosque Chaqueño Serrano (Las Tipas, Tucumán, Argentina). Acta Zool. Lilloana 45 (2): 233-240.
- Navarro, C. I. & Marigliano, N. L. (2006). Avifauna otoño-invernal en un sector de bosque Chaqueño Serrano (Trancas, Tucumán, Argentina). Acta Zoológica Lilloana, 50 (1-2): 55-60. (enlace)
- Navarro, C., Brandán, Z. J. & Marigliano, N. L. (2007). Lista comentada de las aves de un fragmento de la Reserva Provincial La Florida, Tucumán. Acta Zoológica Lilloana, 51 (2): 142-150. (enlace)
- Navas, J. R. (1982). Introducción a la avifauna del Parque Nacional El Palmar. Anales P. Nac. XV: 35-64
- Nellar Ramonella, M. M. (1993). Aves de la provincia de San Luis. Lista y distribución. Ed. Mus. Priv. Cienc. Nat. e Inv. Ornit. “G. E. Hudson”. San Luis. Págs. 98.
- Ng, D., & B. D. Jasperson (1984). Interspecific allopreening between Crested Caracara and Black Vultures. Condor 86:214–215. (enlace)
- Nores, M., D. Yzurieta & R. Miatello (1983). Lista y distribución de las aves de Córdoba, Argentina. Boletín de la Academia Nacional de Ciencias de Córdoba. 56: 1-96.
- Nores, M., D. Yzurieta & S. A. Salvador (1991). Lista y distribución de las aves de Santiago del Estero, Argentina. Bol. Acad. Nac. Cs.Córdoba, 59: 157-196. (enlace)
- Olivera, D. (2008-2011). Relevamiento de Aves Reserva Senderos del Monte de la Familia Powell, Departamento de Gualeguaychú, Provincia de Entre Ríos Argentina. avesargentinas.org.ar (enlace)
- Olivera, L. R. (2015) Reflejos en las aguas del Moconá. Naturaleza e Historia del Parque Provincial Moconá, su entorno y su gente. (1º Ed.) C.A.B.A. Fundación de Historia Natural Félix de Azara. 184 pp.
- Olrog, C. C. (1959) Las Aves Argentinas. Una Guía de campo. Universidad Nacional de Tucumán. Instituto “Miguel Lillo”. Tucumán. Argentina. 343 pp.
- Olrog, C. C. (1979). Nueva Lista de la Avifauna Argentina. Ministerio de Cultura y Educación-Fundación Miguel Lillo Tucumán, Argentina. Opera Lilloana, XXVII:58 (enlace)
- Olson, S. L., H. Loftin, & J. Wiese (1967). Observations on the behavior of Black and Turkey Vultures at traps and in captivity. Bird-Banding 38:75–76. (enlace)
- Ordano, M. (1993). Composicion y Estructura de una Comunidad de Aves Altoserranas (Cordoba), entre 1800 y 1900m Durante un Ciclo Anual. Tesina de Grado. Catedra de Zoologia II, FCEF y N, UNC. 52Pp (S.I.B.)
- Ordano, M. (1996). Estudio de una comunidad de aves altoserrana (Córdoba, Argentina) durante un ciclo anual. Rev. Asc. Cienc. Nat. Litoral 27 (2): 83-94. (enlace)
- Ordano, M., A. Bortoluzzi, M. Chatellenaz & L. Biancucci (2008). Respuesta a corto plazo de las aves a la quema y al pastoreo en pastizales del Parque Nacional Mburucuyá, Argentina. INSUGEO, Miscelánea, 17 (2): 425-446. (enlace)
- Ortiz, G. & F. Murúa (1994). Aves de ambientes acuáticos de la provincia de San Juan (Argentina). I. Multiquina, 3: 125-131. (enlace)
- Ortiz, D. & P. Capllonch (2007). Guía de los rapaces de la provincia de Tucumán. Tucumán, República Argentina. (enlace)
- Ortiz, D. & C. Ruiz (2011a). Migración y estacionalidad de aves en el arroyo Mista, Tucumán, Argentina. Nuestras Aves 56: 16-18. (enlace)
- Ortiz, D., R. Aráoz & C. Aldetere (2011b). Lista sistemática de las aves de la reserva experimental Horco molle, provincia de Tucumán, Argentina. Nótulas Faunísticas. Segunda Serie. No 62: 1-5. (enlace)
- Ortiz, D. & R. Aráoz (2014). Aves de la Sierra de San Javier. Universidad Nacional de Tucumán.
- Ortiz, S. G., H. A. Gómez, R. V. Blanco Fager, L. Videla & E. Godoy Luna (2016a). Aves de las diferentes ecorregiones, San Juan, Argentina. En: Martínez Carretero E. (ed.). San Juan Ambiental. Pp. 494
- Ortiz, S. G., Fager, R. V. B., & Gómez, H. A. (2016b). San Juan, Argentina. Eduardo Martínez Carretero, 259. (enlace)
- Ortiz, D., E. Martínez Paster, J. P. Juliá & P. Quiroga (2018a). Lista de aves de la Reserva Privada San Pablo, provincia de Tucumán, Argentina. Nótulas Faunísticas. Segunda Serie 246: 1-8. (enlace)
- Ortiz, S. G., V. Blanco Fager, M. G. Cánovas, H. J. Villavicencio, L. Videla, A. Laspina & P. Asunto (2018b). Listado de las aves urbanas y periurbanas con límite rural en la ciudad de San Juan, Argentina. Nótulas Faunísticas 254: 1-7. (enlace)
- Pagano, L. G. & E. Mérida (2009) Aves del Parque Costero del Sur. Pp. 200–244, en: Athor J. (de) Parque Costero del Sur. Naturaleza, conservación y patrimonio cultural. Fundación de Historia Natural Félix de Azara, Buenos Aires, Argentina. (enlace)
- Pagano, L. G., E. A. Jordan, J. I. Areta, R.F. Jensen & I. Roesler (2012). Aves de la Reserva Natural Punta Lara. En 97-143: Roesler, I. y M.G. Agostini (eds). Inventario de los Vertebrados de la Reserva Natural Punta Lara, provincia de Buenos Aires, Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas Nº 8. Buenos Aires, Argentina. (enlace)
- Pagano, L. G., & S. A. Salvador (2017). Datos de pesos de aves argentinas. Parte 4. Historia Natural 7:21–43. (enlace)
- Pardieck, K. L., D. J. Ziolkowski Jr., M. Lutmerding, V. I. Aponte, & M-A. R. Hudson (2020). North American Breeding Bird Survey Dataset 1966–2019: U.S. Geological Survey data release. https://doi.org/10.5066/P9J6QUF6 (enlace)
- Parker, P. G., T. A. Waite, & M. D. Decker (1995). Kinship and association in communally roosting Black Vultures. Animal Behaviour 49:395–401. (abstract)
- Parker III, T. A., & Goerck, J. M. (1997). The importance of national parks and biological reserves to bird conservation in the Atlantic forest region of Brazil. Ornithological Monographs, 527-541. (enlace)
- Parmalee, P. W. (1954). The vultures, their movements, exonomic status and control in Texas. Auk. 71(4): 443–453. (enlace)
- Parmalee, P. W. & Parmalee, B. (1967). Results of banding studies of Black Vultures in eastern North America. Condor. 69(2): 146–155. (enlace)
- Parrott, G. C. (1970). Aerodynamics of gliding flight of a Black Vulture Coragyps atratus. Journal of Experimental Biology 53:363–374. (enlace)
- Partridge, W. H. (1953). Observaciones sobre aves de las provincias de Córdoba y San Luis. Hornero 10: 23-73. (enlace)
- Pastore, H. (1994). Lista de aves observadas en el Parque Nacional Los Alerces, 1994. (S.I.B.)
- Paz Barreto, D. (1990). Lista sistemática de aves observadas en la reserva de fauna de punta Bermeja. Prov. de Rio Negro. Dirección de Planificación Ambiental, Provincia de Rio Negro. Banco de datos AOP: PRION 218
- Paz Barreto, D. (1996). Aves de la provincia de Rio Negro. Lista y bibliografía. Consejo de Ecología y Medio Ambiente, deleg. S.C. de Bariloche. (S.I.B.)
- Paz Barreto, D. (1997). Aves de la Provincia de Río Negro. II Localidades confirmadas. Consejo de Ecología y Medio Ambiente, Delegación Bariloche. Pp. 1-24. (enlace)
- Paz Barreto D. (2018). Registro de Aves del Parque Nacional Laguna Blanca de 1951 a 2018. Informe Técnico Parque Nacional Laguna Blanca, Administración de Parques Nacionales, Zapala, Neuquén. 25 pp. (enlace)
- Pennycuick C. J. (1973). The soaring flight of vultures. In Scientific American: 38-45. (enlace)
- Pennycuick, C. J. (1983). Thermal soaring compared in three dissimilar tropical bird species, Fregata magnificens, Pelecanus occidentalis and Coragyps atratus. Journal of Experimental Biology 102:307–325. (enlace)
- Perellano, M. & Basti, A. (1981). Lista de fauna observada en la Seccional Perito Moreno, Parque Nacional Nahuel Huapi. (S.I.B.)
- Pereyra, J. A. (1927). Notas ornitológicas. Pichón de Cuervo (Cathartes atratus brasiliensis). Hornero 4: 80. (enlace)
- Pereyra, J. A. (1937a). Aves nuevas para la provincia de Buenos Aires. Hornero 6: 438-439. (enlace)
- Pereyra, J. A. (1937b). Contribución al estudio y observaciones ornitológicas de la zona norte de la Gobernación de La Pampa. Mem. Jard. Zool. La Plata. Tomo 7: 197-326
- Pereyra, J. A. (1945). Las aves del territorio del Neuquén. An. Mus. de la Pat. Perito “Francisco P. Moreno”, Adm. Prq. Nac., Argentina. T. I, pags. 61-99. Lam. I-VIII
- Pereyra, J. A. (1950a). Avifauna argentina. Hornero 009 (02): 178-241. (enlace)
- Pereyra, J. A. (1950b). Las aves del territorio de Misiones. Anal. Mus. Nahuel Huapi Pto. F. P. Moreno 1-40. Buenos Aires
- Pereira, J. & N. Fracassi (1999). Registro de observación de especies. Parque Nacional El Rey. Inf. inéd. APN-DRNO. 4 pp. (S.I.B.)
- Pérez, C. H. F. & P. Petracci (1998). Notas sobre la avifauna de la cuenca media y superior del Río Negro, Provincia de Río Negro, Argentina. X RAO: 38.
- Perovic, P.G., De Bustos, S., Tálamo, A., Trucco, C. & D. Vázquez (2000). Informe Final del Relevamiento de Flora y Fauna en el Parque Nacional Calilegua y alrededores, Jujuy, Argentina. Monitoring and Modelling the Impacts of Changing Governments Policies on Biodiversity Conservation in the Andes. Proyecto Bioandes. First Annual Report.Unión Europea. 34 pp. (S.I.B.)
- Petracci, P. F., K. J. V. Delhey, C. H. F. Pérez, D. Basanta, M. V. Massola, M. Zamorano & M. Fosatti (2004). Nuevos aportes al conocimiento de la distribución y anidación de algunas especies de aves en la Argentina. Nuestras Aves 48: 25-31. (enlace)
- Piacentini, H., D. Paz Barreto, & A. Wucusich (2003). Registro de Fauna zona de Reserva Cinco Chañares págs. 369-386, en Bajo del Gualicho, una planicie patagónica bajo el nivel del mar-Realidad y leyenda. Coord. R. F. Massera y J. C. Guarido. Secretaría de Estado de Acción Social de Río Negro 2003, págs. 1-416. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Zopilote negro (Coragyps atratus) (Bechstein, 1793); Recuperado de https://www.xeno-canto.org/species/Coragyps-atratus, el 19/01/2020
- Prather, I. D., R. N. Conner, & C. S. Adkisson (1976). Unusually large vulture roost in Virginia. Wilson Bulletin 88:667–668. (enlace)
- Presti, P. M. & A. L. Echevarría (2009). El ensamble de aves en un relicto de selva pedemontana: Parque Percy Hill (Yerba Buena, Tucumán, Argentina). Acta Zoológica Lilloana, 53 (1-2): 64-76. (enlace)
- Prins, T. G., Reuter, J. H., Debrot, A. O., Wattel, J. & Nijman, V. (2009). Checklist of the birds of Aruba, Curaçao and Bonaire, south Caribbean. Ardea. 97(2): 137–268. (enlace)
- Pugnali, G. & P. Chamorro (2008). Lista de aves de la Reserva Costanera Sur. Aves Argentinas. Buenos Aires. (enlace)
- Pujalte, J. C., A. R. Reca, A. Balabusic, P. Canevari, L. Cusato & V. P. Fleming (1995). Unidades ecológicas del Parque Nacional Río Pilcomayo. Anales de Parques Nacionales 16: 1-185. (enlace)
- Pütz, C. C., Basso, M., de los Llanos, E. R., & Kufner, M. (2012). La fauna chaqueña de Córdoba (Argentina) afectada por la transformacion agricola. Ecología Aplicada, 11(1-2), 77-87. (enlace)
- Quiroga, O. B., Aveldaño, W. S., Mamaní, J. C., Martínez-Pastur, E. & Moreno-Ten, Th. (2020). Notas sobre veintidos especies de aves del noroeste argentino. Nótulas Faunísticas- Segunda Serie, 285:1-7. (enlace)
- Rabenold, P. P. (1986). Family associations in communally roosting Black Vultures. Auk 103(1): 32–41. (enlace)
- Rabenold, P. P. (1987a). Recruitment to food in Black Vultures: evidence for following from communal roosts. Animal Behaviour 35: 1775–1785. (abtract)
- Rabenold, P. P. (1987b). Roost attendance and aggression in Black Vultures. Auk 104(3): 647–653. (enlace)
- Raffaele, H., Wiley, J., Garrido, O., Keith, A. & Raffaele, J. (2003). Birds of the West Indies. Published by Princeton University Press 41 William Street Princeton, New Jersey 08540; 216 pp.
- Ramilo, E. J., Chehébar, C. E. & Mazzucchelli, S. (1993). Plan General de Manejo. Parque Nacional Laguna Blanca. APN. (enlace)
- Rea, A. M. (1983). Cathartid affinities: a brief overview. In Vulture Biology and Management (S. R. Wilbur and J. A. Jackson, Editors). University of California Press, Los Angeles, CA, USA. pp. 26–54.
- Regidor, H.A., Acuña, E., Orce, H., Sosa, A. & S. Castrillo (2005). Relevamiento de la Biodiversidad en Pizarro, Departamento de Anta, Salta, y los efectos de los desmontes sobre la misma. IRNED – Instituto de Recursos Naturales y Ecodesarrollo. Universidad Nacional de Salta. 39 pp. (S.I.B.)
- Richardson, D. M. (1989). Close nesting of a Black Vulture and a Turkey Vulture. Wilson Bulletin 101:639–640. (enlace)
- Ricklefs, R. E. (1973). Patterns of growth in birds: II. Growth rate and mode of development. Ibis 115:177–201. DOI: 10.1111/j.1474-919X.1973.tb02636.x
- Ridgely, R.S. & Gwynne Jr., J.A. (1989). A Guide to the Birds of Panamá, with Costa Rica, Nicaragua, and Honduras (2º Ed.) Princeton University Press. 534 pp.
- Roads, K. M. (1936). Black Vultures kill and eat new-born lambs. Wilson Bulletin 48:219. (enlace)
- Robbins, M. B., & D. A. Easterla (1992). Birds of Missouri: Their Distribution and Abundance. University of Missouri Press, Columbia, MO, USA. Pp: 61-62
- Roda, M.A. & C.F. Danti (2015). Nuevos registros de aves para Saladillo, provincia de Buenos Aires. Nuestras Aves 60:32-38. (enlace)
- Rodríguez Graves, V., A. Pautasso, P. Preliasco, M. V. Del Sastre & F. Miñarro (2009). Relevamiento ambiental de la Estancia Isleta Linda. Provincia de Santa Fe. Fundación Vida Silvestre Argentina.
- Rodríguez, E. D. (2012). Aves del Cerro San Bernardo y de las Serranías del Este de la Ciudad de Salta. (1º Ed.) Salta: Fondo Editorial Secretaría de Cultura de la Provincia de Salta.
- Roesler, I. (2001). Nuevas citas de aves para al partido de General Villegas, provincia de Buenos Aires, Argentina. Nuestras Aves 41: 32-33. (enlace)
- Roesler, I. & Agostini, M.G. (2012). Inventario de los vertebrados de la Reserva Natural Punta Lara, provincia de Buenos Aires, Argentina. (enlace)
- Roig, V. G. (1965). Elenco sistemático de los mamíferos y aves de la provincia de Mendoza y notas sobre su distribución geográfica. Bol. de Estud. Geogr. 12 (49): 175-222. (enlace)
- Romiti, D. (1997). Avistajes de fauna. Parque Nacional Laguna Blanca. 5 pág. Nota 7, DRP, 3/04/1997. (S.I.B.)
- Rosso, P. (2002). Listado de aves observadas en la jurisdicción de la Seccional Río Arrayanes. Parque Nacional Los Alerces. (S.I.B.)
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J. & Calo, J. (1996). Inventario de las aves del Parque Nacional “Iguazú”, Misiones, Argentina. Monografía, (9); 68 pp.
- Salvador, S. A. (1990). Nidificación de rapaces argentinos (Falconiformes y Strigiformes). Nuestras aves 23: 28-29. (enlace)
- Salvador, S. A. (2014a). Peso de las aves del Departamento General San Martín, Córdoba, Argentina. Biológica 17: 48-57. (enlace)
- Salvador, S. A. & Salvador, L. A. (2014b). Aves de Villa María y del departamento General San Martín, Córdoba, Argentina. Xolmis, 36, 1-18. (enlace)
- Salvador, S. A. (2016a). Distribución reproductiva de las aves de Argentina y sus territorios. Recopilación inédita. Córdoba, Argentina. (enlace)
- Salvador, S. A. (2016b). Registros de depredadores de huevos, pichones y volantones de aves de Argentina. Acta Zoológica Lilloana 60. (enlace)
- Salvador, S. A., L. A. Salvador & C. Ferrari (2017). Aves de la provincia de Córdoba. Distribución e Historia Natural. Ed. DP. Argentina. SA.
- Sanzín, R. (1918). Lista de aves mendocinas. Hornero 1: 147-152. (enlace)
- Sarquis, J. A. (2018). Conservación de la avifauna de Entre Ríos (Argentina): uso de métodos biogeográficos y de optimización para evaluar la efectividad de las áreas protegidas. Tesis. Laboratorio de Biodiversidad y Conservación de tetrápodos, INALI-CONICET-UNL. (enlace)
- Saunders, A. A. (1906). The habits of the Black Vulture in Nicaragua. Bird-Lore 8:165–167. (enlace)
- Sazima, I. (2011). Black Vulture (Coragyps atratus): bath and drink. Revista Brasileira de Ornitologia 19:81–84. (enlace)
- Scherer-Neto, P. & Costa-Straube, F. (1995). Aves do Paraná: (história, lista anotada e bibliografia). Curitiba-Paraná: Ed. dos autores, Brasil; 117 pp. (enlace)
- Schulenberg, T. S., Stotz, D. F., Lane, D. F., O’Neill, J. P., Parker III, T. A. & A. Brack Egg (2010). Birds of Perú. Revised and Updated Edition ed. Princeton University Press; 664 pp.
- Segura, L. N., N. Bogado, C. A. Darrieu & D. Montalti (2014). La colección de huevos “Pablo Girard” del Museo de La Plata. Probiotica. FCN y M, UNLP, La Plata, Argentina, Serie Técnica y Didáctica 27: 1-14. (enlace)
- Seibold, I. & A. J. Helbig (1995). Evolutionary history of New and Old World vultures inferred from nucleotide sequences of the mitochondrial cytochrome b gene. Philosophical Transactions of the Royal Society of London B 350:163–178. https://doi.org/10.1098/rstb.1995.0150
- Serié, P. & C. H. Smyth (1923). Notas sobre aves de Santa Elena (E. Ríos). El Hornero. 003(01):037-055. (enlace)
- Serrano, G., Moreira, M., Natale, E., Monguillot, J. & R. Neira (2003). Informe Técnico. Registro ocacional de especies del Parque Nacional Sierra de Las Quijadas Nº 5. 3 pp.
- Sferco, G. D. & Nores, M. (2003). Lista comentada de las aves de la Reserva Natural Chancaní, Córdoba, Argentina. El Hornero, 18(1), 21-29. (enlace)
- Sibley, C. G. & J. E. Ahlquist (1990). Phylogeny and Classification of Birds: A Study in Molecular Evolution. Yale University Press, New Haven, CT, USA; 976 pp. https://doi.org/10.2307/j.ctt1xp3v3r
- Siegenthaler, G., E. Fiorucci, S. Tiranti, P. Borraz, M. Urioste & A. García (1990). Informe de avance del plan de relevamiento de los vertebrados de la provincia de La Pampa. Agro Pampeano. Ministerio de Asuntos Agrarios de La Pampa. 18: 38-49.
- Siegenthaler, G. B. (Coord.) (2004). Relevamiento de los vertebrados de la provincia de La Pampa. Inventario integrado de los recursos naturales de la provincia de La Pampa. Clima, geomorfología, suelo, vegetación y fauna de vertebrados. Reedición. INTA.UNLP. Gobierno de La Pampa, CD, multimedia. (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Uma Introdução. Universidad de Brasília, Brasília, Brazil.
- Silva, C. & R. S. Carmo (2015). Comportamento allopreening entre urubu-de-cabeça-preta (Coragyps atratus) e caracará (Caracara plancus) no nordeste Brasileiro. Atualidades Ornitológicas 184:22. (enlace)
- Skutch, A. F. (1969). Notes on the possible migration and the nesting of the Black Vulture in Central America. Auk 86:726–731 (enlace)
- Slud, P. (1964). The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History 128:1–430. (enlace)
- Smyth, C. H. (1927). Descripción de una colección de huevos de aves argentinas. El Hornero. 004(01):001-016. (enlace)
- Sosa, H. J. (1995). Actualización de la lista de avifauna de la Reserva Provincial Laguna Llancanelo, Malargüe, Mendoza. Presencia estacional, preferencia de hábitats y nidificación. Multequina, (4), 65-75. (enlace)
- Sosa, H. J. (1999). Descripción del evento reproductivo del Flamenco austral (Phoenicopterus chilensis) en Laguna Llancanelo, Malargüe, Mendoza. Multequina 8: 87-99. (enlace)
- Sosa, M. & Mutt Coll, M. S. (2001). Aves de San Martín de los Andes y sus alrededores. Planilla de registro. 2001. (S.I.B.)
- Souto, H. N., A. G. Franchin, & O. M. Júnior (2009). New record of allopreening between Black Vultures (Coragyps atratus) and Crested Caracara (Caracara plancus). Sociobiology 53:1–5. (enlace)
- Sprunt, A., Jr. (1946). Predation on living prey by the Black Vulture. Auk 63:260–261. (enlace)
- Stager, K. E. (1964). The role of olfaction in food location by the Turkey Vulture (Cathartes aura). Los Angeles County Museum Contributions in Science 81:1–63. (enlace)
- Stempelmann, H. & F. Schulz (1890). Enumeración de las aves de la provincia de Córdoba. (República Argentina). Bol. Acad. Nac. Cienc. Córdoba 10: 393-409
- Steullet, A. B. & E. A. Deautier (1935). Catálogo sistemático de las aves de la República Argentina. Obra del Centenario del Museo de La Plata. Unv. Nac. de La Plata. Buenos Aires: Imprenta y Casa Editora «Coni». Tomo 1 (1º entrega): 1-256.
- Steullet, A. B. & Deautier, E. A. (1936). Catálogo sistemático de las aves de la República Argentina. Obra del Cincuentenario del Museo de La Plata. Unv. Nac. de La Plata. Buenos Aires: Imprenta y Casa Editora «Coni». Tomo 1 (1º entrega): 1: 257- 492
- Stewart, P. A. (1974). A nesting of Black Vultures. Auk 91(3): 595–600. (enlace)
- Stewart, P. A. (1978). Behavioral interactions and niche separation in Black and Turkey Vultures. Living Bird 17: 79–84. (enlace)
- Stewart, P. A. (1983). Adoption of introduced young and neglect of own by nesting Black Vultures. Wilson Bulletin 95:310–311. (enlace)
- Stewart, P. A. (1984). Population decline of Black Vultures in North Carolina. Chat 48:65–68. (enlace)
- Stiles, F. G., & A. F. Skutch (1989). A Guide to the Birds of Costa Rica. Christopher Helm, London, UK.
- Stolen, E. D. (1996a). Black and Turkey Vulture interactions with Bald Eagles in Florida. Florida Field Naturalist 24:43–45. (enlace)
- Stolen, E. D. (1996b). Roosting behavior and foraging ecology of Black Vultures in central Florida. M.S. thesis, University of Central Florida, Orlando, FL, USA.
- Stolen, E. D. (2000). Foraging behavior of vultures in central Florida. Florida Field Naturalist, 28(4), 173-181. (enlace)
- Stolen, E. D. & Taylor, W. K. (2003). Movements of black vultures between communal roosts in Florida. The Wilson Journal of Ornithology, 115(3), 316-320. (enlace)
- Stotz, D. F., Fitzpatrick, J. W., Parker III, T. A. & Moskovits, D. K. (1996). Neotropical birds: ecology and conservation. University of Chicago Press.
- Stresemann, E. & D. Amadon (1979). Order Falconiformes. In Check-list of birds of the world (Mayr & Cottrell, Eds.). Vol:1. Museum of Comparative Zoology, Cambridge, MA, USA. pp. 271–425. (enlace)
- Sweeney, T. M. (1984). Black and Turkey Vulture roost dynamics, marking, morphology and nesting in Virginia. Master’s Thesis, Virginia Polytechnic Inst. and State Univ., Blacksburg, VA. (enlace)
- Sweeney, T. M., J. D. Fraser & J. S. Coleman (1985). Further evaluation of marking methods for Black and Turkey Vultures. Journal of Field Ornithology 56:251–257. (enlace)
- Sweeney, T. M. & J. D. Fraser (1986). Vulture roost dynamics and monitoring techniques in southwest Virginia. Wildlife Society Bulletin 14:49–54. (enlace)
- Tagliarini, M. M., C. Y. Nagamachi, J. C. Pieczarka & E. H. C. de Oliveira (2007). Description of two new karyotypes and cytotaxonomic considerations on Falconiformes. Revista Brasileira de Ornitologia 15:261–266. (enlace)
- Tate, Jr., J. (1986). The blue list for 1986. American Birds 40:227-236. (enlace)
- Tejerina, P., M. J. Turnes & S. L. Tiranti (2006). Aves. En: Salomone, F. y N. Gouts. (eds.). Los vertebrados de las áreas protegidas de la provincia de La Pampa. Ed. Santa Rosa, La Pampa, Argentina. (enlace)
- Teulings, R. P. (1975). Southern atlantic coast region. American Birds 29 (1):40-43. (enlace)
- Thompson, W. L., R. H. Yahner, & G. L. Storm (1990). Winter use and habitat characteristics of vulture communal roosts. Journal of Wildlife Management 54:77–83. (enlace)
- Thurber, W. A. (1981). Aerial «play» of Black Vultures. Wilson Bulletin 93:97. (enlace)
- Torres, R. & P. Michelutti (2001). Las aves de ambientes acuáticos del sistema Laguna Mar Chiquita – Bañados del Río Dulce (provincias de Córdoba y Santiago del Estero, Argentina. Bol. Acad. Nac. Cienc. Córdoba 66: 61-73. (enlace)
- Torres, T. F., A. Ríos, E. Schiappacasse, M. Mañez, J. Beruhard & R. Morales (2019). Relevamiento de fauna para la puesta en valor de la Reserva Natural de usos multiples del Cóndor, departamento Pocho, Córdoba, Argentina. Nótulas Faunísticas 265: 1-10. (enlace)
- Travaini, A., A. Rodríguez, O. Ceballos, J. A. Donázar & F. Hidalgo (1995). Roadside raptor surveys in central Argentina. Hornero 14: 64-66. (enlace)
- Trejo, A. & Seijas, S. (2003) . An estimation of road mortality of birds in Nahuel Huapi National Park, northwestern Argentine Patagonia. El Hornero, 018(02), 097-101. (enlace)
- Vallely, A. C. & Dyer, D. (2018). Birds of Central America. Published by Princeton University Press, 41 William Street, Princeton, New Jersey 08540; 570 pp.
- Vera, A. S. (2002). Lista de aves de San Miguel de Tucumán y Yerba Buena. Acta zoológica lilloana, 46(1), 131-135. (enlace)
- Vickery, P. D. (1982). The Autumn migration: August 1–November 30 1981, Northeastern Maritime region. American Birds 36:152–155. (enlace)
- Vides Almonacid, R. (1991). La alteración del boque de Yungas en Tucumán, Argentina y el uso de las aves como indicadores ecológicos para el diseño de zonas de amortiguamiento en áreas protegidas. Tesis Maestría Sc. Programa de Maestría de Manejo de Vida Silvestre para Mesoamérica y el Caribe, Universidad de Costa Rica; 210 pp. (S.I.B.)
- Vides Almonacid, R. (1992). Estudio comparativo de las taxocenosis de aves de los bosques montanos de Sierra de San Javier, Tucumán, Argentina. Bases para su manejo y conservación- Tesis doctoral, Facultad de Ca. Naturales, Universidad Nacional de Tucumán, Argentina; 347 pp.
- Vidoz, F. (1993). Informe de observaciones de avifauna en el Parque Nacional Lago Puelo, en el período julio 1992 y abril 1993. Nota de la DRP Nro. 5 del 17/5/93; 8 pp. (S.I.B.)
- Vidoz, F. (1995). Informe del reconocimiento del valle del río Puelo realizado entre los días 24 y 27 de noviembre de 1994. Nota 49/95 del PN Lago Puelo; 6 pp. y 1 mapa. (S.I.B.)
- Vidoz, F., Berardi, M. & E. Anderson (2011). Informe de Patrulla, Zona Limítrofe Los Hitos Sur – Arroyo Melo, en Parque Nacional Lago Puelo. (S.I.B.)
- von Berlepsch, H. (1908). On the birds of Cayenne, 2. Novitates Zoologicae 15:261–324. (enlace)
- Vuilleumier, F. (1985). Forest birds of Patagonia: ecological geography, speciation, endemism, and faunal history. Ornithological Monographs, 255-304. (enlace)
- Wallace, M. P., P. G. Parker & S. A. Temple (1980). An evaluation of patagial markers for cathartid vultures. Journal of Field Ornithology 51:309–314. (enlace)
- Wallace, M. P. & S. A. Temple (1987). Competitive interactions within and between species in a guild of avian scavengers. Auk 104:290–295. (enlace)
- Ward, P. & A. Zahavi (1973). The importance of certain assemblages of birds as «information centres» for food finding. Ibis 115:517–534. (enlace)
- Wells, J. V. & Wells, A. Ch. (2017). Birds of Aruba, Bonaire, and Curaçao. (1º Ed.). COMSTOCK PUBLISHING ASSOCIATES a division of Cornell University Press Ithaca and London; 474 pp.
- Wetmore, A. (1926). Observations on the birds of Argentina, Paraguay, Uruguay and Chile. United States Nat. Mus. Bull. 133: 1-448. (enlace)
- Wetmore, A. (1956). A checklist of the fossil and prehistoric birds of North America and the West Indies. Smithsonian Miscellaneous Collections 131:1–105. (enlace)
- Wetmore, A. (1962). Systematic notes concerned with the avifauna of Panamá. Smithsonian Miscellaneous Collections 145:1–14. (enlace)
- Wetmore, A. (1965). The Birds of the Republic of Panama. Volume 1. Tinamidae (Tinamous) to Rynchopidae (Skimmers). Smithsonian Miscellaneous Collections 150. Smithsonian Institution, Washington, DC, USA; 483 pp. (157) (enlace)
- Wieczorek, J. (2007). Observation records for Parques. (S.I.B.)
- Wilson, A. S. (1926). Lista de aves del sur de Santa Fe. Hornero 3: 349-362. (enlace)
- Wink, M. (1995). Phylogeny of Old and New World vultures (Aves: Accipitridae and Cathartidae) inferred from nucleotide sequences of the mitochondrial cytochrome b gene. Zeitschrift fuer Naturforschung C 50:868–882. (enlace)
- Wright, A. L., R. H. Yahner & G. L. Storm (1986). Roost-tree characteristics and abundance of wintering vultures at a communal roost in south central Pennsylvania. Raptor Research 20:102–107. (enlace)
- Yahner, R.H., G.L. Storm & A.L. Wright (1986). Winter diets of vultures in southcentral Pennsylvania. Wilson Bulletin 98:157-160. (enlace)
- Yahner, R. H., G. L. Storm & W. L. Thompson (1990). Winter diets of vultures in Pennsylvania and Maryland. Wilson Bulletin 102:320–325. (enlace)
- Yee, D. G., S. F. Bailey & D. Fix (1994). The autumn migration: August 1-November 30 1993. Middle Pacific Coast region. American Birds 48:147–151. (enlace)
- Yepes, J. (1939). Contribución al conocimiento de la Biocenosis del Oeste de la Gobernación del Neuquén. Revista del centro de estudios del doctorado en ciencias Naturales, 2 (5): 65-81. (enlace)
- Yorio P. & Bertelloti, M. (2007). (En A. S. Di Giacomo (editor). Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 340-341. Temas de Naturaleza y Conservación 5. Aves Argentinas/Asociación Ornitológica del Plata. Buenos Aires. (enlace)
- Yzurieta, D. (1995). Manual de reconocimiento y evaluación ecológica de las aves de Córdoba. Ministerio de Agricultura, Ganadería y Recursos Renovables. Córdoba
- Zanotti, M. (2014). Coragyps atratus (Bechstein, 1783). www.ecoregistros.org./61145
- Zapata, A. R. P. (1998a). Contribución al estudio de la avifauna de la región de la Laguna Chasicó, partido de Villarino, provincia de Buenos Aires (Doctoral dissertation, Universidad Nacional de La Plata). (enlace)
- Zapata, A. R. P. (1998b). Aves registradas en la región de la laguna Chasicó, sudoeste de la provincia de Buenos Aires. Natura Neotropicalis 29 (2): 156-161. (enlace)
- Zapata, A. R. P. (2002). Nueva cita sobre la nidificación y crías del Jote cabeza negra (Coragyps atratus) para la provincia de Buenos Aires, Argentina. Nuestras Aves 44: 14-15. (enlace)
-
Jote cabeza negra | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR
Contaldi y colaboradores, concluyen, que con una población total estimada en 20 millones de individuos, se sabe que hoy sus poblaciones extremas se encuentran en proceso de expansión como consecuencia del impacto de la actividad antrópica en el ambiente a nivel local (mayor oferta de alimento y disminución en la persecución) o global (mayores temperaturas producto del cambio climático) (Contaldi et al., 2019:8)
Esta especie tiene un rango extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). La tendencia de la población parece estable, por esto esta especie no alcanza los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población es extremadamente grande, por lo tanto esta especie no se aproxima a los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como de “preocupación menor” (Stotz, 1996:142).
En Argentina (S.I.B.):
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable ). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas ).Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable ).Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza ). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Arasarí fajado | Bibliografía
- Administración de Parques Nacionales. S.I.B. Ficha: Pteroglossus castanotis. Recuperado de https://sib.gob.ar/especies/pteroglossus-castanotis el 2/01/2021
- ArgentAvis (s.f.) Ficha: Arasarí fajado (Pteroglossus castanotis). Recuperado el 12/02/2021 de http://argentavis.com.ar/2012/sitio/especie_co.php?id=612
- Asociación Armonía (s.f.) Birds of Bolivia. Ficha: Pteroglossus castanotis. Recuperado el 12/01/2021 de https://birdsofbolivia.org/species-fact-sheets-2/toucans/pteroglossus-castanotis/
- Barnett, J.M. & Pearman, M. (2001). Lista Comentada de las Aves Argentinas (1º Ed.). Lynx Edicions. Barcelona.
- Bates, J.M., M.C. Garvin, D.C. Schmitt, & C.G. Schmitt (1989). Notes on bird distribution in northeastern Dpto. Santa Cruz, Bolivia, with 15 species new to Bolivia. Bulletin of the British Ornithologists’ Club 109:236–244. (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178 (4):369–636. (enlace)
- Berlepsch, H. von (1889). Systematisches Verzeichness der von Herrn Gustav Garlepp in Brasilien und Nord-Peru im Gebiete das oberen amazonas gesammelten Vogelbälge. Journal of Ornithology. 87: 289-321. (enlace)
- Bertoni, A. de W. (1901). Aves Nuevas del Paraguay. Continuación a Azara. Anales Cient. Paraguayos, (1) 1: 1-214. (enlace)
- BirdLife International (2021) Species factsheet: Pteroglossus castanotis. Downloaded from http://www.birdlife.org on 14/01/2021.
- Bodrati, A. (2006) Yabotikaba: El Arbol frutal de la selva misionera. Naturaleza y Conservación 18: 10-15. Revista de Aves Argentinas/Asociación Ornitológica del Plata (enlace)
- Bodrati, A., K. Cockle, J.M. Segovia, I. Roesler, J.I. Areta & E. Jordán. (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga 32: 41-64. (enlace)
- Bodrati, A. & Salvador, S.A. (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Historia Natural. Tercera Serie Volumen 5 (1): 77-89. (enlace)
- Brooks, T.M., Barnes, R., Bartrina, L., Butchart, S.H.M., Clay, R.P., Esquivel, E.Z., Etcheverry, N.I., Lowen, J.C. & Vincent, J. (1993). Bird Surveys and Conservation in the Paraguayan Atlantic Forest: Project CANOPY ’92 Final Report. BirdLife Study Report 57. BirdLife International, Cambridge. (enlace)
- Chapman, F.M. (1917) The distribution of bird-life in Colombia: a contribution to a biological survey of South America. Bulletin of the American Museum of Natural History 36: 1–729. (enlace)
- Chapman, F.M. (1921) «The distribution of bird life in the Urubamba Valley of Peru. A report on the birds collected by the Yale University-National Geographic Society’s Expeditions.» Bulletin of the United States National Museum. 1–138, 3 figs, 9 pls. https://doi.org/10.5479/si.03629236.117.1 (enlace)
- Chapman, F.M. (1926). The distribution of bird-life in Ecuador: a contribution to a study of the origin of Andean bird-life. Bulletin of the American Museum of Natural History. 55: 1–784. (enlace)
- Chebez, J.C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5. Págs. 320. Ed. L.O.L.A. Bs.Aires
- Chébez, J.C. (2009). Otros que se van. Editorial Albatros, Buenos Aires, pp. 1.
- Cockle, K., Martin, K., & Wiebe, K. (2008). Availability of cavities for nesting birds in the Atlantic forest, Argentina. Ornitologia Neotropical, 19(Supplement), 269-278. (enlace)
- Cockle, K.L., Bodrati, A., Lammertink, M., Bonaparte, E.B., Ferreyra, C., & Di Sallo, F.G. (2016). Predators of bird nests in the Atlantic forest of Argentina and Paraguay. The Wilson Journal of Ornithology, 128(1), 120-131. (enlace)
- Contreras J.R., Agnolin F., Davies Y.E., Godoy I., Giacchino A. & Ríos E. (2014) Atlas Ornitogeográfico de la Provincia de Formosa, República Argentina: I No-passeriformes. (1º Ed.) Vázquez Mazzini Editores; Fundación de Historia Natural Félix de Azara, C.A.B.A. Argentina; 450 pp.
- Cory, C.B. (1919). Catalogue of Birds of the Americas. Publications of the Field Museum of Natural History, Zoological Series 13(2). 608 pp. (enlace)
- Cziulik, M. (2006) Comportamento reprodutivo do Araçari-castanho Pteroglossus castanotis (Gould, 1834) (Piciformes, Ramphastidae) em cativeiro: nidifacaçao e cuidado com filhotes (enlace)
- Cziulik, M., Z.S. Cubas & C. Dejuste (1998) Reprodução do araçari-castanho Pteroglossus castanotis (Goldi, 1834) Ramphastidae, no Parque das Aves Foz. Tropicana, Foz do Iguaçu, Paraná. Em: An. XXII Congresso Brasileiro de Zoológicos e IV Encontro Internacional de Zoológicos. Salvador.
- Dabbene, R. (1929) Los tucanes de la República Argentina. Hornero 004 (03) : 265-271 (enlace)
- de la Fuente Muñoz (2016) Los tucanes (6). Aviornis Internacional. Nº 147: 62-8 (enlace)
- de la Peña, M.R. (1999). Aves argentinas. Lista y distribución. L.O.L.A (Literature of Latin America), Buenos Aires
- de la Peña, M.R. (2015). Aves Argentinas (1º Ed.); Santa Fé. Ediciones UNL; CABA: EUDEBA. Vol. 1:376
- de la Peña, M.R. & Salvador, S. (2016) Aves Argentinas: Descripción, Comportamiento, Reproducción y Distribución. Trogonidae a Furnariidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Vol.20 (2):1-620.
- del Hoyo, J. (2020) All The Birds of the World. Lynx Editions, Barcelona. 966 pp.
- Di Giácomo, A.G. (2005). Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 181-203. Temas de Naturaleza y Conservación 5. Aves Argentinas/ Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- EcoRegistros; Ficha: Arasarí fajado (Pteroglossus castanotis Gould, 1834). Recuperado el 12/01/2021 de http://www.ecoregistros.org/ficha/Pteroglossus-castanotis
- Foster, R.B., Carr, J.L. & Forsyth. (1994). The Tambopata-Candamo Reserved Zone of Southeastern Perú: a Biological Assessment. Rapid Assessment Program Working Papers 6. Conservation International, Washington, D.C.
- Fraga, R.M. (2011). Giant cowbird (Molothrus oryzivorus) parasitism of red-rumped caciques (Cacicus haemorrhous) in the atlantic forest, northeastern Argentina. The Wilson Journal of Ornithology, 123(2), 277-282.
- Giraudo, A.R. & Sironi, M. (1992). Registro de Pteroglossus castanotis australis (Cassin, 1867) y de Baillonius bailloni (Viellot, 1819) (Aves: Ramphastidae) en el noreste de la provincia de Corrientes, República Argentina. Not. Faun. 25: 1-2.
- Gorleri, F. & A.G. Di Giácomo (2002). Lista sistemática de las aves de la Reserva de la Biósfera Laguna Oca del Río Paraguay, Formosa. Reunión Argentina de Ornitología (enlace)
- Gorleri, F., M.C. Gorleri. & M. Murdoch (2011). Aves de la Reserva de Biosfera Laguna Oca, Formosa, Argentina. Universidad Nacional de Formosa/SPU Programa de Voluntariado Universitario. Ideas Gráficas. Formosa.
- Griscom, L. & Greenway, J.C. (1937). Critical notes on new Neotropical birds. Bulletin of the Museum of Comparative Zoology. 81: 416-437. (enlace)
- Guilherme, E & de Melo Dantas, S. (2011) Avifauna of the Upper Purus River, State of Acre, Brazil. Revista Brasileira de Ornitologia, 19(2), 185‐199 (enlace)
- Hackett, S.J. & Lehn, C.A. (1997). Lack of genetic divergence in a genus (Pteroglossus) of Neotropical birds: the connection between life-history characteristics and levels of genetic divergence. Pp. 267-279 in: Remsen (1997). (enlace)
- Hayes, F.E. (1995) Status, distribution and biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, Colorado. (enlace)
- Hellmayr, C.E. (1910). The Birds of the Rio Madeira. Novitates Zoologicae 17. 172 pp. (enlace)
- Hornbuckle, J. (1999). The birds of Abra Patricia and the upper Río Mayo, San Martín, north Peru. Cotinga. 12: 11–28. (enlace)
- H.N. María & Olivares, A. (1967). Adiciones a la avifauna colombiana, IV (Apodidae-Picidae). Hornero 010 (04) : 403-435 (enlace)
- Krauczuk, E.R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Christi, San Ignacio, Misiones, Argentina. Lundiana, 9(1), 29-39. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Ficha: Arasarí caripardo (Pteroglossus castanotis, Gould 1834). Recuperado el 12/01/2021 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=766425133B13A871
- Meyer de Schauensee, R. (1949). The Birds of the Republic of Colombia. Segunda Entrega, Accipitridae-Picidae. Caldasia 5. 264 pp. (enlace)
- Martínez Gamba, R. (2014). Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones,Argentina. Nótulas Faunísticas. Segunda Serie. 163: 1-10 (enlace)
- Narosky, T. & Chébez, J.C. (2002). Aves de Iguazú: guía para la identificación. (1º Ed.). Buenos Aires: Vázquez Mazzini Editores; 128 pp.
- Narosky, T., & Yzurieta, D. (2010). Aves de Argentina y Uruguay. Guía de identificación (16.a Ed.). Buenos Aires. Vázquez Mazzini Editores.
- Naumburg, E.M.B. (1930). The Birds of Mato Grosso, Brazil. A Report on the Birds Secured by the Roosevelt-Rondon Expedition. Bulletin of the American Museum of Natural History 60, New York. 432 pp. (enlace)
- Novaes, F.C. (1957). Contribuição à ornitología do noroeste de Acre. Bol. Mus. Paraense Emílio Goeldi (Zool.). 9: 1–30. (enlace)
- Olivera, L.R. (2015) Reflejos en las aguas del moconá: naturaleza e historia del Parque Provincial Moconá, su entorno y su gente (1º Ed.) CABA: Fundación de Historia Natural Félix de Azara; 184 pp
- Olrog, C.Ch. (1959). Las Aves Argentinas. Una Guía de Campo. (1º ed.) Universidad Nacional de Tucumán. Instituto «Miguel Lillo».
- Parker, T. A., III & B. Bailey (Editors) (1991) A biological assessment of the Alto Madidi region and ajacent areas of northwest Bolivia, May 18-June 15, 1990. Rapid Assessment Program Working Papers 1. Conservation International, Washington, D.C (enlace)
- Parker, T.A. & Goerck, J.M. (1997). The importance of national parks and biological reserves to bird conservation in the Atlantic Forest region of Brazil. Pp. 527–541 en: Remsen (1997). (enlace)
- Patel S., J.D. Weckstein, J.S.L. Patané, J.M. Bates & A. Aleixo (2011) Temporal and spatial diversification of Pteroglossus araçaris (Aves: Ramphastidae) in the neotropics: Constant rate of diversification does not support an increase in radiation during the Pleistocene. Molecular Phylogenetics and Evolution, 58: 105–115. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Ficha: Arasarí caripardo (Pteroglossus castanotis, Gould 1834). Recuperado el 12/01/2021 de https://www.xeno-canto.org/species/Pteroglossus-castanotis
- Pearman, M. (1993). The avifauna of the Río Machariapo dry forest, northern La Paz department, Bolivia: a preliminary investigation. Bird Conservation International 3(2):105–117. (enlace)
- Pereyra Coimbra R., Reichelt V., Cantaluppi A. & Chatellenaz M. (2017) Nuevo registro de Arasarí fajado (Pteroglossus castanotis) en la Provincia de Corrientes, Argentina. Nótulas Faunísticas Segunda Serie, 215 (2017): 1-4 (enlace)
- Remsen, J.V. & Parker, T.A. (1983). Contribution of river-created habitats to bird species richness in Amazonia. Biotropica. 15: 223–231. (enlace)
- Remsen, J.V., Hyde, M.A. & Chapman, A. (1993). The diets of Neotropical trogons, motmots, barbets and toucans. Condor. 95(1): 178–192. (enlace)
- Remsen J.V. Jr., J.I. Areta, C.D. Cadena, A. Jaramill, M. Nores, J.F. Pacheco, J. Pérez-Emáan, M.B. Robbins, F.G. Stiles, D.F. Stotz & K.J. Zimmer (2017). A classification of the bird species of South America. American Ornithologists’ Union. (enlace)
- Robinson, S.K., & J. Terborgh (1997) Bird community dynamics along primary successional gradients of an Amazonian whitewater river. Pages 641–672 in Neotropical ornithology honoring Ted Parker (J. V. Remsen, Jr.). Ornithological Monographs 48 (enlace)
- Robinson, S.K. (1985). Coloniality in the Yellow-rumped Cacique as a defense against nest predators. Auk. 102(3): 506–519. (enlace)
- Robinson, S.K. (1997). Birds of a Peruvian oxbow lake: populations, resources, predation, and social behavior. Pp. 613–639 in: Remsen (1997). (enlace)
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J., & Calo, J. (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina (1º Ed.). L.O.L.A. (Literature of Latin America).
- SACC. (2006). A classification of the bird species of South America. Available at: #http://www.museum.lsu.edu/~Remsen/SACCBaseline.html#.
- Scherer-Neto, P., & Straube, F.C. (1995). Aves do Paraná: história, lista anotada e bibliografia. Curitiba: Ed. dos autores. (enlace)
- Short, L.L. (1975) A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History 154: 165–352. (enlace)
- Short, L.L. (2020). Chestnut-eared Aracari (Pteroglossus castanotis), version 1.0. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, and E. de Juana, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.cheara1.01
- Sick, H. (1979). Ornitologia brasileira. Editora Nova Fronteira, Rio de Janeiro
- Stager, K.E. (1961). The Machris Brazilian expedition. Ornithology: Non-Passerines. Contrib. Sci. Los Angeles Co. Mus.. 41: 1–27. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A. & Moskovits, D.K. (1996). Neotropical Birds, Ecology and Conservation. University of Chicago Press, Chicago & London.
- Traylor, M.A. (1952). Notes on birds from the Marcapata Valley, Cuzco, Peru. Fieldiana Zool.. 34: 17-23. (enlace)
- Willis, E.O. (1976). Effects of a cold wave on an Amazonian avifauna in the upper Paraguay drainage, western Mato Grosso, and suggestions on Oscine-Suboscine relationships. Acta Amazonica 6(3): 379-394. (enlace)
- Willis, E.O. & Oniki, Y. (1990). Levantamento preliminar das aves de inverno em dez áreas do sudoeste de Mato Grosso, Brasil. Ararajuba. 1: 19–38. (enlace)
-
Arasarí fajado | Descripción
Corona negra con centro castaño hasta la nuca. Los lados de la cabeza y zona superior de la garganta castaños con garganta inferior negra. Frente, parte anterior del cuello y pecho superior negros. Pico de base amplia con línea basal y lados naranja-amarillenta, mandíbula principalmente negra, maxilar con culmen con amplia franja triangular negra. Iris blanco.
Piel alrededor de los ojos gris-azulada (de la Peña & Salvador, 2016:42)
Dorso y cola verdes pardos con rabadilla y franja en el abdomen rojas. Zonas inferiores amarillas con una banda en zona inferior del pecho de color roja o roja-castaña oscura.
Patas castañas-verdosas a castañas-negruzcas. Alas pardas (Short, 2020; Dabbene, 1929:269)
Hembra: más castaña desde la coronilla hasta la nuca y parte superior de la garganta. Pico más corto.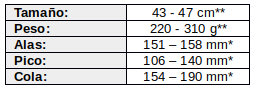
(* Hellmayr, 1910:397) (** Short, 2020) 
© Bernard Dupont. Chestnut-eared Araçari (Pteroglossus castanotis). Pouso Alegre, Transpantaneira, Poconé, Mato Grosso, BRAZIL. 6 de Julio 2016. Algunos derechos reservados 
© Bernard Dupont. Chestnut-eared Araçari (Pteroglossus castanotis) Pouso Alegre, Transpantaneira, Poconé, Mato Grosso, BRAZIL. 1 agosto 2019. Algunos derechos reservados -
Arasarí fajado | Taxonomía
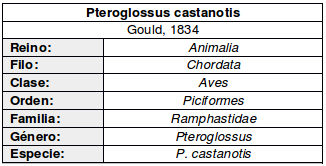
El género Pteroglossus (Aves: Ramphastidae) comprende 10 especies de tucanes de tamaño pequeño a mediano, esbeltos y coloridos, que se distribuyen desde el sur de México y a través de Centroamérica, hasta la Selva Atlántica de Brasil y el nordeste de Argentina (Remsen et al., 2017; BirdLife International, 2017).
Los datos genéticos indican que las especies actuales, P. aracari y P. pluricinctus forman un grupo monofilético perteneciente al grupo P. torquatus (Hackett, S.J. & Lehn, 1997:267; Patel et al., 2011:108).
Se reconocen dos subespeciesSubespecies y Distribución
- P. c. castanotis (Gould, 1834) – Sur y Este de Colombia y Oeste de Brasil, Sur a Sureste de Perú y en Brasil en la cuenca del Amazonas.
- P. c. australis (Cassin, 1867) – Norte y Centro de Brasil, Sur de Amazonas, Norte de Bolivia, Este de Paraguay, Noreste de Argentina (Misiones, Noreste de Corrientes y Este de Formosa) y Sureste de Brasil (Minas Gerais, Sao Pablo, Paraná y Norte de Rio Grande do Sul)
-
Carpintero garganta estriada | Bibliografía
- Administración de Parques Nacionales. Sistema de Información de Biodiversidad. Argentina. (s.f.) Ficha: Dryocopus lineatus (Linneus, 1766). Recuperado de https://sib.gob.ar/especies/dryocopus-lineatus el 20/10/2020
- Anjos, L. & Schuchmann, K.L. (1997). Biogeographical affinities of the avifauna of the Tibagi River Basin, Paraná drainage system, southern Brazil. Ecotropica 3(1): 43–65. (enlace)
- Askins, R.A. (1983). Foraging ecology of temperate-zone and tropical woodpeckers. Ecology 64: 945-956. (enlace)
- Athanas N., P.J. Greenfield, I. Campbell, P. Cervantes Daza, A.Spencer & S. Woods (2016) Birds of Western Ecuador: A Photographic Guide. Princeton University Press, 2016: 220
- Barnett, J.M. & Pearman, M. (2001). Lista Comentada de las Aves Argentinas (1º Ed.). Lynx Edicions. Barcelona
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178(4):369–636. (enlace)
- Benz, B.W., M.B. Robbins, & A.T. Peterson. (2006). Evolutionary history of woodpeckers and allies (Aves: Picidae): placing key taxa on the phylogenetic tree. Molecular Phylogenetics and Evolution 40: 389-399. (enlace)
- Binford, L.C. (1989). A Distributional Survey of the Birds of the Mexican State of Oaxaca. Ornithological Monographs 43. American Ornithologists’ Union. Washington, D.C. (enlace)
- BirdLife International (2020) Species factsheet: Hylatomus lineatus. Downloaded from http://www.birdlife.org on 31/10/2020.
- Bodrati, A., Cockle, K., Segovia, J.M., Roesler, I., Areta, J. I. & Jordan, E. (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga 32: 41–64. (enlace)
- Bodrati, A., J.I. Areta & E. White. (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves 57: 63-80. (enlace)
- Brooks, D.M. (2000). New distributional records for birds in the Paraguayan Chaco. Cotinga. 13: 77–78. (enlace)
- Brooks, T.M., Barnes, R., Bartrina, L., Butchart, S.H.M., Clay, R.P., Esquivel, E.Z., Etcheverry, N.I., Lowen, J.C. & Vincent, J. (1993). Bird Surveys and Conservation in the Paraguayan Atlantic Forest: Project CANOPY ’92 Final Report. BirdLife Study Report 57. BirdLife International, Cambridge. (enlace)
- Burgos, F.G., J.L. Baldo & F. M. Cornell. (2009). Lista de las aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. S. S. de Jujuy (enlace)
- Camperi, A.R., & Darrieu, C.A. (2001). Estudio de una colección de aves del sur de la provincia de Misiones, República Argentina. Physis, 134-135.
- Capllonch, P., Lobo, R., Ortiz, D. & R. Ovejero. (2005). La avifauna de la selva de galería en el noreste de Corrientes, Argentina: Biodiversidad, patrones distribución y migración. Insugeo, Miscelánea, 14: 483-498. (enlace)
- Capper, D.R., Clay, R.P., Madroño, A., Mazar Barnett, J., Burfield, E.J., Esquivel, E.Z., Kennedy, C.P., Perrens, M. and Pople, R.G. (2001). First records, noteworthy observations and new distributional data for birds in Paraguay. Bull. Brit. Orn. Club. 121(1): 23-37. (enlace)
- Capper, D.R., Esquivel, E.Z., Pople, R.G., Burfield, I.J., Clay, R.P., Kennedy, C.P. & Mazar Barnett, J. (2000). Surveys and recommendations for the management of Aguará Ñu in the Reserva Natural del Bosque Mbaracayú, eastern Paraguay. (enlace)
- Chatellenaz, M.L. (2005). Aves del Valle del Río Paraná en la provincia del Chaco, Argentina: riqueza, historia natural y conservación. Miscelánea, 14, 528. (enlace)
- Chébez, J.C. (1996). Fauna Misionera, Catálogo Sistemático y Zoogeográfico de los vertebrados de la Provincia de Misiones (Argentina) (1º Ed.). Editorial L.O.L.A. (Literature of Latin American): 139,140
- Cockle, K., Martin, K. & K. Wiebe. (2008). Availability of cavities for nesting birds in the Atlantic Forest, Argentina. Ornitología Neotropical 19 (Suppl.): 269-278. (enlace)
- Cockle, K., K. Martin & K. Wiebe. (2011). Selection of Nest Trees by Cavity-nesting Birds in the Neotropical Atlantic Forest. Biotrópica 43: 228-236. (enlace)
- Coconier, E. G., López Lanús, B., Roesler, I., Moschione, F., Pearman, M., Blendinger, P., Bodrati, A., Monteleone, D., Casañas, H., Pugnali, G. & M. E. Alvarez. (2007). Lista comentada de las aves silvestres de la unidad de gestión Acambuco. Pp: 32-103. En Coconier, E. G. (Ed.). Las aves silvestres de Acambuco, Provincia de Salta, Argentina. Temas de Nat. y Cons. No 6. Nuestras Aves A.O.P. (enlace)
- Cohn-Haft, M., Whittaker, A. & Stouffer, P.C. (1997). A new look at the “species-poor” central Amazon: the avifauna north of Manaus, Brazil. Pp. 205–235 in: Remsen (1997). (enlace)
- Contreras, J.R. (1981). Lista preliminar de la avifauna correntina. I. No Passeriformes. Historia Natural 2: 21-28.
- Contreras, J.R. (1987). Lista preliminar de la avifauna de la provincia de Formosa, República Argentina. Historia Natural VII (4): 33-52
- Contreras, J.R., Berry, L.M., Contreras, A.O., Bertonatti, C.C. & Utges, E.E. (1990). Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Vol. 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1.
- Contreras, J.R. (1993). Acerca de algunas especies de aves del extremo sudeste de la provincia de Formosa, República Argentina. Nótulas Faunísticas, 47, 1-8. (enlace)
- Contreras, J.R., F. Agnolin, Y.E. Davies, I. Godoy, A. Giacchino & E. Ríos. (2014). Atlas ornitogeográfico de la provincia de Formosa, República Argentina. (1º Ed.) Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 p. (enlace)
- De la Peña, M.R. (1999). Aves Argentinas. Lista y Distribución (1º Ed.). Editorial L.O.L.A. (Literature of Latin America).
- De la Peña, M.R. (2015). Aves Argentinas (Vol.1). EUDEBA, UNL.
- De la Peña M.R. & Salvador S. (2016). Aves Argentinas: Descripción, comportamiento, Reproducción y Distribución. Trogonidae a Furnariidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), 20(2), 620. (enlace)
- del Hoyo, J. (2020) All The Birds Of The World. Lynx Edicions. Barcelona: 343
- Di Giacomo, A.G. (2005). Aves de la Reserva «El Bagual». En Di Giacomo, A. G. y S. F. Krapovickas (Eds.). Historia natural y paisaje de la Reserva «El Bagual», provincia de Formosa, Argentina. Inventario de la fauna de vertebrados y de la flora vascular de un área del Chaco Húmedo. Temas de Naturaleza y Conservación 4: 201-465. Aves Argentinas/AOP. Buenos Aires. (enlace)
- Figueiredo, L.F.A. & Lo, V.K. (2000). Lista das aves do município de São Paulo. Bol. CEO. 14: 15–35. (enlace)
- Giraudo, A.R., A. Bortoluzzi & V. Arzamendia. (2006). Vertebrados tetrápodos de la reserva y sitio ramsar “Esteros del Iberá” (Corrientes, Argentina): análisis de su composición y nuevos registros para especies amenazadas. Natura Neotropicalis, 37 (1-2): 1-20. (enlace)
- Goerck, J.M. (1999). Distribution of birds along an elevational gradient in the Atlantic forest of Brazil: implications for the conservation of endemic and endangered species. Bird Conservation International. 9(3): 235–253. (enlace)
- Graber, R.R. (1954). The Lineated Woodpecker. Wilson Bulletin 66: 5. (enlace)
- Hayes, F.E. (1995) Status, distribution and biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, Colorado. (enlace)
- Hayes, F.E. & Samad, I. (1998). Diversity, abundance and seasonality of birds in a Caribbean pine plantation and native broad-leaved forest of Trinidad, West Indies. Bird Conservation International. 8(1): 67–87. (enlace)
- Heisler, D.A. (1994). Costa Rican woodpecker abundances and habitat use in a fragmented landscape. Bull. Ecol. Soc. Amer. 75(2)(Suppl.): 92. (Abstract).
- Hernández, B.E., Peterson, A.T., Navarro, A.G. & Escalante, P. (1995). Bird faunas of the humid montane forests of Mesoamerica: biogeographic patterns and priorities for conservation. Bird Conservation International. 5(2/3): 251-277. (enlace)
- Hilty, S.L. (1997) Seasonal distribution of birds at a cloud forest locality, the Anchicayá Valley, in western Colombia. Pages 321–344 in Studies in Neotropical ornithology honoring Ted Parker (J. V. Remsen, Jr.). Ornithological Monographs 48. (enlace)
- Hilty, S. (2003) Birds of Venezuela (2º Ed.) Course Book ed. Princeton University Press, 2002: 471
- Kilham, L. & O’Brien, P. (1979). Early breeding behavior of Lineated Woodpeckers. Condor. 81(3): 299-303. (enlace)
- Krauczuk, E.R. (2005). Aves do Inta-Campo Anexo ao Zaiman, e do Campus da Universidade Nacional de Misiones, Posadas, Misiones, Argentina. Atualidades Ornitológicas No 126: 1-22 (enlace)
- Krauczuk, E.R. (2008-2009). Riqueza específica, abundancia y ambientes de las aves de Corpus Chriti, San Ignacio, Misiones, Argentina. Lundiana 9 (1): 21-31. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Dryocopus lineatus (Linnaeus, 1766) Recuperado de https://avibase.bsc-eoc.org/species.jsp?avibaseid=3CD8FECCC54D40ED el 20/10/2020)
- López Lanús, B. (1997). Inventario de las aves del Parque Nacional “Río Pilcomayo” Formosa, Argentina. Monografía Especial L.O.L.A. No 4, 76 págs. Bs.As.
- López-Lanús, B., A.S. Di Giacomo, A. Azpiroz, P. Haynes, A. Galimberti, A. Keyel, A. Ocampo, R. Güller, R. Moller Jensen, M. Mattalia, H. Cardoso, C. Giarduz, G. Papini & A. G. Di Giacomo. (2013). Inventario focal de fauna de las estancias La Higuera, María Concepción, La Serena y Virocay en el sitio piloto Aguapey: Corrientes, Argentina. En pp. 179-223/277-293/307-319/331-347/490,494-506: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- Malekan, I.S. (2020). Lineated Woodpecker (Dryocopus lineatus), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.linwoo1.01
- Marini, M.Â. (2001). Effects of forest fragmentation on birds of the Cerrado Region, Brazil. Bird Conservation International. 11(1): 13-25. (enlace)
- Martínez Gamba, R. (2014). Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones, Argentina. Nótulas Faunísticas. Segunda Serie. 163: 1-10. (enlace)
- Maurício, G.N. & Dias, R.A. (1998). Range extensions and new records for forest birds in southern Rio Grande do Sul, Brazil. Bulletin of the British Ornithologists’ Club 118(1): 14–25. (enlace)
- Mayr, E. & Short, L.L. (1970). Species Taxa of North American Birds. A Contribution to Comparative Systematics. Publications of the Nuttall Ornithological Club 9. Cambridge, Masschusetts. 127 pp. (enlace)
- Melo-Júnior, T.A. (2001). Bird species distribution and conservation in Serra do Cipó, Minas Gerais, Brazil. Bird Conservation International. 11(3): 189-204. (enlace)
- Mischler, T. (2012). Status, abundance, seasonality, breeding evidence and an updated list of the birds of Cerro Blanco, Guayaquil, Ecuador. Cotinga. 34: 60–72. (enlace)
- Monroe, B.L. Jr. (1968). A Distributional Survey of the Birds of Honduras. Ornithological Monographs 7. American Ornithologists’ Union, Washington, D.C. 458 pp. (enlace)
- Moschione, F., O. Spitznagel & M. González. (2013). Lista de aves de Salta. Gobierno de la Provincia de Salta. (enlace)
- Narosky, T., & Chébez, J.C. (2002). Guía para la Identificación de las Aves de Iguazú. (1º Ed.). Vazquez Mazzini Editores.
- Narosky, T., & Yzurieta, D. (2010). Aves de Argentina y Uruguay. Guía de identificación (16.a Ed.). Vázquez Mazzini Editores.
- Nores, M. & D. Yzurieta. (1985). Nuevas localidades para aves Argentinas. Parte VI. Historia Natural 5 (7): 55-56.
- Parker, T.A. & Goerck, J.M. (1997). The importance of national parks and biological reserves to bird conservation in the Atlantic Forest region of Brazil. Pp. 527–541 in: Remsen (1997). (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Picamaderos listado · Dryocopus lineatus · (Linnaeus, 1766) Recuperado de https://www.xeno-canto.org/species/Dryocopus-lineatus el 20/10/2020
- Pople, R.G., Burfield, I.J., Clay, R.P., Cope, D.R., Kennedy, C.P., López Lanús, B., & Warren, B. (1997). Project Ortalis’ 96: interesting and important results of bird surveys in western Ecuador. (enlace)
- Rangel Olivera, L. (2015) Reflejos en la aguas del Moconá: naturaleza e historia del Parque Provincial Moconá, su entorno y su gente. (1º Ed.) CABA: Fundación de Historia Natural Félix de Azara; 184 pp
- Robinson, S.K. & J. Terborgh (1997) Bird community dynamics along primary successional gradients of an Amazonian whitewater river. Pages 641–672 in Neotropical ornithology honoring Ted Parker (J. V. Remsen, Jr.). Ornithological Monographs 48. (enlace)
- Robinson, S.K. (1997). Birds of a Peruvian oxbow lake: populations, resources, predation, and social behavior. Pp. 613–639 in: Remsen (1997). (enlace)
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J., & Calo, J. (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina (1º Ed.). L.O.L.A. (Literature of Latin America).
- Schulenberg, D., F. Stotz, D.F. Lane, J.P. O’Neill, T. A. Parker III, A. Brack Egg (2010) Birds of Perú. Revised and Updated Edition. Princeton University Press, 2010: 288
- Short, L.L. (1970). Notes on the habits of some Argentine and Peruvian woodpeckers (Aves, Picidae). American Museum Novitates number 2413. American Museum of Natural History, New York, New York. (enlace)
- Short, L.L. (1971). Aves nuevas o poco comunes de Corrientes. Rev. Mus. Argent. Cienc. Nat.“Bernardino Rivadavia” Inst. Nac. Invest. Cienc. Nat. Zool, 9, 283-309. (enlace)
- Short, L.L. (1975) A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History 154: 165–352. (enlace)
- Sick, H. (1997) Ornitologia Brasileira. Editora Nova Fronteira. Rio de Janeiro, Brasil :515
- Skutch, A.F. (1969). Life Histories of Central American Birds. III. Pacific Coast Avifauna 35. Cooper Ornithological Society, Berkeley, California. 580 pp. (enlace)
- Slud, P. (1964) The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History 128: 1–430. (enlace)
- Stager, K.E. (1961). The Machris Brazilian expedition. Ornithology: Non-Passerines. Contrib. Sci. Los Angeles Co. Mus.. 41: 1–27. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A., & Moskovits, D.K. (1996). Neotropical Birds, Ecology and Conservation (1º Ed.). University of Chicago Press, Ltd.,London: pp:198,199 y 329
- Stotz, D.F., Lanyon, S.M., Schulenberg, T.S., Willard, D.E., Peterson, A.T. & Fitzpatrick, J.W. (1997). An avifaunal survey of two tropical forest localities on the middle Rio Jiparaná, Rondônia, Brazil. Pp. 763–781 in: Remsen (1997). (enlace)
- Straneck, R. (1990). Canto de las aves de Misiones I. Ed. L.O.L.A. Buenos Aires; 21
- Vallely, A.C. & Dyer D. (2018) Birds of Central America: Belize, Guatemala, Honduras, El Salvador, Nicaragua, Costa Rica, and Panama. Princeton University Press: 174
- Wetmore, A. (1968). The Birds of the Republic of Panama. Part 2. Columbidae (Pigeons) to Picidae (Woodpeckers). Smithsonian Miscellaneous Collections 150. Smithsonian Institution, Washington, D.C. 605 pp. (enlace)
- White, E.W. (1882). Notes on birds collected in the Argentine Republic. Proc. Zool. Soc. London, 591-629. (enlace)
-
Carpintero garganta estriada | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR.Bastante común. No se ha cuantificado la población mundial pero se ha sugerido el rango de 5 a 50 millones de individuos. Su número parece estar aumentando en muchas áreas. La preferencia por los hábitats abiertos significa que se beneficia de la deforestación ya que sobrevive bien en áreas degradadas. No se conocen amenazas. (del Hoyo et al. 2020).
En vista de su amplia distribución y alta abundancia relativa, el estado de conservación del Carpintero garganta estriada está clasificado como de preocupación menor por la Lista Roja de Especies Amenazadas de la UICN (BirdLife International 2020)En Argentina
- No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable ).López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
- No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas ).Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
- No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable ).Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
-
Carpintero garganta estriada | Distribución
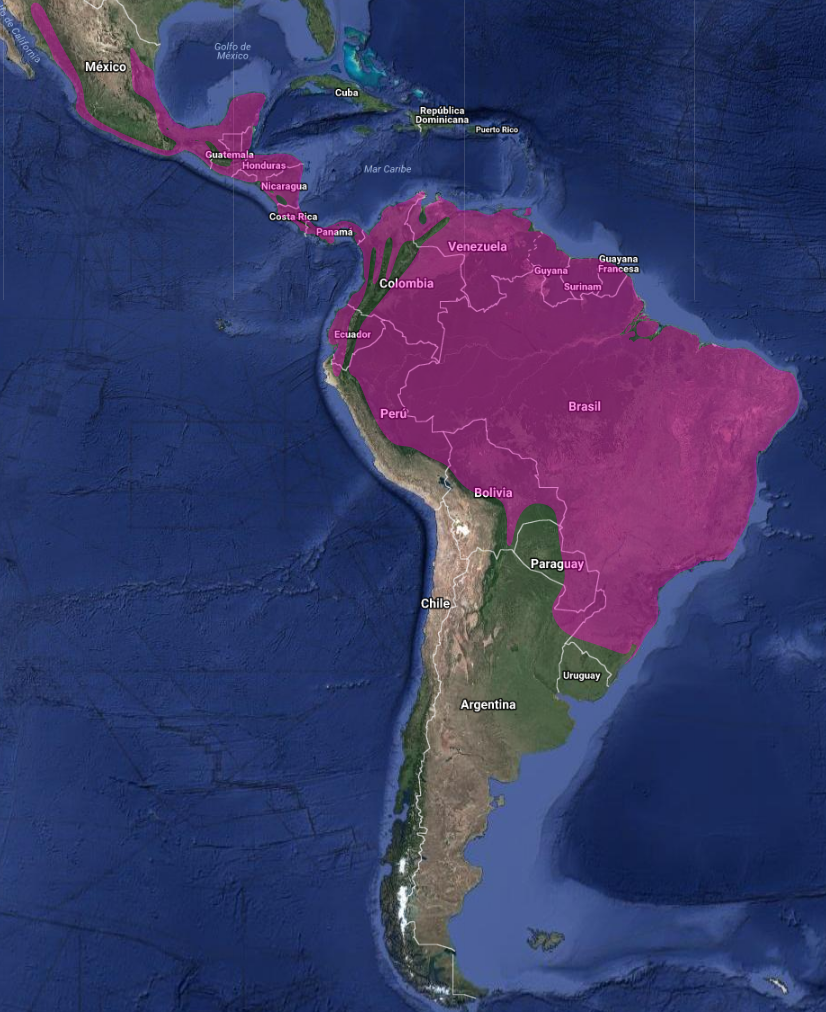
InfoNatura: Animals and Ecosystems of Latin America 2007 Endémico de las Américas. Extensa área de distribución desde Méjico al Norte de Argentina. (Short, 1975:251,252); (Skutch, 1969:428) (Contreras et al., 2014:369)
Comprende: (Stotz et al, 1996:329)
Méjico, Estado Oaxaca (Binford, 1989:165)
Guatemala, (Hernández et al., 1995); (Askins, 1983); (Vallely & Dyer, 2018:174)
Belice, (Vallely & Dyer, 2018:174); (Lee Jones & Vallely, 2001:30)
Honduras, (Hernández et al., 1995); (Monroe, 1968:463); (Vallely & Dyer, 2018:174)
El Salvador, (Hernández et al., 1995); (Graber, 1954:5); (Vallely & Dyer, 2018:174)
Nicaragua, (Hernández et al., 1995); (Vallely & Dyer, 2018:174)
Costa Rica, (Heisler, 1994); (Hernández et al., 1995); (Slud, 1964:189,190); (Vallely & Dyer, 2018:174)
Panamá, oeste (Hernández et al., 1995); (Slud, 1964:189,190); (Wetmore, 1968:546); (Kilham, 1972:28); (Vallely & Dyer, 2018:174)
Trinidad y Tobago, (Hayes & Samad, 1998:76)
Venezuela, hasta 1200 msnm. Maracaibo cuenca del Rio Zulia, noroeste del Estado deTáchira, y oeste de Mérida; pié de los Andes, desde Táchira norte a oeste del de Barinas; resto de Venezuela norte, norte del Orinoco incluyendo el Estado de Delta Amacuro; Todo Amazonas sur hasta Cerro de la Neblina (Cuenca norte del Amazonas); común en el Estado de Bolı́var (lineatus) (Hilty, 2003:471);
Guayana Francesa, Guyana, Surinam, (Short, 1975:251,252); (Skutch, 1969:428)
Colombia, (Hilty, 1997:337)
Ecuador, (Mischler, 2012:70); Pople et al., 1997); Oeste (Athanas et al., 2016:220)
Perú, Manu National Park, (Dto. Madre de Dios) (Robinson & Terborgh, 1997:665); (Robinson, 1997:637); Dto Huanuco (Short, 1970:6, 24); común en el Este, por encima de los 1.500 msnm (Schulenberg et al., 2010:288)
Bolivia, (Short, 1975:251,252); (Skutch, 1969:428)
Paraguay, Alto Chaco, Paraguay Central y Alto Paraná (Brooks et al., 1993, Brooks, 2000:77, Capper et al., 2000:31, Capper et al., 2001:24); (Hayes, 1995:69,103)
Brasil, Estados de Paraná (Anjos & Schchumman, 1997:59); (Belton, 1984:595); centro de Amazonas (Cohn-Haft et al, 1997:231); Sao Paulo (Figueiredo & Lo, 2000:24); Goerck, 1999:246); Minas Gerais (Marini, 2001:21, Melo-Junior, 2001:198); Rio Grande (Mauricio & Dias, 1998:19); Iguazú National Park (Parker & Goerck, 1997:535); Goiás central (Stager, 1961:25); Rondônia (Stotz et al., 1997:777)En Argentina: (De la Peña, 1999:109) (De la Peña & Salvador, 2016: 104,105)
Dryocopus lineatus erythrops (Valenciennes, 1826): En Misiones, Corrientes, Formosa y Chaco
Dryocopus lineatus lineatus (Linnaeus, 1766): En Salta y JujuySalta, (Coconier et al., 2007:63), una pareja registrada en cercanías del punto El Chorrito (22º10’15,9’’S 63º54’38,5’’W), el 6 de octubre de 2005 a 700 msnm. El ambiente donde fue observado estaba cubierto por muy pocos individuos de timbó (Enterolobium contortisiliquum) y ceibo (Erythrina crista-galli), con el sotobosque absolutamente desprovisto de vegetación, por lo que se formaba una sabana abierta. El área circundante estaba dominada por un bosque bajo de tipo chaqueño. Además existe un registro, del 25 de noviembre de 2005, en el punto Embalse Itiyuro (22º05’53’’S 63º44’06’’W), 700 msnm.
(Moschione et al., 2013:26), en la región de las Yungas, incluyendo pedemonte, chaco serrano húmedo y matorrales de altura húmedos. Difícil de observar, residente y nidificante
Jujuy, (Burgos et al., 2009:12), en las Yungas (selvas pedemontanas, selvas montanas, bosques montanos y pastizales de neblina: Parque Nacional Calilegua 23°47’S-64°45’ /23°35’S-64°54’W, Parque Provincial Potrero de Yala , (1650 msnm), 24°07’14.02”S-65°27’28.97”W. (Nores & Yzurieta, 1985 y Olrog, 1959:175), lo citan para la provincia
Misiones, Uranga (in litt.), citado en El Soberbio, (Dto. Guaraní), a 27°17′44″S 54°11′47″O, el 12-11-2010;
(Cockle et al., 2011:237), desde San Pedro, a 26º38′ S, 54º07′ W hasta Tobuna, a 26º27′ S, 53º54′ W, (Dto. de San Pedro), Parque Provincial Caá Yarı́, (Dto. Leandro N. Alem), a 26º52’S, 54º14′ W; Reserva de la Biosfera Yabotí, (Dtos de San Pedro y Guaranı́), a 26°37′00″S 53°40′00″O.
(Bodrati et al., 2010:58), Parque Provincial Cruce Caballero, a 26º31’S 54º00’ O (Dto San Pedro), residente, nidificante y común, tanto en selva primaria como secundaria
(Bodrati et al., 2012), Posada y Reserva Puerto Bemberg, (25 º55’S, 54 º37’O), en el sudoeste del departamento Iguazú, en la localidad de Puerto Libertad (antiguamente Puerto Bemberg). Escasa y residente
(Camperi & Darrieu, 2001), lo cita en su Estudio de una colección de aves del sur de la provincia de Misiones.
(Chebez, 1996:139-140), en Dtos de Iguazú, Gral Belgrano, San Javier, Eldorado, L.N. Alem, San Ignacio, Concepción, San Pedro, Oberá, Cainguás, Lib. Gral. San Martín, Guaraní, Capital y Montecarlo
(Cockle et al., 2008:271), en la Sierra Central, (Dto. de San Pedro), en Bosque Atlántico con laurel (Lauraceae), guatambú (Balfourodendron riedelianum), y araucaria (Araucaria angustifolia). Parque Provincial Cruce Caballero (26°31’S 53°59’W; y Tobuna (26°27’S 53°54’W; ambos a 600 msnm
(Krauczuk, 2005:17), en Inta-Campo Anexo El Zaimán y Campus de la Universidad Nacional de Misiones, localizado en el KM 7 de la Ruta Nacional 12, en el sector suburbano de la Ciudad de Posadas (27° 26’S – 55° 53’O), en hábitat de Pinus eliotii (Exótico)
(Krauczuk, 2009:33); en el municipio de Corpus Christi, parte SO del municipio de Santo Pipó y parte NO del municipio de Gobernador Roca (27º07’56.15”S 55º 28’1.97”O). El paisaje es ondulado, con remanentes de Selvas Mixtas de Laurel y Guatambú.
(Martínez Gamba, 2014:6); Parque Natural Municipal Monte Seguín, (Dto. General San Martín). Posee una superficie aproximada de 300 hectáreas y está localizado a la vera del río Paraná a solo 2 kilómetros al oeste del centro del poblado de Puerto Rico (26º 48’22.7”S 55º 01’40.65” O). Observado en asentamientos humanos, capueras, Selva secundaria tardía y Selva marginal.
(Rangel Olivera, 2015:169), lo cita para el Parque Provincial Moconá, (Dto. San Pedro), a 27°08′35″S 53°53′12″O
(Saibene et al., 1996:38), en PN Iguazú, frecuente, residente y nidificante
(Straneck, 1990), Parque Nacional Iguazú, en verano
(White, 1882:617), en Dto de San Javier, 1881; pocos espécimenes observados, solo en bosques densos.
Observaciones: De la Peña (Cataratas del Iguazú, (Dto. Iguazú, 07-02-1973)
(Narosky & Chébez, 2002:71), en PN Iguazú, en dosel del bosque.
Norte de Corrientes, (Capllonch et al., 2005:487), en área de estudio ubicada frente a la Isla de San Mateo, en la ribera oeste del Río Uruguay (28º29′ S 55º57′ W), 17 Km al norte de Santo Tomé, provincia de Corrientes. Observadoen árboles aislados entre los pastizales.
(Giraudo et al., 2006:9), en Sitio Ramsar “Esteros del Iberá”, preocupación menor
(López-Lanús et al., 2013:313), en el Sitio Piloto Aguapey, solo registrado durante todo el año en Ea. Virocay, (Dto Gral Virasoro), a 28º 15’45.74’’S 55º 57’25.36’’O
(Short, L.L. Jr., 1971:292). Ea. Santa Ana -29,0263 -56.4872, (Dto Gral Alvear), a 29°1’34,5″S 56°29’13,8″O, (8 km al norte de la ciudad de Alvear, en la orilla boscosa del rio Uruguay); Ea. Rincón de las Mercedes -28.3167 -55.7667, 6 km al SO de Colonia Garabí.
Este de Formosa, (Contreras, J.R., 1981, citado en ….). Lista preliminar de la avifauna correntina. I. No Passeriformes.
(Contreras, 1987:43, citado en De la Peña & Salvador, 2016: 104,105) en su Lista preliminar de la avifauna de la provincia de Formosa
(Contreras, 1993:5), en SE del Dto de Laishi, a lo largo de la RP-9 que une Puerto Fotheringham (Colonia Cano) con la Localidad de General Mansilla sobre la RN-11. El autor comenta que esta especie fue dada como probable por Contreras, (1987:43) y citada por Nores, (1989:67) para El Colorado, (Dto. Pirané), a 26°28’S-59°22’W.
(Contreras et al., 2014:369), rara en la provincia, residente, con escasos registros en las cercanías del valle aluvial del Rio Paraguay y cursos bajos de los Rios Bermejo y Pilcomayo.
(Di Giacomo, 2005:314), en la Reserva Ecológica «El Bagual» (Dto Laishi), a 26°10’S-58°56’W, escaso aunque probable residente
(López Lanús, 1997), en Parque Nacional “Río Pilcomayo”. Probable residente y nidificante. En isletas de monte y selvas en galería. Observado en Seccional Fonzo y Paso von Kelson
Este de Chaco, (Chatellenaz, 2005:544), en el Valle del Río Paraná en la Provincia del Chaco; el área de la revisión bibliográfica realizada por los autores, se encuentra comprendida entre la confluencia de los ríos Paraná y Paraguay hasta la desembocadura del río Tragadero, cerca de la localidad de Barranqueras (27º 29’S, 58º 56’W). Citado en selva riparia, como residente y nidificante en el área.Hábitat: Zonas húmedas, y bosques de transición y moderadamente secos. Prefiere zonas abiertas, bordes del bosque y zona de desmontes. Bosque de 2º crecimiento y claros con isletas de monte, especialmente aquellas zonas atacadas por el fuego, hasta las profundidades del bosque lluvioso (Skutch, 1969:428); Selva en galería, bosque de ribera, secundario, deciduo tropical (Stotz et al, 1996:198-199), parques, bordes y claros de selva, y sabanas húmedas con isletas de bosque (Contreras et al., 2014:369). Residente en tierras bajas, colinas e incluso hasta alturas de 2.150 msnm (principalmente por debajo de los 900 msnm) (Stotz et al, 1996:198-199); Tanto en Guatemala como Costa Rica vive desde el nivel del mar hasta los 900-1000 msnm, aunque ocasionalmente a los 1500 msnm (Griscom, 1957:29).
Ecorregiones: Selva Paranaense, Yungas y Chaco (Barnett & Pearman, 2001:53)
-
Carpintero garganta estriada | Comportamiento
Es un ave muy activa, escandalosa, que se inquieta con facilidad (Winkler & Christie, 2002). Se mueve en el estrato medio y dosel (Vallely & Dyer, 2018:239)
Solitarios, forman parejas en la época reproductiva y a veces se los observa en grupos familiares de 4 a 6 individuos; pocas veces se mezclan con otras bandadas de aves, aunque existen referencias con el Hormiguerito negro (Myrmotherula) (Skutch, 1969:428)
Aunque se mantienen con su pareja durante todo el año, ellos descansan, en todas las estaciones, en huecos separados (Skutch, 1969:431)VOCALIZACIONES
Se comunican entre ellos golpeteando y tamborileando especialmente durante la defensa de su territorio. Las vocalizaciones son características y mantenidas. (Sick, 1997:515)
Canto: llamada sostenida tipo “risa”: «pi-shâ-shâ-shâ-shâ-âh» es muy fácil de escuchar, asciende hasta descender abruptamente al final.Alarma: «pik» agudo; también como «kip-whurrr», «pik-urrr-rr», «ik-rrrr», «cuchrrrrrrrr», o «k’rroo» (Skutch 1969:431)
Llamada común: Series de 8-20 segundos, agudas, fuertes y explosivas de, «wicwic-wicwicwic», «wuk wuk wuk», «Kyah-yik-yik-yik» (Kilham & O’Brien, 1979:299) que descienden al final. Mantienen el pico ligeramente entreabierto mientras sacuden todo el cuerpo. Las utilizan para comunicarse con su pareja a la distancia, así como para anunciar la propiedad del territorio (Sick, 1997:515) (Kilham & O’Brien, 1979:299)
Otras llamadas: «kay rar- rrrr»(Kilham, 1979:299) (Kilham & O’Brien, 1979:300).
Sonidos no-vocales
Tamborileo: 5-8 golpes lentos seguidos de otros más rápidos de 1-2 s de duración. El tamborileo a una velocidad de una a tres ráfagas por minuto, parece estar relacionado con la comunicación entre parejas y la territorialidad. También se comunican golpeando la madera con golpes únicos y duros, generalmente como respuesta a los intrusos (Kilham & O’Brien 1979:299) (Skutch, 1969:431)Otros sonidos: durante el vuelo, ondulante y generalmente silencioso, en ciertas condiciones producen vuelo claramente audible (Kilham & O’ Brien, 1979:299)
ALIMENTACIÓN
Insectívoro: Escarabajos y sus larvas que barrena en la madera de los troncos, hormigas (Crematogaster, Camponotus, Azteca) (Skutch, 1969:428), orugas, así como semillas y frutos (Heliconias y Clusia rosea) (Skutch, 1969:439). Posiblemente actúe como controlador biológico, ya que al alimentarse con las larvas de insectos que dañan los fustes y deterioran el árbol, evita serios problemas a nivel forestal.
Forrajea en solitario y a menudo en pareja y grupos de 4-6 aves (Malekan, 2020)
Martilla, picotea, explora, tanto en madera viva como en descomposición, y utilizan sus largas lenguas protráctiles, de púas, para extraer larvas de los agujeros (Short 1982). Según otros autores se alimenta preferentemente en dosel, por percusión, localización de la presa valorando la diferencia en la resonancia entre madera hueca y sólida (Brooks et al., 1993:39)
Se alimentan a todas las alturas de los árboles en troncos y ramas grandes, y algunas veces en postes telefónicos. Los machos tienden a tener preferencia por las ramas más grandes que las hembras (Askins, 1983:950). También desciende a tierra, donde arroja a un lado las hojas en busca de alimentoREPRODUCCIÓN
Las hembras suelen iniciar la conducta copulatoria moviéndose hasta el final de la rama de un árbol y comprimiendo sus cuerpos con las nalgas ligeramente elevadas en el aire (postura de invitación). Mientras la hembra se dirige hacia el extremo de la rama, el macho asciende por el tronco del árbol y avanza hacia la hembra hasta que se establece el contacto cloacal. Las cópulas duran de 6 a 12 s (Kilham & O’Brien, 1979:299-300). La llamada larga se puede pronunciar antes de la cópula.
Se reproduce en primavera, de marzo a junio, excava sus nidos en troncos de árboles muertos a una altura de 18 a 27 m. Algunas veces ubica su nido en el estrato más bajo casi a 2 m de altura. El tamaño de la nidada es de 2 a 3 huevos (Skutch, 1969:433). Los machos y las hembras toman turnos de 2-3 horas de incubación durante el día, pero sólo los machos incuban durante la noche. Los polluelos son alimentados una vez cada hora por ambos padres (Binford, 1989:165, Winkler y Christie 2002); la hembra cubre la mayor parte de la alimentación mientras el macho vigila el nido (Skutch, 1969:434)
Acerca del cortejo, los autores Kilham & O’Brien (1979:299) mencionan que adopta varios métodos de comunicación: a) expresiones «instrumentales» entre ellas el tamborileo, golpeteo y vuelo sonoro; b) despliegues, como los de amenaza, movimientos ondulatorios con el pico; simplemente tocarse los picos entre ellos o erizar la cresta; y c) Vocalizaciones, llamadas fuertes o llamadas cortos y notas bajas. Después de esta conducta la pareja se acerca y copulan en un árbol aproximadamente entre 6 y 12 segundos; después se dan a la tarea de excavar en una cavidad el nido, lo que les lleva aproximadamente entre 16 y 18 días. (Kilham & O’Brien, 1979:300)
Tienen varios competidores, que también anidan en agujeros, que se interesan en las cavidades del pájaro carpintero, como el Arasarí de collar (Pteroglossus torquatus), Loro coroniblanco (Pionis senilis) y Amazona frentiroja (Amazona autumnalis), Benteveo rayado (Myiodynastes maculatus), Titira enmascarado (Tityra semifasciata) y Tueré grande (Tityra cayana). Los conflictos interespecíficos pueden hacer que los Carpinteros de garganta estriada se muestren amenazantes para proteger sus nidos (Kilham & O’Brien, 1979:301)