- Administración de Parques Nacionales (SIB). Ficha: Cypseloides senex. Recuperado en septiembre de 2024 de https://sib.gob.ar/especies/cypseloides-senex
- Avibase (s.f.). Ficha: Vencejo Canoso. Cypseloides senex (Temminck, CJ 1826). Recuperado en septiembre 2024 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=61C74CAD8200BDD2
- Allen, J. A. (1893). On a collection of birds from Chapada, Mato Grosso, Brazil, made by Mr. H. H. Smith. Part III. Pipridae to Rheidae. Bulletin of the American Museum of Natural History, 5: 107-158. (enlace)
- Barnett, J. M. & M. Pearman (2001). Lista comentada de las Aves Argentinas. Lynx Edicions, Barcelona, Spain. 164 pp. ISBN 84-87334-32-6
- Bates, J. M. & T. A. Parker III (1998). Appendix 2. The avifauna of Parque Nacional Noel Kempff Mercado and surrounding areas. Pp 317-340 in T.J. Killeen and T.S. Schulenberg (editors), A biological assessment of Parque Nacional Noel Kempff Mercado, Bolivia. RAP Working Papers 10. Conservation International, Washington, D.C. (enlace)
- BirdLife International (2024). Species factsheet: Great Dusky Swift Cypseloides senex. Downloaded from https://datazone.birdlife.org/species/factsheet/great-dusky-swift-cypseloides-senex on 10/09/2024.
- Bodrati, A., K. Cockle, J. M. Segovia, I. Roesler, J. I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A., J. I. Areta & E. White (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves, 57: 63-80. (enlace)
- Bodrati, A. & S. A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Historia Natural, Tercera Serie. Volumen 5 (1): 77-89. (enlace)
- Brooks, T. M., R. Barnes, L. Bartrina, S. H. M. Butchart, R. P. Clay, E. Z. Esquivel, N. I. Etcheverry, J. C. Lowen & J. Vincent (1993). Bird Surveys and Conservation in the Paraguayan Atlantic Forest: Project CANOPY ’92 Final Report. BirdLife Study Report 57. BirdLife International, Cambridge, UK. (enlace)
- Cebolla Badie, M. (2000) El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación. Suplemento Antropológico; Vol XXXV, n.º 2: 9-188 (enlace)
- Chantler, P. & G. Driessens (2000). Swifts: A Guide to the Swifts and Treeswifts of the World (second edition). Pica Press. (enlace)
- Chebez, J. C. (1993). Los manuscritos de William Henry Partridge. Aves misioneras (VIII). Nuestras Aves, 29: 20-22. (enlace)
- Chebez, J. C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5. Págs. 320. L. O. L. A. Bs.Aires. 320 pp. ISBN 950-9725-20-X
- Dabbene, R. (1917). Los Vencejos de la República Argentina. Hornero, 1: 3-8. (enlace)
- de la Peña, M. R. (1999). Aves Argentinas. Lista y Distribución. Monografía N.º 18; 244 pp. Ed. L.O.L.A. (Literature of Latin America). Buenos Aires. ISSN 0328-1620
- de la Peña, M. R. (2013). Nidos y Reproducción de las aves argentinas. Serie Naturaleza, Conservación y Sociedad No 8. Ediciones Biológica. Santa Fe. 590 pp. ISBN 978-987-27043-7-7
- de la Peña, M. R. (2015). Aves Argentinas. Incluye nidos y huevos. 1º Ed. Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña, M. R. & S. Salvador (2016). Descripción, Comportamiento, Reproducción y Distribución. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie). Vol. 20 Vol 1; 627 pp. ISSN 0325-3856
- de la Peña, M. R. (2020:255-257). Aves argentinas. Descripción, Comportamiento, Reproducción y Distribución (Actualización). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), N° 6; Pág. 1-348. ISSN 0325-3856
- del Hoyo, J. ed. (2020). All the Birds of the World. Lynx Edicions. Barcelona, España. 967 pp. ISBN 978-84-16728-37-4
- de Vasconcelos, M. F., Duca, C. & L. F. Silveira (2005). Range extension for Sooty Swift Cypseloides fumigatus, with notes on its nesting in Central Brazil. Cotinga, 25: 74-76. (enlace)
- Dubs, B. (1992). Birds of Southwestern Brazil: Catalogue and Guide to the Birds of the Pantanal of Mato Grosso and its Border Areas. Betrona Verlag, Kusnacht, Switzerland. ISBN 3-9520244-0-6 (enlace)
- Hayes, F. E. (1995). Status, Distribution and Biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, CO, USA. 230 pp. ISBN 1-878788-30-2 (enlace)
- Hayes, F. E. & P. A. Scharf (1995). The birds of Parque Nacional Ybycuí, Paraguay. Cotinga 4:14–19. (enlace)
- Hilty, S. L. & W. L. Brown (1986). A Guide to the Birds of Colombia. Princeton University Press, Princeton, NJ, USA.
- Marull, C. (1994). Relevamiento Faunístico del Área Cataratas, Parque Nacional Iguazú. El vencejo de cascada. Densidad poblacional y comportamiento alimenticio (enlace)
- Narosky, T. & J. C. Chebez (2002). Aves de Iguazú: guía para la identificación (1º Ed.). Vázquez Mazzini Editores, Buenos Aires, Argentina. 128 pp. ISBN 987-9132-04-1
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. (16ª Ed.) Vázquez Mazzini Editores, Buenos Aires, Argentina. 432 pp. ISBN 978-987-9132-27-2
- Navarro, A. G., Peterson, A. T., Escalante, P. & H. Benítez (1992). Cypseloides storeri, a new species of swift from Mexico. Wilson Bull., 104 (1): 55–64. (enlace)
- Oliveira, S. L. (2011). Aves, Apodidae, Cypseloides senex (Temminck, 1826): Geographic distribution in the state of Rio Grande do Sul, Southern Brazil. Checklist 7: 473-475. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & R. de By (Xeno-canto Foundation). Ficha: Vencejo canoso · Cypseloides senex · (Temminck, 1826); Recuperado en septiembre de 2024 de https://xeno-canto.org/species/Cypseloides-senex
- Pacheco, J. F. & F. Olmos (2005). Birds of a latitudinal transect in the Tapajos-Xingu Interfluvium, eastern Brazilian Amazonia. Ararajuba, 13: 29-46. (enlace)
- Raymundi, D. P. & G. A. Borsini (1997). Primer registro de Cypseloides senex (Temminck, 1826), (Aves, Apodidae) en Parque Provincial Salto Encantado, Dpto. de Cainguás, provincia de Misiones. Bol. Cient. Aprona, 32: 36. (enlace)
- Remsen, J. V., Jr., J. I. Areta, E. Bonaccorso, S. Claramunt, A. Jaramillo, D. F. Lane, J. F. Pacheco, M. B. Robbins, F. G. Stiles & K. J. Zimmer (2022). (enlace) Version 24 JULY 2022. A classification of the bird species of South America. American Ornithological Society. (enlace)
- Rosenblatt, C. (2020). Great Dusky Swift (Cypseloides senex), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.grdswi1.01
- Saibene, C. A., M. A. Castelino, N. R. Rey, J. Herrera & J. Calo (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina. Literature of Latin America, Buenos Aires, Argentina. 70 pp. ISSN 0328-1620
- Schubart, O., A. C. Aguirre & H. Sick (1965). Contribuição para o conhecimento da alimentação das aves brasileiras. Arquivos de Zoologia do Estado de São Paulo, 12:95–249. (enlace)
- Sick, H. (1993). Birds in Brazil. A Natural History. Princeton University Press, Princeton, NJ, USA. 534 pp. ISBN 0-691-08569-2 (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brazil. 912 pp. ISBN 85-209-0816-0
- Stopiglia R. & M. A. Raposo (2007). Distribuição e biologia do andorinhão-preto-da-cascata Cypseloides fumigatus e do andorinhão-velho-da-cascata C. senex no Brasil: uma síntese. Cotinga, 27: 49-57 (enlace)
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker & D. K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA, and London, UK. 478 pp. ISBN 0-226-77630-1
- Valim, M. P. (2013). Three new species of Dennyus Neumann, 1906 (Phthiraptera, Amblycera, Menoponidae) parasitic on swifts (Aves, Apodiformes, Apodidae) in Brazil. Papeis Avulsos de Zoologia, 53: 415-429. (enlace)
- Whitacre, D. F. (1989). Conditional use of nest structures by White-naped and White-collared Swifts. Condor, 91 (4):813–825. (enlace)
- Whitney, B. M., J. L. Rowlett & R. A. Rowlett (1994). Distributional and other noteworthy records for some Bolivian birds. Bulletin of the British Ornithologists’ Club, 114 (3):149–162. (enlace)
-
-
Vencejo de cascada | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNATIONAL: PREOCUPACIÓN MENOR.Especie con rango extremadamente amplio, por lo tanto no se aproxima a los umbrales de Vulnerabilidad bajo criterio de tamaño del rango (extensión < 20.000 km² combinado con declinación o fluctuación del tamaño del rango, extensión/calidad del hábitat, o tamaño de la población y número pequeño de localizaciones o fragmentación severa). La población parece ser estable, por lo que no se cree que alcancen los umbrales de Vulnerabilidad bajo los criterios de tendencia de la población (declinación > 30% en 10 años o 3 generaciones). El tamaño de la población no ha sido cuantificado, pero no se cree que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (< 10.000 individuos maduros con una declinación continua estimada de ser un > 10% en 10 años o 3 generaciones, o con una estructura poblacional específica). Se sospecha que la población es estable ya que no existen evidencias de disminución de su número ni existencia de amenazas sustanciales. (Ekstrom, J., Butchart, S.)
Debido a su amplia distribución geográfica y a una población aparentemente estable, el estado de conservación del Vencejo de cascada, incluido en la Lista Roja de la UICN, se evalúa como Preocupación menor (BirdLife International, 2024; Rosenblatt, 2020; del Hoyo, 2020:128; Stotz et al., 1996:174).EFECTOS DE LA ACTIVIDAD HUMANA EN LAS POBLACIONES
La construcción de presas podría inundar las cascadas, interfiriendo con la cría y dormideros de esta especie. En el valle del río Uruguay, la construcción de cuatro grandes represas en la parte superior del río puede ser la responsable de la extinción o reducción severa de las poblaciones reproductoras (Oliveira, 2011:475; Stotz et al. 1996:175; Chantler & Driessens, 2000:113).
En Argentina
Según Marull (1994:43-45), «esta especie es catalogada como Rara en el orden nacional y que el CIPA ha listado como «Probablemente amenazada». Los dos focos poblacionales nidificantes de mayor importancia por su tamaño habían sido detectados en la Cataratas del Iguazú y en Sete Quedas (Brasil), esta última ya desaparecida con el represamiento de Itaipú.
«La creciente urbanización en los alrededores de las cataratas y el incremento consecuente del impacto turístico que ello genera, influyen sobre un ambiente único, como son los saltos y el sector isleño del Área. Además, el río Iguazú al tener sus nacientes fuera de los límites del Parque es muy vulnerable a sufrir grandes perturbaciones como lo son la contaminación, el represamiento parcial y en erosión de la alta cuenca, lo que se ve reflejado en las continuas inundaciones causadas por éste aguas abajo. El conjunto de presiones y modificaciones puede repercutir negativamente en las poblaciones de la especie, que está directamente ligada a los ciclos del río».Estado de conservación (SIB, 2024)
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza . Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real. -
Vencejo de cascada | Distribución

InfoNatura: Animals and Ecosystems of Latin America 2007 Se distribuye en el centro-este de América del Sur, desde el este de Bolivia hasta el este de Paraguay (Brooks et al., 1993:118; Hayes, 1995:66; Hayes & Scharf, 1995:16) y desde el noreste de Argentina hasta el sureste de Brasil (Rosenblatt, 2020; de Vasconcelos et al., 2015:74).
En Bolivia se ha registrado sólo en el noreste de Santa Cruz (Whitney et al., 1994:154; Bates & Parker, 1998:326), donde está presente un «hábito reproductivo aparentemente ideal» (Whitney et al. 1994:154), pero la reproducción aún no está confirmada en esta región. Se reproduce en el sureste de Paraguay (Hayes, 1995:66) y en el noreste de Argentina en Misiones.
En Brasil está presente desde el Este de Mato Grosso hasta el Sur de Pará, y al Sur hasta Río Grande do Sul (se encuentra principalmente en la región de la Mata Atlántica, desde los estados de Espírito Santo hasta Rio Grande do Sul (Allen, 1893:123; Dubs, 1992:54; Sick, 1993:314; Pacheco & Olmos, 2005:31; Oliveira, 2011:473; de Vasconcelos et al., 2015:74). Localmente abundante en Brasil, escaso en Paraguay y otras áreas (Hayes & Scharf, 1995:16).En Argentina: En la Provincia de Misiones. (Citas y coordenadas)
Hábitat: selvas, bosques de tierras bajas, matorrales de segundo crecimiento, cascadas (Sick, 1993:314; de la Peña, 2020:256). Estrato alto sobre selvas y ríos, desde tierras bajas hasta los 2000 msnm (Stotz et al., 174-317). Anida y se posa en cascadas, y se alimenta en zonas cercanas. Registrado en Bolivia a los 180 m de altitud (Narosky & Chebez, 2002:62). Según del Hoyo (2020:128) entre 100 y 1000 msnm
Ecorregiones: Selva Paranaense (Barnett & Pearman, 2001:48). -
Vencejo de cascada | Comportamiento
Gregario. Residente, tratado equivocadamente como migratorio, aunque ejecuta desplazamientos diarios en busca de alimento (Stopiglia & Raposo, 2007:55). Sin embargo, los autores Stotz et al., 1996:414 y Hilty & Brown (1986), sugirieron que podría ser un migrante transamazónico, basándose en registros de avistamientos indocumentados, que se cree que son de esta especie, en el noreste de Perú. Sin embargo, no hay confirmación de que se encuentre en Perú, y ahora generalmente se considera residente en toda su área de distribución (Chantler & Driessens, 2000:113).
Vive durante las horas de luz en continuo movimiento, alimentándose solamente en vuelo capturando sus presas individualmente (diversas especies de insectos voladores) (Sick, 1993:318; Chantler & Driessens, 2000:113; Narosky & Chebez, 2002:62; Narosky, T. & D. Yzurieta, 2010:196). Poseen la habilidad de reducir abruptamente la velocidad para alimentarse de enjambres estacionarios de pequeños himenópteros. También presenta un vuelo vertical que les permite efectuar cambios de ubicación entre los diferentes posaderos. Entre las especies del género Cypseloides, es la más propensa a cazar a grandes alturas, salvo ante ciertas condiciones atmosféricas en las que los insectos permanecen en estratos inferiores.Se ha observado que cuando escasea el alimento, en tiempo lluvioso y frío, permanece el día entero en sus posaderos. Durante el período reproductivo exhiben una particular manera de volar, como vuelos en círculos y en grupos de tres. La cópula se realiza en vuelo (Marull, 1994:42 )
Descansan en grandes colonias alrededor de cascadas (Pacheco & Olmos, 2005:35). Se congregan en grandes bandadas de cientos de individuos (de la Peña, 2020:255) y se lo ha observado, en muchas ocasiones, asociado con S. zonaris (Stopiglia & Raposo, 2007:53; Rosenblatt, 2020; Chantler & Driessens, 2000:113).Es huésped del ectoparásito Dennyus malagonensis, un tipo de piojo masticador. (Valim, 2013:427).
Vocalizaciones: Sick (1997:428), la describe como un repetido “tik-tik-tik” seguido de “trrrrrrr….churrrrrr” (Rosenblatt, 2020; Narosky & Chebez, 2002:62). Straneck (en de la Peña, 2016:485) comenta que en vuelo emite un áspero y prolongado «Chierrrrr…chierrrrrr…»
ALIMENTACIÓN
Insectívoro, aunque su dieta no se conoce con mucho detalle. El contenido de los estómagos de tres especímenes de Brasil contenía Coleoptera (Bruchiade, Carabidae, Chrysomelidae, Curculionidae, Nitidulidae, Staphylinidae y Tenebrionidae), Diptera, Hemiptera, Homoptera e Hymenoptera (Formicidae, Ichneumonoidea y microhymenoptera) (Schubart et al., 1965:170; Oliveira, 2011:473; Sick 1993:318).
Bodrati & Salvador (2015:82), los observaron alimentándose de Termitas en la provincia de Misiones.REPRODUCCIÓN
Se reproduce en colonias. Presumiblemente monógamo. El nido es una taza colocada en un acantilado, detrás o al lado de una cascada, generalmente en hendiduras de rocas. Compuesto de musgo y guijarros, unidos con saliva y barro (Whitacre, 1989:819; Sick, 1993:314; Oliveira, 2011:473; Chantler & Driessens, 2000:113; Stopiglia & Raposo, 2007:52). Según Sick «… también en paredes enteramente expuestas a la luz del día (por ejemplo, Iguaçu, Paraná), lo cual es inusual para un Apodidae»
Los datos sobre la reproducción de esta especie en Minas Gerais generalmente concuerdan con informes publicados anteriormente, ya que todos los registros corresponden a la temporada de lluvias en el centro y sureste de Brasil (en septiembre-marzo) (de Vasconcelos et al., 2015:74). Se localizaron nidos en Misiones en el mes de octubre (de la Peña, 2013:19; de la Peña, 2015:337; Salvador & Narosky (en de la Peña, 2016:485).
La puesta es de 1-2 huevos ovoides de color blanco. Incubación 25 días. Los pichones nacen desnudos y en menos de dos semanas se cubren de un denso manto de plumas, importante adaptación a este ambiente extremadamente húmedo. El período de nidificación coincide con el de las lluvias, momento en el que disponen de mayor cantidad de alimento (Marull, 1994:43). -
Vencejo de cascada | Descripción

© Mark Bolnik. (Cypseloides senex). Agosto 2019. Cataratas del Iguazú. Misiones. Algunos derechos reservados Vencejo de tamaño mediano a grande con un plumaje predominantemente oscuro, que varía entre tonalidades negruzcas y pardas. Sexos similares
El plumaje general es pardo uniforme, destacándose una coloración más clara en la cabeza, particularmente en la frente, lorales y mandíbula aún más pálidas.
Cuerpo voluminoso con alas largas y anchas.
El vientre es más claro, especialmente en la garganta, donde los raquis oscuros destacan sobre las plumas claras.
Las plumas supracaudales y la rabadilla son más claras que el dorso, mientras que las cubiertas alares son marrón negruzco, con remeras primarias y secundarias internas de puntas pálidas. La parte ventral de las alas es apenas más clara que la dorsal.
Su cola es corta, de forma cuadrada o ligeramente redondeada.
Pico y dedos negros. (Sick, 1993:318; Sick, 1997:428; Chantler & Driessens, 2000:113; Navarro et al. 1992:59; de la Peña, 2020:255; de la Peña, 2015:33; del Hoyo, 2020:128; Dubs, 19992:54; Narosky & Chebez, 2002:62; Stopiglia & Raposo, 2007:52).
-
Vencejo de cascada | Taxonomía

Monotípico (Rosenblatt, 2020; del Hoyo, 2020:128).
Protónimo: Aerornis senex (Remsen et al., 2022).
-
Vencejo de cascada (Cypseloides senex)

Nouveau recueil de planches coloriées d’oiseaux: pour servir de suite et de complément aux planches enluminées de Buffon (Cypselus senex) Es la especie más grande del género que se encuentra en nuestro país. Gregario, asociado a cataratas. Se registra principalmente el este de Sudamérica: en Argentina, Brasil y Bolivia; más raro en Perú y Paraguay.(Rosenblatt, 2020). Estas aves tienen bastante semejanza con las golondrinas (Dabbene, 1917:3), con las cuales han sido reunidas con frecuencia, pero ese parecido es únicamente superficial.
Nombres comunes: Vencejo de cascada (Argentina, Paraguay); Golondrina del Iguazú, Golondrina murciélago grande, Vencejo ahumado grande, Vencejo de anteojos grande, Vencejo de las cataratas, Vencejo ligero, Vencejo pardo, Vencejo pardo grande, Vencejo canoso. Andorinhão-velho-da-cascata, taperuçu, taperucu-velho (Brasil); En guaraní le dicen “Mbyju’i ita”, «Mbiyuí-mbopí-guasú» (Chebez,1996:135; de la Peña, 2020:255; Cebolla Badie, 2000; de la Peña, 2015:337).
En otros idiomas

Breves apuntes históricos:
- Nouveau recueil de planches coloriées d’oiseaux: pour servir de suite et de complément aux planches enluminées de Buffon, édition in-folio et in-4⁰ de l’Imprimerie royale, 1770. Temminck, C. J., Buffon , Georges Louis Leclerc. A Strasbourgh; Chez Legras Imbert et Comp.,1838: 201-202 ; Lámina 397 (Cypselus senex)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. London,1874-98. Vol 16: 496
- As aves do Estado de S. Paulo. Ihering, H. von. S. Paulo: Typ. a vapor de Hennies irmãos,1898; pp: 268 (Cypseloides senex)
-
Vencejo ahumado chico | Bibliografía
- Albano, C. & W. Girão (2008). Aves das matas úmidas das serras de Aratanha, Baturité e Maranguape, Ceará. Revista Brasileira de Ornitologia, 16: 142‐154. (enlace)
- ArgentAvis. (s.f.). Proyecto “Argentavis – Aves de Argentina” (enlace)
- Barnett, J.M. & M. Pearman (2001). Lista comentada de las aves argentinas. Lynx Edicions, Barcelona. 164 pp. ISBN 84-87334-32-6
- Barnett, J.M. J.M. Inns, Kirwan, G.M. & H.R. Remold (2004). Informações adicionais sobre as aves dos estados do Paraná, Santa Catarina e Rio Grande do Sul. Ararajuba, 12: 53–56. (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History, 178 (4): 369–636.
- Bertoni, A.D.W. (1939). Catálogos sistemáticos de los vertebrados del Paraguay. Revista de la Sociedad Científica del Paraguay, 4 (4): 1-60.
- Biancalana, R.N. (2015). Breeding biology of the Sooty Swift (Cypseloides fumigatus) in São Paulo, Brazil. Wilson J. Orn., 127 (3): 402–410. https://doi.org/10.1676/14-067.1 (enlace)
- Biancalana, R.N., Nogueira, W., Bessa, R., Pioli, D., Albano, C. & C. Lees (2012). Range extensions and breeding biology observations of the Sooty Swift (Cypseloides fumigatus) in the states of Bahia, Goiás, Minas Gerais and Tocantins. Revista Brasileira de Ornitologia, 20 (2): 87–92. (enlace)
- BirdLife International (2024) Species factsheet: Cypseloides fumigatus. Downloaded from https://datazone.birdlife.org/species/factsheet/sooty-swift-cypseloides-fumigatus on 20/05/2024.
- Bodrati, A., K. Cockle, J. M. Segovia, I. Roesler, J. I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A., J.I. Areta & E. White (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves, 57: 63-80. (enlace)
- Bodrati, A. & S.A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Nuestras Aves, 5: 77-89. (enlace)
- Brooks, T.M., R. Barnes, L. Bartrina, S.H.M. Butchart, R.P. Clay, E.Z. Esquivel, N.I. Etcheverry, J.C. Lowen & J. Vincent (1993). Bird Surveys and Conservation in the Paraguayan Atlantic Forest: Project CANOPY ’92 Final Report. BirdLife Study Report 57. BirdLife International, Cambridge, UK. (enlace)
- Brooks, T.M., Clay, R.P., Lowen, J.C., Butchart, S.H.M., Barnes, R., Esquivel, E.Z., Etcheverry, N.I. & J.P.Vincent (1995). New information on nine birds from Paraguay. Ornitología Neotropical, 6 (2): 129–134. (enlace)
- Chantler, P. (2000). Swifts. A guide to the swifts and treeswifts of the world. Second edition. Yale University Press, New Haven, Connecticut. 280 pp. ISBN 0-300-07936-2 (enlace)
- Chebez, J.C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5. Págs. 320. L. O. L. A. Bs.Aires. 320 pp. ISBN 950-9725-20-X
- Dabbene, R. (1918). Nidos y huevos de vencejos. Hornero, 1: 193. (enlace)
- de la Peña, M.R. (2015). Aves Argentinas. Incluye nidos y huevos. 1º Ed. Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña M.R. (1999). Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 18; 244 pp. Buenos Aires. ISSN 0328-1620
- de la Peña, M.R. (2020). Aves Argentinas: Descripción, Comportamiento, Reproducción y Distribución. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino» (Actualización). N° 6. Pág. 1-347. ISSN 0325-3856
- del Hoyo, J. ed. (2020). All the Birds of the World. Lynx Edicions. Barcelona, España. 967 pp. ISBN 978-84-16728-37-4
- Di Giacomo, A.S., M.V. De Francesco & E.G. Coconier (editores) (2007). Áreas importantes para la conservación de las aves en Argentina. Sitios Prioritarios para la conservación de la biodiversidad. Temas de Naturaleza y Conservación 5:1-514. CD-ROM. Edición Revisada y Corregida 1 . Aves Argentinas/Asociación ornitológica del Plata, Buenos Aires.
- Eisenmann, E. & F.C. Lehmann (1962). A new species of swift of the genus Cypseloides from Colombia. Amer. Mus. Novit., 2117: 1–16. (enlace)
- Hayes, F.E. (1995). Status, distribution, and biogeography of the birds of Paraguay. Monogr. Field Ornithol, 1: 1-230. American Birding Association, Colorado Springs, Colorado); 224 pp. ISBN: 1-878788-30-2 (enlace)
- Hennessey, B., S.K. Herzog & F. Sagot (2003). Lista anotada de las aves de Bolivia. Asociación Armonia, Santa Cruz de la Sierra, Bolivia.
- Hernández, N. (2020). Sooty Swift (Cypseloides fumigatus), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.sooswi1.01
- Krauczuk, E.R. & J. Baldo (2004). Contribuiçao para o conhecimento da avifauna de um fragmento de floresta com araucaria em Misiones, Argentina. Atualidades ornitológicas, 119: 1-42. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird. Ficha: Vencejo Negruzco –Cypseloides fumigatus– (Streubel, AV 1848); Recuperado en mayo 2024 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=9054A7CAD23D5D4F
- López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo & R. Banchs (2008). Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. (enlace)
- Lowen, J.C., R.P. Clay, J. Mazar, A. Madroño, M. Pearman, B. López, J.A. Tobias, D.C. Liley, T.M. Brooks, E.Z. Esquivel & J.M. Reid (1997). New and noteworthy observations on the Paraguayan avifauna. Bulletin of the British Ornithologists’ Club, 117 (4): 275–293. (enlace)
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. ISBN 950-99063-6-0
- Olrog, C.Ch. (1979). Nueva Lista de la Avifauna Argentina. Ópera Lilloana XXVII. Ministerio de Cultura y Educación. Fundación Miguel Lillo. Tucumán, Argentina. 324 pp. ISSN 0078-5245
- Pacheco, J.F., Parrini, R., Whitney, B.M., Fonseca, P.S.M. & C. Bauer (1996). Novos registros de aves para o Estado do Rio de Janeiro: Vale de Paraíba Norte. Atualidades Orn., 73: 6. (enlace)
- Pearman, M., Areta, J.J., Roesler, I. & A. Bodrati (2010). Confirmation of the Sooty Swift (Cypseloides fumigatus) in Argentina, with notes on its nest placement, seasonality, and distribution. Ornitología Neotropical, 21: 351–359. (enlace)
- Remsen, J.V., Jr., J.I. Areta, E. Bonaccorso, S. Claramunt, G. Del-Río, A. Jaramillo, D.F. Lane, M.B. Robbins, F.G. Stiles & K. J. Zimmer. Version [date]. A classification of the bird species of South America. Museum of Natural Science, Louisiana State University. http://www.museum.lsu.edu/~Remsen/SACCBaseline.htm VERSION: 16 May 2024
- Roesler, I., G.M. Kirwan, M.G. Agostini, D. Beadle, H. Shirihai & L.C. Binford (2009). First sight records of White-chested Swift Cypseloides lemosi in Bolivia, with documented records of C. lemosi and White-chinned Swift C. cryptus in Peru. Bulletin of the British Ornithologists’ Club, 129: 222-228. (enlace)
- Short, L.L. (1975). A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History, 154 (3): 165–352. (enlace)
- S.I.B. Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina. Ficha: Cypseloides fumigatus (Streubel, 1848); Recuperado en mayo 2024 de https://sib.gob.ar/especies/cypseloides-fumigatus?tab=sitios#presencia-title
- Sick, H. (1993). Birds in Brazil. A Natural History. Princeton University Press, Princeton, NJ, USA. ISBN 0-691-08569-2 (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brazil. 912 pp. ISBN 85-209-0816-0
- Silveira, L. F., Develey, P. F., Pacheco, J. F. & B.M. Whitney (2005). Avifauna of the Serra das Lontras-Javi montane complex, Bahia, Brazil. Cotinga, 24: 45-54. (enlace)
- Stopiglia, R. & M.A. Raposo (2007). Distribuição e biologia do andorinhao-preto-da cascata Cypseloides fumigatus e do andorinhao-velho-da cascata C. senex no Brasil: uma síntese. Cotinga, 27: 49-57. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A. & D.K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA, and London, UK. 478 pp. ISBN 0-226-77629-8
- Straube, F.C., Krul, R. & E. Carrano (2005). Coletânea da avifauna da região sul do Estado do Paraná (Brasil). Atualidades Ornitológicas, 125 (10). (enlace)
- Vasconcelos, M.F., C. Duca & L.F. Silveira (2006). Range extension for Sooty Swift Cypseloides fumigatus, with notes on its nesting in central Brazil. Cotinga, 25: 74–76. (enlace)
- Xeno-canto (2024). Ficha: Vencejo negruzco · Cypseloides fumigatus · (Streubel, 1848). Recuperado en mayo 2024 de https://xeno-canto.org/species/Cypseloides-fumigatus
- Zimmer, J.T. (1945). A new swift from Central and South America. Auk, 62 (4): 586–592. (enlace)
-
Vencejo ahumado chico | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNATIONAL: PREOCUPACIÓN MENOR.
(BirdLife International, 2024; Hernández, 2020)
Especie con rango extremadamente amplio, por lo tanto no se aproxima a los umbrales de Vulnerabilidad bajo criterio de tamaño del rango (extensión < 20.000 km² combinado con declinación o fluctuación del tamaño del rango, extensión/calidad del hábitat, o tamaño de la población y número pequeño de localizaciones o fragmentación severa). A pesar del hecho que la población parece tener tendencia a disminuir, no se cree que esta declinación sea lo suficientemente rápida como para alcanzar los umbrales de Vulnerabilidad bajo los criterios de tendencia de la población (declinación > 30% en 10 años o 3 generaciones). El tamaño de la población no se ha cuantificado pero no se cree que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (< 10.000 individuos maduros con una declinación continua estimada ( > 10% en 10 años o 3 generaciones, o con una estructura poblacional específica). Por estas razones la especie es considerada como: Preocupación menor
El tamaño de la población global no ha sido cuantificado, pero esta especie se describe como «bastante común pero distribuida de manera irregular» (Stotz et al., 1996:174).
Se estima provisionalmente que la especie está en declive debido a la pérdida de hábitat según Tracewski et al. (2016).En Argentina (SIB, 2024)
Estado de conservación
Vulnerable (VU): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1º ed. AOP: Buenos Aires, Argentina
Insuficientemente Conocida (IC): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
Vulnerable (VU): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real. -
Vencejo ahumado chico | Distribución
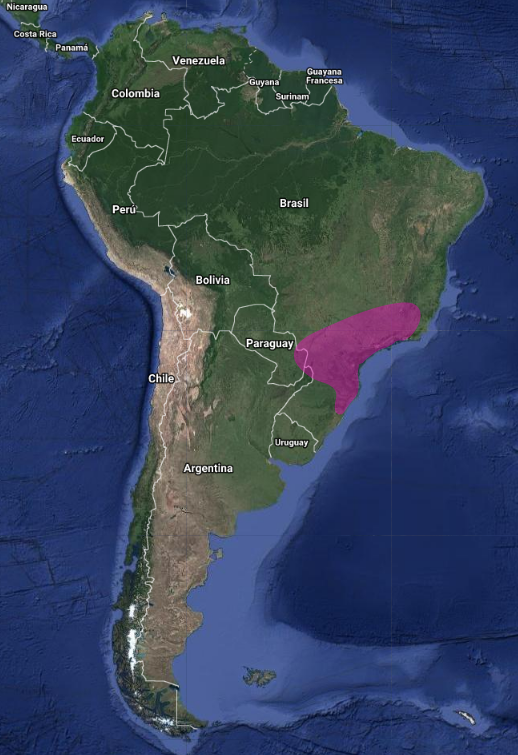
InfoNatura: Animals and Ecosystems of Latin America 2007 En América del Sur tiene una distribución amplia, pero dispersa, con registros en Este de Paraguay, Sureste de Brasil y Noreste de Argentina (Misiones) (Olrog, 1979:138; Sick, 1993:318; Brooks et al., 1993:118; Brooks et al., 1995:131; Chantler, 2000:108; Narosky & Yzurieta, 2010:197; Pearman et al., 2010:352; Stotz et al., 1996:317; Biancalana, 2015:402-403).
En Brasil, se puede encontrar en Rio Grande do Sul, Paraná, São Paulo, Río de Janeiro, Minas Gerais, Goiás, Tocantins, Bahía y Ceará (Belton, 1984:564; Pacheco et al., 1996:5; Sick, 1997:497; Barnett et al., 2004:54; Silveira et al., 2005:52; Straube et al., 2005:22; Vasconcelos et al., 2006:74; Stopiglia & Raposo, 2007:52; Albano & Girão, 2008:145; Pearman et al., 2010:351; Biancalana et al., 2012:1; Biancalana, 2015:402).
Se ha confirmado la presencia de nidos activos en Tocantins, Minas Gerais, Río de Janeiro y Paraná en Brasil (Vasconcelos et al., 2006:74; Biancalana et al., 2012:1) y en Misiones, Argentina (Pearman et al., 2010:352).
Brooks et al. (1995:131) comentan que en Paraguay, Bertoni (1939:26) reportó la especie para «Paraná», pero sin evidencias y Hayes (1995:129) consideró este informe como «hipotético». Sin embargo, comunican nuevos registros que pueden indicar que la especie es un residente escaso en el este de Paraguay, con un aumento en el número de individuos debido a la llegada de migrantes en la primavera austral, que han pasado el invierno más al norte.
Al menos en la porción sur de su rango, puede estar presente solo de manera estacional, por ejemplo, principalmente de septiembre a marzo en Río Grande do Sul, Brasil (Belton, 1984:564) y de agosto a marzo en Misiones, Argentina (Pearman et al., 2010:352). Aunque se ha informado de su presencia en Bolivia (Chantler, 2000:108), no hay registros confirmados en ese país (Pearman et al., 2010:356).Distribución geográfica en Argentina: En la provincia de Misiones (Citas y observaciones)
HÁBITAT
Se lo observa sobre cañones, pantanos, bosques montanos húmedos, bosques templados y áreas de crecimiento secundario (Belton, 1984:564; Stotz et al., 1996:174; Vasconcelos et al., 2006:74; Di Giácomo et al., 2007:494).
Frecuenta selvas entre los 700 y los 2100 m de altura (de la Peña, 2015:337; de la Peña, 2020:254; Stotz et al., 1996:174; Hernández, 2020)
La especie tiene una fuerte asociación con la Mata Atlántica, con registros dispersos en áreas de transición entre otros biomas (Barnett & Pearman, 2001:48; Vasconcelos et al., 2006:74; Stopiglia & Raposo, 2007:52; Albano & Girão, 2008:145; Biancalana et al., 2012:2; Biancalana, 2015:403).