- Alvarenga, H.M.F., Höfling, E. & L.F. Silveira (2002). Notharchus swainsoni (Gray, 1846) (Bucconidae) é um espécie válida. Ararajuba, 10 (1): 73-77. (enlace)
- Aleixo, A. & M. Galetti (1997). The conservation of the avifauna in a lowland Atlantic forest in south-east Brazil. Bird Conservation International, 7 (3): 235–261. (enlace)
- ArgentAvis. (s.f.). Proyecto “Argentavis – Aves de Argentina” (enlace)
- Barnett, J.M. & M. Pearman (2001). Lista comentada de las aves argentinas. Lynx Edicions, Barcelona. 164 pp. ISBN 84-87334-32-6
- Bodrati, A. & K. Cockle (2007). Alta cuenca del Arroyo Alegría. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 290-292. Temas de Naturaleza y Conservación 5. CD-ROM. Edición Revisada y Corregida. Aves Argentinas/ Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Bodrati, A., K. Cockle, J.M. Segovia, I. Roesler, J.I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A. & S.A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Nuestras Aves, 5: 77-89. (enlace)
- Brooks, T.M., R. Barnes, L. Bartrina, S.H.M. Butchart, R.P. Clay, E.Z. Esquivel, N.I. Etcheverry, J.C. Lowen & J. Vincent (1993). Bird Surveys and Conservation in the Paraguayan Atlantic Forest: Project CANOPY ’92 Final Report. BirdLife Study Report 57. BirdLife International, Cambridge, UK. (enlace)
- Chebez, J.C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5. Págs. 320. L. O. L. A. Bs.Aires. 320 pp. ISBN 950-9725-20-X
- Cockle, K.L., A. Bodrati, M. Lammertink, B. B. Bonaparte, C. Ferreira & F. Di Sallo (2016). Predators of bird nest in the Atlantic Forest of Argentina y Paraguay. Wilson Jour. Ornith., 128: 120-131. (enlace)
- Cory, C.B. (1919). Catalogue of Birds of the Americas. Publications of the Field Museum of Natural History, Zoological Series, 13 (2): 608. (enlace)
- de la Peña M.R. (1999). Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 18; 244 pp. Buenos Aires. ISSN 0328-1620
- de la Peña, M.R. (2015). Aves Argentinas. Incluye nidos y huevos. 1º Ed. Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña, M.R. (2020:29). Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución. (Actualización). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), Vol 7: 1-344. ISSN 0325-3856
- del Hoyo, J. ed. (2020). All the Birds of the World. Lynx Edicions. Barcelona, España. 967 pp. ISBN 978-84-16728-37-4
- Giraudo, A.R., Baldo, J.L. & R.R. Abramson (1993). Aves observadas en el sudeste, centro y este de Misiones (República Argentina), con la mención de especies nuevas o poco conocidas para la provincia. Nótulas Faunísticas, 49: 1-13. (enlace)
- Hayes, F.E. (1995). Status, Distribution and Biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, CO, USA. 224 pp. ISBN: 1-878788-30-2 (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird. Ficha: Notharchus swainsoni; Recuperado en mayo 2024 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=5D3D72E119BEFB1C
- López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo & R. Banchs (2008). Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. (enlace)
- Matthews, A. & P. Smith (2017). Breeding observations on Buff-bellied Puffbird Notharchus swainsoni (Piciformes: Bucconidae) at rancho Laguna Blanca, San Pedro Department, Paraguay. Revista Brasileira de Ornitologia, 25 (1): 20-23. (enlace)
- Narosky, T. & J.C. Chebez (2002). Aves de Iguazú: guía de identificación. 1º Ed. Vázquez Mazzini Editores, Buenos Aires. 128 pp. ISBN 987-9132-04-1
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. ISBN 950-99063-6-0
- Oliveira, R.C. & O. Arasaki (2011). Novos registros de Notharchus swainsoni (Galbuliformes: Bucconidae) na região noroeste do Estado do Paraná e ampliação da área de ocorrência no estado. Atualidades Orn., 162: 6-7. (enlace)
- Olrog, C.Ch. (1979). Nueva Lista de la Avifauna Argentina. Ópera Lilloana XXVII. Ministerio de Cultura y Educación. Fundación Miguel Lillo. Tucumán, Argentina. 324 pp. ISSN 0078-5245
- Partridge, W.H. (1954). Estudio preliminar sobre una colección de aves de Misiones. Rev. Mus. Arg. Cs. Nat. Zool., 3: 85-153.
- Pereyra, J.A. (1950). Avifauna argentina (contribución a la ornitología). El Hornero, 9 (2): 178–241. (enlace)
- Rasmussen, P.C., N. Collar & G.M. Kirwan (2020). Buff-bellied Puffbird (Notharchus swainsoni), version 1.0. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, and E. de Juana, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.bubpuf1.01
- Saibene, C.A., M. A. Castelino, N.R. Rey, J. Herrera & J. Calo (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina. Literature of Latin America, Buenos Aires, Argentina. 68 pp. ISSN 0328-1620
- Schmidtuz, C., Güller, R., Di Santo, H., Chévez, R., Tahmazian, R. & A. Quinteros (2001). Nuevos registros para Misiones (Argentina) de la Viudita Coluda (Muscipipra vetula) y el Chacurú Grande (Notharchus macrorhynchus). Nuestras Aves, 41: 4. (enlace)
- Short, L.L. (1975). A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History, 154 (3): 165–352. (enlace)
- Short, L.L. (1972). Systematics and Behavior of South American Flickers (Aves, Colaptes). Bulletin of the American Museum of Natural History, 149 (1), New York. 110 pp. (enlace)
- S.I.B. Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina. Ficha: Notharchus swainsoni. Recuperado en mayo 2024 de https://sib.gob.ar/especies/notharchus-swainsoni
- Sick, H. (1993). Birds in Brazil. A Natural History. Princeton University Press, Princeton, NJ, USA. ISBN 0-691-08569-2 (enlace)
- Silveira, L.F., P.F. Develey, J.F. Pacheco, & B.M. Whitney (2005). Avifauna of the Serra das Lontras–Javi montane complex, Bahia, Brazil. Cotinga, 24: 45–54. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A., & D.K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA, and London, UK. 478 pp. ISBN 0-226-77629-8
- Xeno-canto (2024). Ficha: Buco de Swainson · Notharchus swainsoni · (Gray, 1846). Recuperado en mayo 2024 de https://xeno-canto.org/species/Notharchus-swainsoni
-
-
Chacurú grande | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNATIONAL: PREOCUPACIÓN MENOREspecie de amplia distribución, no alcanza los umbrales de vulnerabilidad bajo este criterio ( extensión < 20.000 km² combinada con su declinación o fluctuación, calidad/extensión del hábitat, o tamaño de la población y pequeño número de localizaciones o fragmentación grave)
La tendencia de la población parece ser estable y tampoco alcanza los umbrales de vulnerabilidad bajo los criterios de tendencia de las poblaciones (> 30% declinación en 10 años o 3 generaciones)
El tamaño de la población no ha sido cuantificado, pero tampoco se cree que alcance los niveles de vulnerabilidad según criterio de tamaño de la población (<10.000 individuos maduros con una declinación continua en su número > 10% en 10 años o 3 generaciones)
Por estas razones se considera a esta especie como de “preocupación menor»
Rara en Argentina (Misiones), aunque regularmente se registra en el área de Iguazú.Estado de conservación
Vulnerable (VU): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina (2008:82)
Vulnerable (VU): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
Vulnerable (VU): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Chacurú grande | Distribución
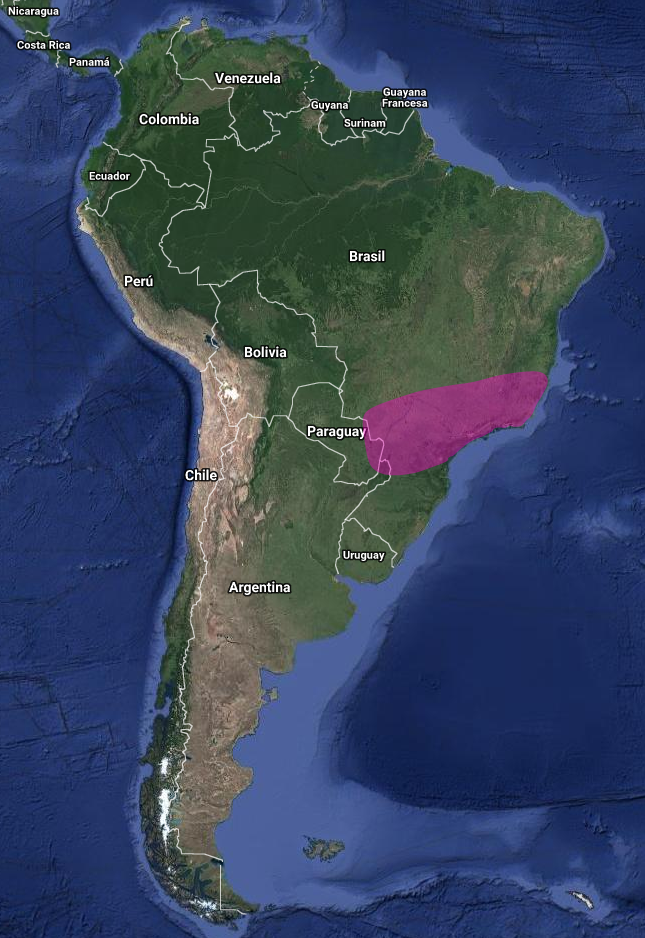
InfoNatura: Animals and Ecosystems of Latin America 2007 Se distribuye en el Sureste de Brasil, desde Espírito Santo hasta Santa Catarina, y se extiende hacia el este hasta Bahía y Mato Grosso do Sul; hacia el oeste hasta el este de Paraguay (localmente rara y poco común en otras regiones, como el Bajo Chaco y Campos Cerrados, así como en el centro de Paraguay (Hayes, 1995:102) y Noreste de Argentina (Misiones) (Oliveira y Arasaki, 2011:6; Cory, 1919:392; Schubart et al., 1965:177; de la Peña, 2020:30; Matthews & Smith, 2017:20; Olrog, 1979:149; Pereyra, 1950:235; de la Peña, 2020:30).
Distribución geográfica en Argentina (de la Peña, 2020:30)
Notharchus swainsoni (Gray, 1846) en Misiones. (Citas y observaciones)Migraciones
Posible migrante de verano, de septiembre a marzo, a la Mata Atlántica en el estado brasileño de São Paulo; Residente en Iguazú, en el extremo Noreste argentino.Hábitat
Esta especie se encuentra típicamente en hábitats de bosque húmedo de tierras bajas, incluyendo el Bosque Atlántico (Barnett & Pearman, 2001:51; de la Peña, 2015:372), así como en áreas de bosque secundario alto y talado. Su rango altitudinal se extiende hasta aproximadamente de 0-900 msnm (del Hoyo, 2020:315; Silveira et al., 2005:52) hasta los 1.300 msnm (Stotz et al., 1996:190). Se ha documentado su presencia en tierras bajas del Bosque Atlántico en el sureste de Brasil (Alexio & Galetti, 1997:251).
Ecorregiones: Selva Paranaense -
Chacurú grande | Comportamiento
Exhibe una serie de comportamientos y hábitos particulares según lo documentado por varias fuentes (Narosky & Chebez, 2002:68; Narosky & Yzurieta, 2010:214; Pereyra, 1950:235). Se ha observado que suele posarse en ramas altas, mostrando un vuelo corto y algo torpe (Narosky & Chebez, 2002:68; Narosky & Yzurieta, 2010:214). Además, tiende a encaramarse en ramas secas o en árboles específicos como el ambay (Cecropia adenopus) (Narosky & Yzurieta, 2010:214).
Suelen observarse en parejas, permaneciendo posados durante períodos prolongados. Además, se señala que si una de las aves es cazada, su compañero tiende a permanecer en el mismo lugar, lo que facilita su captura, lo cual ha dado lugar a la denominación local «Juan zonzo del monte» (Pereyra, 1950:235).
Existe la posibilidad de que esta especie sea migratoria durante el verano, aunque esta información no está completamente clara. Se ha confirmado su residencia en la región de Iguazú, Misiones, lo que sugiere una distribución estable en esta área específica (Pereyra, 1950:235).
Vocalizaciones
Según lo descrito por varias fuentes (Sick, 1993:368; Rasmussen et al., 2020), su voz se caracteriza por ser muy alta y aguda para un ave de su tamaño, con secuencias descendentes de silbos melódicos, a menudo trisilábicos, que pueden ser tanto ascendentes como descendentes y que presentan notables cambios de ritmo. Se describe que estas vocalizaciones pueden sonar como «ui-ui—dibule-dibule...», y se las ha catalogado como llamadas «duras», aunque con cierto grado de melodía (Sick, 1993:368; Rasmussen et al., 2020).
ALIMENTACIÓNEn cuanto a sus hábitos alimenticios, se ha observado que frecuentan cultivos cercanos a sus dormideros, posándose en ramas débiles de árboles bajos y permaneciendo quietos durante largos períodos, a menos que detecten insectos cerca, momento en el cual los capturan y regresan a su posición anterior (Pereyra, 1950:235).
La dieta de esta especie incluye una variedad de insectos y sus larvas, así como pequeños vertebrados y materia vegetal (Rasmussen et al., 2020; Matthews & Smith, 2017:23). Específicamente, se ha observado que los insectos consumidos pertenecen a los órdenes de Orthoptera, Hymenoptera, Hemiptera, Coleoptera y Lepidoptera, con una preferencia por las larvas de Lepidoptera, Coleoptera y Himenópteros, principalmente Vespoidea. Además, se han registrado consumos de Odonata, Orthoptera, Blattodea, Auchenorrhyncha, Mantodea y, en particular de cigarras. Los adultos capturan artrópodos principalmente desde el follaje, detectando presas estacionarias tanto en el follaje como en el sustrato, y luego llevándolas de regreso a su percha favorita o directamente al nido para alimentar a los polluelos. Se ha observado que las perchas de forrajeo son utilizadas repetidamente, aunque no siempre restringidas a la proximidad del nido, ya que los adultos a veces se ausentan del área durante los periodos de observación (Matthews & Smith, 2017:23; de la Peña, 2020:29; Rasmussen et al., 2020). Bodrati & Salvador (2015:82), observaron consumo de termitas (Isoptera, Blattodea) en la provincia de Misiones.
REPRODUCCIÓNSe reproduce durante el período de septiembre a octubre en el sur de su área de distribución (Rasmussen et al., 2020; de la Peña, 2020:29; Bodrati et al., 2010:58; Matthews & Smith, 2017:20). Excava un agujero en nidos de termitas, como se observó en un caso donde se encontró una cavidad a una altura considerable de hasta 12 metros sobre el suelo en Paraguay (Rasmussen et al., 2020).
Durante el proceso de construcción del nido, se observó la presencia de termitas dentro de la cavidad del mismo debido a la perturbación de la estructura por parte de las aves. Posteriormente, se observaron trabajos de reparación llevados a cabo por los insectos. Además, se ha documentado que las aves mantienen una cámara de anidación separada de las áreas de actividad de los insectos, posiblemente como una estrategia para evitar interferencias no deseadas en el proceso reproductivo y el cuidado de las crías (Matthews & Smith, 2017:20)
En Argentina, de la Peña, (2020:29), observó nidos en Misiones, entre noviembre y diciembre, en takurúes y en árboles emergentes; Bodrati et al. (2010:58) nidos en Parque Provincial Cruce Caballero, dpto. San Pedro Misiones, en noviembre y diciembre de 2014 y 2016, en un mismo takurú a gran altura y en un Ybyrá pytá (Peltophorum dubium). También han sido observados adultos con pichones en la provincia de Misiones (Bodrati & Cockle, 2007:291)
La puesta es de cuatro huevos de color blanco (Matthews & Smith, 2017:23; Bodrati et al., 2010:58). El período de incubación oscila entre 14 y 21 días, y el período de emplumado se extiende de 26 a 30 días aproximadamente (Matthews & Smith, 2017:20; Rasmussen et al., 2020). Además, se ha observado que tanto los adultos macho como hembra participan en la incubación, alimentación y defensa del nido, demostrando comportamientos agresivos hacia potenciales depredadores (Bodrati et al., 2010:58; de la Peña, 2020:29).
No existen datos sobre otros aspectos de la reproducción.Depredadores
De huevos: Pteroglossus castanotis en Misiones (Cockle et al., 2016:122); Atacan a tucanes (Ramphastos dicolorus, Pteroglossus bailloni, Pteroglossus castaneus), Cyanocorax chrysops, Ictiniaplumbea, Caracara plancus, e incluso a investigadores cuando se acercan al nido (Bodrati et al., 2010:58).
-
Chacurú grande | Descripción

© Tony Morris. Buff-bellied Puffbird (Notharchus swainsoni). Paraguay, 30 septiembre 2015. Algunos derechos reservados lksjlkajsdlKAJS
-
Chacurú grande | Taxonomía
Nota taxonómica: Según Alvarenga y colaboradores (2002:77), «es una especie perfectamente distinta de su congénere Notharchus macrorhynchos, que se encuentra desde México hasta toda la Amazonia, y por lo tanto debe ser tratada como una especie independiente. Además de la distribución disjunta, estas especies no muestran ninguna intergradación morfológica; Se diferencian entre sí en plumaje, medidas, masa, proporciones. del cráneo y pico, así como las diferencias osteológicas, especialmente en el cráneo, manifestadas por el tamaño y forma de la fosa temporal, altura de las apófisis maxilares de los nasales y distancia (apertura) de los palatinos»
En consecuencia, fueron separadas en dos especies por el South American Classification Committee (SACC) American Ornithologists’ Union, en 2004, mediante la aprobación de la Propuesta N° 124.
Monotípico (del Hoyo, 2020:315; Rasmussen et al, 2020).
-
Chacurú grande (Notharchus swainsoni)

Bucco swainsoni (Gray, GR 1846); Gen. Birds 1 p.74, pl. XXVI Endémico del bosque atlántico, se encuentra desde el sureste de Brasil hasta el este de Paraguay y el extremo noreste de Argentina (Misiones). En general es bastante poco común en gran parte de su área de distribución, excepto quizás en el este de Paraguay (Rasmussen et al, 2020).
Nombres comunes: Buco de Swainson, Chacurú grande (Argentina y Paraguay); Capitán del monte, Chacurú común, Chacurú pecho blanco, Juan del monte; Capitâo do mato, Macuru-de-barriga-castanha (Brasil); En guaraní: «Chakuru guasu» (Pereyra, 1950:234; Chebez, 1996:137; de la Peña, 2020:29).
Protónimo: Bucco swainsoni ( Gray, GR 1846)
En otros idiomas:
Breves apuntes históricos:
- Zoological illustrations, or, Original figures and descriptions of new, rare, or interesting animals : selected chiefly from the classes of ornithology, entomology, and conchology, and arranged on the principles of Cuvier and other modern zoologists. Swainson, William. London: Printed by R. and A. Taylor for Baldwin, Cradock, and Joy; and W. Wood, 1820-1823. Vol 2; Ilustración 99 (Tamatia macrorhynchos)
- Museum ornithologicum Heineanum. Cabanis, J.L., Heine, F. Halbertstadt: In Commission bei R. Frantz, 1850-1863. Vol 4: 151 (Notharchus swainsoni)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London,1874-98. Vol 19: 200 (Nonnula rubecula)
- A monograph of the jacamars and puff-birds, or families Galbulidæ and Bucconidæ. Sclater, Philip Lutley. London, Published for the author by R.H. Porter [etc.,1882]. Página 73; Ilustración XXIII (Bucco swainsoni)
- As aves do Estado de S. Paulo. Ihering, H. von (Hermann). S. Paulo: Typ. a vapor de Hennies irmãos, 1898. Página 297 (Bucco swainsoni Gray)
- Revista do Museu Paulista. São Paulo O Museu, 1895-1988. Vol 22 (1938): 308 (Notharchus swainsoni)
-
Chacurú cara negra| Bibliografía
- Anjos, L. & K.L. Schuchmann (1997). Biogeographical affinities of the avifauna of the Tibagi River Basin, Paraná drainage system, southern Brazil. Ecotropica, 3 (1): 43–65. (enlace)
- ArgentAvis (s.f.). Ficha: Chacurú cara negra (Nystalus chacuru). Recuperado en abril 2024 de http://argentavis.com.ar/2012/sitio/especie_id.php?id=615
- Azara, F. de (1802-1805). Apuntamientos para la Historia Natural de los Páxaros del Paragüay y Río de la Plata. Vol. 3. Viuda de Ibarra, Madrid. (enlace)
- Barnett, J.M. & M. Pearman (2001). Lista comentada de las aves argentinas. Lynx Edicions. 164 pp. ISBN 84-87334-32-6
- Belton, W. (1984:583). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History, 178 (4): 369–636. (enlace)
- BirdLife International (2024) Species factsheet: Nystalus chacuru. Downloaded from https://datazone.birdlife.org/species/factsheet/white-eared-puffbird-nystalus-chacuru on 30/04/2024.
- Bodrati, A., K. Cockle, J.M. Segovia, I. Roesler, J.I. Areta & E. Jordan (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64 (enlace)
- Bodrati, A., Areta J. I. & E. White (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves, 57: 63-80. (enlace)
- Bodrati, A. & S.A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Historia Natural. Tercera Serie, Volumen 5 (1): 77-89. (enlace)
- Brooks, T.M., Barnes, R., Batrina, L., Butchart, S.H.M., Clay, R.P., Esquivel, E.Z., Etcheverry, N.I., Lowen, J.C. & J. Vincent (1993). Bird Surveys and Conservation in the Paraguayan Atlantic Forest. BirdLife Study Report 57. BirdLife International, Cambridge. (enlace)
- Cardoso da Silva, J.M. (1994). Can avian distribution patterns in northern Argentina be related to gallery-forest expansion-retraction caused by Quaternary climatic changes? Auk, 111 (2): 495–499.
(enlace) - Carriker, M.A. (1935). Descriptions of new birds from Bolivia, with notes on other little-known species. Proceedings of the Academy of Natural Sciences of Philadelphia, 87: 313–341. (enlace)
- Chebez, J.C. (1996:138). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía Nº 5. Ed. L. O. L. A. Bs.Aires. 320 pp. ISBN 950-9725-20-X
- Chubb, C.L. (1910). The birds of Paraguay. Ibis, Ser. 9 (4): 53-78. (enlace)
- Contreras, J.R. (1981). Lista preliminar de la avifauna correntina. I. No Passeriformes. Historia Natural, 2: 21-28.
- Cory, C.B. (1924). Catalogue of Birds of the Americas. Publications of the Field Museum of Natural History, Zoological Series, 13 (3): 309. (enlace)
- Crozariol, M.A. & F.B.R. Gomes (2010). Insetívoro our oportunista? A dieta do joão-bobo, Nystalus chacuru (Galbuliformes: Bucconidae). Atualidades Orn, 154: 14-15. (enlace)
- de la Peña M.R. (1999). Aves Argentinas. Lista y Distribución. Ed. L.O.L.A. (Literature of Latin America). Monografía N.º 18. 244 pp. Buenos Aires. ISSN 0328-1620
- de la Peña, M.R. (2013). Nidos y reproducción de las aves argentinas. Ediciones Biológica. Serie Naturaleza, Conservación y Sociedad N° 8. Santa Fe, Argentina. 590 pp. ISBN 978-987-27043-7-7
- de la Peña, M.R. (2015). Aves Argentinas. Incluye nidos y huevos. 1º Ed. Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña M.R. & S. Salvador (2016); Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), Vol. 20 (2): 1-620. ISSN 0325-3856
- de la Peña, M.R. (2020); Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución (Actualización). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), N° 7: 1-344. ISSN 0325-3856
- Di Giacomo A.S. & O.A. Spitznagel (2007). Cuenca del río Aguapey. En Di Giacomo, A.S., M.V. De Francesco & E.G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 149-151 Temas de Naturaleza y Conservación 5. CD-ROM. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- del Hoyo, J. ed. (2020). All the Birds of the World. Lynx Edicions. Barcelona, España. 967 pp. ISBN 978-84-16728-37-4
- Dubs, B. (1992). Birds of Southwestern Brazil: Catalogue and Guide to the Birds of the Pantanal of Mato Grosso and its Border Areas. Betrona Verlag, Kusnacht, Switzerland. (enlace)
- Eckelberry, D.R. (1962). The White-eared Puffbird. Auk, 78 (1): 1-2. (enlace)
- Giraudo, A.R., J.L. Baldo & R.R. Abramson (1993). Aves observadas en el sudeste, centro y este de Misiones (República Argentina), con la mención de especies nuevas o poco conocidas para la provincia. Nótulas Faunísticas, 49: 1-13. (enlace)
- Gomes, F.B.R. (2009). Perigoso, mas gostoso: registro da predação de duas espécies de “sapos-verdadeiros” por aves. Atualidades Orn., 151: 8-9. (enlace)
- Hayes, F.E. (1995). Status, Distribution and Biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, CO, USA. 224 pp. ISBN: 1-878788-30-2
- Hellmayr, C.E. (1929). A contribution to the ornithology of northeastern Brazil. Field Museum of Natural History (Zoological Series), 12 (18): 235–501. (enlace)
- Krauczuk, E.R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Christi, San Ignacio, Misiones, Argentina. Lundiana, 9 (1): 21-31. (enlace)
- Lepage, D. (s.f.) Avibase. La base de datos World Bird. Ficha: Bucco chacurú –Nystalus chacuru (Vieillot, 1816)- Recuperado en abril 2024 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=10A7647897A0CCDB
- Martínez Gamba, R. (2014). Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones, Argentina. Nótulas Faunísticas. Segunda Serie, 163: 1-10. (enlace)
- Narosky, T. & J.C. Chebez (2002). Aves de Iguazú: guía de identificación. 1º Ed. Vázquez Mazzini Editores, Buenos Aires. 128 pp. ISBN 987-9132-04-1
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. ISBN 950-99063-6-0
- Navajas Artaza, A. (1977). Nystalus chacuru. Hornero, 11 (5): 436-437 (enlace)
- Nores, M. (1994). Quaternary vegetational changes and bird differentiation in subtropical South America. Auk, 111 (2): 499-503. (enlace)
- Olrog, C.Ch. (1959). Las aves argentinas. Una guía de campo. Universidad Nacional de Tucumán. Instituto «Miguel Lillo». Tucumán, Argentina.
- Olrog, C.Ch. (1979). Nueva Lista de la Avifauna Argentina. Ministerio de Cultura y Educación. Fundación Miguel Lillo. Ópera Lilloana, 27. 324 pp. ISSN 0078-5245
- Parker, T.A. III & B. Bailey (Editors) (1991). A biological assessment of the Alto Madidi region and adjacent areas of northwest Bolivia, May 18-June 15, 1990. Rapid Assessment Program Working Papers 1. Conservation International, Washington, DC, USA. (enlace)
- Parker, T.A., S.A. Parker & M.A. Plenge (1982). An Annotated Checklist of Peruvian Birds. Buteo Books, Vermillion, SD, USA. ISBN 0-931130-07-7 (enlace)
- Partridge, W.H. (1954). Estudio preliminar sobre una colección de aves de Misiones. Rev. Mus. Arg. Cs. Nat. Zool. 3: 85-153.
- Pearman, M. (1993). The avifauna of the Río Machariapo dry forest, northern La Paz department, Bolivia: a preliminary investigation. Bird Conservation International, 3 (2): 105–117. (enlace)
- Planqué, B., Vellinga, W-P., Pieterse, S. Jongsma, J. & Rolf de By (2024). Xeno-canto Foundation. Ficha: Buco chacurú · Nystalus chacuru · (Vieillot, 1816). Recuperado en abril 2024 de https://xeno-canto.org/species/Nystalus-chacuru
- Rasmussen, P.C., N. Collar & G.M. Kirwan (2020). White-eared Puffbird (Nystalus chacuru), version 1.0. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, and E. de Juana, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.whepuf1.01
- Raw, A. (1997). Avian predation on individual Neotropical social wasps (Hymenoptera, Vespidae) outside their nests. Orn. Neotropical, 8 (1): 89–92. (enlace)
- Remsen, J.V. (1986). Aves de una localidad en la sabana húmeda del norte de Bolivia. [Birds at a wet savanna locality in the north of Bolivia]. Ecol. Bol. (Rev. Inst. Ecol.), 8: 21–35. (enlace)
- Saibene, C.A., M.A. Castelino, N.R. Rey, J. Herrera & J. Calo (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina. Literature of Latin America, Buenos Aires, Argentina. 76 pp. ISSN 0328-1620
- Scherer-Neto, P. & F. Costa-Straube (1995). Aves do Paraná : (história, lista anotada e bibliografia). Curitiba: Ed. dos autores. 79 pp. (enlace)
- Schmitt, C.G., D.C. Schmitt & J.V. Remsen (1997). Birds of the Tambo area, an arid valley in the Bolivian Andes. In Studies in Neotropical Ornithology Honoring Ted Parker (J.V. Remsen, Jr., Editor). Ornithological Monographs, 48: 701–716. (enlace)
- Schubart, O., A.C. Aguirre & H. Sick (1965). Contribuição para o conhecimento da alimentação das aves brasileiras. Arquivos de Zoologia do Estado de São Paulo, 12: 95–249. (enlace)
- Schulenberg, T.S., D.F. Stotz, D.F. Lane, J.P. O’Neill & T.A. Parker (2007). Birds of Peru. Princeton University Press, Princeton, NJ, USA. ISBN 978-0-691-13023-1
- Sclater, P.L. & O. Salvin (1879). On birds collected in Bolivia by Mr. C. Buckley. Proceedings of the Zoological Society of London, 1879: 588–645. (enlace)
- SIB. Sistema de información de Biodiversidad de la Administración de Parques Nacionales, Argentina. Ficha: Nystalus chacuru chacuru (Vieillot, 1816). Recuperado en abril 2024 de https://sib.gob.ar/especies/nystalus-chacuru
- Sick, H. (1993). Birds in Brazil. A Natural History. Princeton University Press, Princeton, NJ, USA. (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brazil. 912 pp. ISBN 85-209-0816-0
- Silveira, M.B. & M.Â. Marini (2012). Timing, duration, and intensity of molt in birds of a Neotropical savanna in Brazil. Condor, 114 (3): 435–448. (enlace)
- Stotz, D.F., J.W. Fitzpatrick, T.A. Parker & D.K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, Illinois, USA, and London, UK. 478 pp. ISBN 0-226-77630-1
- Straneck, R. (1990). Canto de las aves de Misiones II. L.O.L.A. Buenos Aires.
- Willis, E.O. (1992). Zoogeographical origins of eastern Brazilian birds. Ornitología Neotropical, 3 (1): 1-15. (enlace)
- Willis, E.O. & Y. Oniki (1991). Avifaunal transects across the open zones of northern Minas Gerais, Brazil. Ararajuba, 2:41–58. (enlace)
- Zotta, A.R. (1938). Lista sistemática de las aves argentinas. Hornero, 7 (1): 89-124 (enlace)
-
Chacurú cara negra | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNATIONAL: PREOCUPACIÓN MENOR.No está globalmente amenazado. Especie de amplia distribución, no alcanza los umbrales de vulnerabilidad bajo los siguiente criterios: < 20.000 km² junto con una disminución o fluctuación del rango, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de poblaciones y/o grave fragmentación de las poblaciones.
La tendencia de la población parece ser estable y las especies no alcanzan los umbrales de Vulnerabilidad de acuerdo con los criterios de tendencia de la población (declinación > 30% en 10 años o 3 generaciones).
El tamaño de la población no ha sido cuantificado, pero no se estima que alcance los umbrales de Vulnerabilidad con respecto a los criterios de tamaño de población (< 10.000 individuos maduros con una declinación continua estimada que sea > 10% en 10 años o 3 generaciones, o con una estructura de la población específica)
Por estas razones la especie es evaluada como: Preocupación menor. (Birdlife International, 2024)En Argentina: (SIB, 2024)
Estado de conservación:
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1º ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas) .Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Chacurú cara negra | Distribución

InfoNatura: Animals and Ecosystems of Latin America 2007 El Nystalus chacuru se encuentra en Perú, Brasil, Paraguay, Bolivia y Argentina (Cory, 1924:399; Zotta, 1938:91; Crozariol & Gomes, 2010:4; del Hoyo, J., 2020:315; Dubs, 1992:64; Eckelberry, 1962:1; Hellmayr, 1929:427; Stotz et al., 1996:325)
Se distribuye desde NE al Este de Perú, donde es poco común y local (Valle de Mayo, los Valles de Apurímac y Urubamba y las Pampas del Heath) (Parker et al., 1982:48; Anjos & Schuchmann, 1997:59; Schulenberg et al., 2007:266; Rasmussen et al, 2020).
En Brasil común en partes del sudeste y centro de Brasil (por ejemplo, Bahía, Distrito Federal), de presencia moderada en Rio Grande do Sul, bastante común en Mato Grosso; presente en varias áreas protegidas: Parque Nacional Itatiaia, el Parque Nacional Serra da Canastra, el Parque Nacional Brasilia, el Parque Nacional Emas y el Parque Nacional Chapada dos Guimarães (Belton, 1984:583; Willis & Oniki, 1991:46; Willis, 1992:14; Dubs, 1992:64; Scherer-Neto. & Costa-Straube, 1995).
Presente en Paraguay (Chubb, 1910:276; Brooks et al., 1993; Hayes, 1995:68) y bastante común en Bolivia (Sclater & Salvin, 1879:633; Carriker, 1935:319; Remsen, 1986:30; Parker & Bailey, 1991:53; Pearman, 1993:114; Schmitt et al., 1997:706).
Distribución en Argentina (Tabla de citas) Poco común en Argentina (Misiones y Corrientes) (Partridge, 1954; Olrog, 1959:169; Olrog, 1979:500; de la Peña & Salvador, 2016:30; Cory, 1924:399; Zotta, 1938:91; Crozariol & Gomes, 2010:4; del Hoyo, J., 2020:315; Dubs, 1992:64; Eckelberry, 1962:1; Hellmayr, 1929:427; Stotz et al., 1996:325)
Hábitat: se lo encuentra en estrato medio y borde de bosque seco tropical, segundo crecimiento, bosque de galería, bosque abierto, pastizal arbolado, campos, cerrado, sabana tropical, matorral, claros (Eckelberry, 1962:1), pastizales, campo abierto con vegetación dispersa; también campos de cultivo (por ejemplo, cafetales) que bordean las vías del ferrocarril, calles arboladas en los suburbios rurales (Sick, 1997:487; Chubb, 1910:276; Nores, 1994:500; Cardoso da Silva, 1994:495;; de la Peña & Salvador, 2016:30; Rasmussen et al, 2020; del Hoyo, J., 2020:315; Dubs, 1992:64; Sick, 1997:487).
Desde tierras bajas hasta los 1400 msnm. Hasta 2500 msnm localmente en Bolivia (Stotz et al., 1996:190) y registrado hasta 2200 msnm en Perú (Schulenberg et al., 2007:266)
Ecorregiones: Selva Paranaense y sabana mesopotámica (Barnett & Pearman, 2001:51)