- Antelo, C. M., Brandán, Z. J., Navarro, C. I., & Marigliano, N. L. (2006). Avifauna de un sector de bosque en Las Tipas (Tucumán, Argentina). Acta Zoológica Lilloana, 50(1-2): 41-46.
- Antelo, C. M. & Brandán Fernández, Z. J. (2013). Las aves no passeriformes de Tucumán, Argentina. Miscelánea 132, Fundación Miguel Lillo, Argentina. (enlace)
- ArgentAvis (s.f.): Ficha especie: Atajacaminos colorado (Antrostomus rufus). Recuperado el 10 noviembre 2022 de http://argentavis.com.ar/2012/sitio/especie_co.php?id=679
- Babarskas, M., J. O. Veiga & F. C. Filiberto (1995). Inventario de Aves del Parque Nacional El Rey, Salta, Argentina. Monografía Especial L. O. L. A. No 6, 44 Págs. Buenos Aires.
- Belcher, C. & G. D. Smooker (1936). Birds of the colony of Trinidad and Tobago. Part III. Ibis 78: 1-35.
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178(4): 369–636. (enlace)
- BirdLife International (2022) Species factsheet: Antrostomus rufus. Downloaded from http://www.birdlife.org on 12/11/2022.
- Bodrati, A., & Areta, J. I. (2010). Dos nuevos dormilones para la avifauna argentina (Chordeiles acutipennis y Caprimulgus maculicaudus) y comentarios sobre hábitat, comportamiento y geonemia en Paraguay. El Hornero, 25(2): 67-73. (enlace)
- Bodrati, A., Cockle, K., Segovia, J. M., Roesler, I., Areta, J. I., & Jordan, E. (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A. & S. A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Historia Natural. Tercera Serie Volumen 5 (1): 77-89. (enlace)
- Bodrati, A., & Cockle, K. L. (2018). Reproductive biology and distribution of the Silky-tailed Nightjar (Antrostomus sericocaudatus) in Argentina. Ornitología Neotropical, 29: 1-11. (enlace)
- Borges, S. H. (2004). Species poor but distinct: bird assemblages in white sand vegetation in Jaú National Park, Brazilian Amazon. Ibis, 146: 114-124.
- Brandán, Z. J. & Navarro, C. I. (2009). Lista actualizada de las aves de la provincia de Tucumán. Bird Checklist. Publicación especial, Fundación Miguel Lillo, Tucumán, Argentina. (enlace)
- Burgos, F. G., Baldo, J. L. & Cornell, F. M. (2009). Lista de las Aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. SS de Jujuy. (enlace)
- Camperi, A. R. (1990). Notas sobre una colección de aves del Río Santa María, Salta, Argentina. El Hornero, 13: 147-153. (enlace)
- Chatellenaz, M. L. (2005). Aves del Valle del Río Paraná en la provincia del Chaco, Argentina: riqueza, historia natural y conservación. Miscelánea, 14, 528. (enlace)
- Chatellenaz, M. L., P. Cano, C. Saibene & H. A. Ball (2010). Inventario de las aves del Parque Nacional Mburucuyá (provincia de Corrientes, Argentina). Acta Zool. Lilloana 54: 139-160. (enlace)
- Chébez, J. C. (1996). Fauna Misionera. Catálogo Sistemático y Zoogeográfico de los Vertebrados de la Provincia de Misiones (Argentina). Ed. L.O.L.A. (Literature of Latin America) (1º Ed.), Monografía N.º 5. Buenos Aires, Argentina. 320 pp. I.S.B.N. 950-9725-20-X
- Chebez, J. C., N. R. Rey, M. Babarskas & A. G. Di Giacomo (1998). Las aves de los Parques Nacionales de la Argentina. Monografía Especial L.O.L.A. No 12, 126 págs. Bs.As.
- Cintra, R. & C. Yamashita (1990). Habitats, Abundancia e Ocorrência das Espécies de Aves do Pantanal de Poconé, Mato Grosso, Brasil. Pap. Avulsos Zool., 37 (1): 1-21. (enlace)
- Cleere, N. (1998). Nightjars. A guide to the nightjars, nighthawks, and their relatives. Yale University Press, New Haven, Connecticut. (enlace)
- Cobos, V., Miatello, R. & Baldo, J. (1999). Algunas especies de aves nuevas y otras con pocos registros para la provincia de Córdoba. Argentina. II. Nuestras Aves, 39, 7-11. (enlace)
- Coconier, E. G., López Lanús, B., Roesler, I., Moschione, F., Pearman, M., Blendinger, P., Bodrati, A., Monteleone, D., Casañas, H., Pugnali, G. & M. E. Alvarez (2007). Lista comentada de las aves silvestres de la unidad de gestión Acambuco. Pp: 32-103. En Coconier, E. G. (Ed.). Las aves silvestres de Acambuco, Provincia de Salta, Argentina. Temas de Nat. y Cons. No 6. Nuestras Aves A.O.P. (enlace)
- Contreras, J. R. (1987). Lista preliminar de la avifauna de la Provincia de Formosa, República Argentina. Historia Natural, 7(4): 33-52.
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti & E. E. Utges (1990). Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Volume 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1.
- Contreras Roqué, J. R., Agnolin, F., Davies, Y. E., Godoy, I., Giacchino, A. & Ríos, E. E. (2014). Atlas ornitogeográfico de la Provincia de Formosa, República Argentina. (1º Ed.) Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 p. (enlace)
- de la Peña, M. R. (1996). Nuevos registros o aves poco citadas para las provincias de Santa Fe y Entre Ríos, Argentina. El Hornero, 14(3): 87-89. (enlace)
- de la Peña, M. R. (1999). Aves Argentinas. Lista y distribución. Monografía N.º 18; Ed. L.O.L.A. (Literature of Latin America), Buenos Aires, Argentina.
- de la Peña, M. R. (2015). Aves argentinas. Incluye nidos y huevos. (1º Ed.) Ediciones UNL, Santa Fe; EUDEBA, CABA, Argentina; 496 pp.
- de la Peña, M. R. (2020). Aves argentinas. Descripción, Comportamiento, Reproducción y Distribución (ACTUALIZACIÓN). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Año 2020 | N° 6 | Pág. 1-348| ISSN 0325-3856
- Diamond, A. W. (1973). Habitats and feeding stations of St Lucia forest birds. Ibis 115: 313-329.
- Dickinson, E. C. (editor) (2003). The Howard and Moore complete checklist of the birds of the world. Third edition. Princeton University Press, New Jersey. 241 (enlace)
- Di Giacomo, A. G. & B. López Lanús (1998). Aportes sobre la nidificación de veinte especies de aves del noroeste argentino. El Hornero 15: 29-38. (enlace)
- Dubs, B. (1992). Birds of Southwestern Brazil: Catalogue and Guide to the Birds of the Pantanal of Mato Grosso and its Border Areas. Betrona Verlag, Kusnacht, Switzerland. (enlace)
- ffrench, R. P. (1991). A Guide to the Birds of Trinidad and Tobago. 2nd edition. Comstock Publishing Associates, Ithaca, NY, USA. (enlace)
- Fraga, R. M. (2001). The avifauna of Estancia San Juan Poriahú, Iberá Marshes, Argentina: checklist and some natural history notes. Cotinga, 16: 81-86. (enlace)
- Giannini, N. P. (1999). La interacción de aves-murciélagos-plantas en el sistema de frugivoría y dispersión de semillas en San Javier, Tucumán, Argentina. Tesis doctoral, Facultad de Ciencias Naturales e Instituto M. Lillo, Universidad. Nacional de Tucumán, Tucumán, Argentina. (enlace)
- Giraudo, A. R., Bortoluzzi, A. & Arzamendia, V. (2006). Vertebrados tetrápodos de la Reserva y Sitio Ramsar “Esteros del Iberá” (Corrientes, Argentina): Análisis de su composición y nuevos registros para especies amenazadas. Natura Neotropicalis, 37(1-2): 1-20. (enlace)
- Greenway, J. C., Jr. (1958) Extinct and vanishing birds of the world. Special Publication 13. American Committee for International Wild Life Protection, New York, New York, USA.
- Han, K., M. B. Robbins & M. J. Braun (2010). A multi-gene estimate of phylogeny in the nightjars and nighthawks (Caprimulgidae). Molecular Phylogenetics and Evolution 55: 443-453. (enlace)
- Hartert, E. & S. Venturi (1909). Notes sur les oiseaux de la République Argentine. Novit. Zool. 16: 159-267. (enlace)
- Hayes, F. E. (1995). Status, Distribution and Biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, CO, USA. (enlace)
- Hilty, S. L. (2003). Birds of Venezuela. Second edition. Princeton University Press, Princeton, New Jersey.
- Hilty, S. L. & W. L. Brown (1986). A guide to the birds of Colombia. Princeton University Press, Princeton, New Jersey.
- Holyoak, D. T. (2001). Nightjars and their allies: the Caprimulgiformes. Oxford University Press, Oxford, United Kingdom, and New York, New York.
- Kiff, L. F. (1975). Notes on southwestern Costa Rican birds. Condor. 77(1): 101–103. (enlace)
- Krauczuk, E. R. (2005). Aves do Inta-Campo Anexo ao Zaiman, e do Campus da Universidade Nacional de Misiones, Posadas, Misiones, Argentina. Atualidades Ornitológicas, 126: 17-39. (enlace)
- Krauczuk, E. R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Christi, San Ignacio, Misiones, Argentina. Lundiana: International Journal of Biodiversity, 9(1): 29-39. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Ficha Especie: Chotacabra castaña (Antrostomus rufus, Boddaert, 1783); Recuperado el 10 noviembre 2022 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=C6B09772
- López-Lanús, B., Grilli, P., Coconier, E., Di Giacomo, A. & Banchs, R. (2008). Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas/AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina, 64. (enlace)
- Lucero, M. M. (1983). Lista y distribución de aves y mamíferos de la provincia de Tucumán. Miscelánea No 75. Fund. M. Lillo. Tucumán. Págs. 61.
- Manassero, M., H. Luna & L. Acquaviva (2006). Nuevos registros de aves para Santa Fe, Argentina. Parte II. Nuestras Aves 51: 29-31. (enlace)
- Mazar Barnett, J. & M. Pearman (2001). Lista comentada de las aves Argentinas / Annotated checklist of the birds of Argentina. Lynx Edicions, Barcelona.
- Meyer de Schauensee, R. & W. H. Phelps (1978). A Guide to the Birds of Venezuela. Princeton University Press, Princeton, NJ, USA. (enlace)
- Militello, E. & Chébez, J. (2009). Notas sobre Aves del Parque Nacional Iguazú y Zona de Influencia, Misiones, Argentina. Nótulas Faunísticas (segunda serie), 32: 1-5. (enlace)
- Moschione, F. & L. Bishels (2004). Listado de las aves del Parque Provincial Loro Hablador, provincia del Chaco. Informe Técnico. Proyecto Elé/DFS. Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F. N. & Segovia, J. (2005). Listado de las aves de la Reserva Natural Las Lancitas, Santa Bárbara, Jujuy. Informe técnico Proyecto Elé/DFS, Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F., O. Spitznagel & M. González (2012). Lista de Aves de Salta (Birds Checklist). Ministerio de Cultura y Turismo. Salta. (versión octubre 2012) (enlace)
- Múnera-Roldán, C., M. L. Cody, R. H. Schiele-Zavala, B. J. Sigel, S. Woltmann & J. P. Kjeldsen (2007). New and noteworthy records of birds from south-eastern Nicaragua. Bulletin of the British Ornithologists Club 127: 152-161. (enlace)
- Narosky, T. & Chébez, J. C. (2002). Aves de Iguazú: Guía para la identificación. 1º Ed. Vázquez Mazzini Editores; Buenos Aires, Argentina; 128 pp.
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. 432 pp.
- Navarro, C. I., Brandán, Z. J., Antelo, C. M. & Marigliano, N. L. (2000). Avifauna invernal en una localidad del Bosque Chaqueño Serrano (Las Tipas, Tucumán, Argentina). Acta Zoológica Lilloana, 45(2): 233-240.
- O’Connor, R. S. & G. Ritchison (2013). Notes on the incubation, brooding, and provisioning behavior of Chuck-will’s-widows. Wilson Journal of Ornithology 125:815-819.
- Olrog, C. Ch. (1959). Las Aves Argentinas. Una Guía de Campo. Universidad Nacional de Tucumán. Instituto “Miguel Lillo”. Argentina. 343 pp.
- Olrog, C. Ch. (1984). Las aves argentinas. Una guía de campo. Administración de Parques Nacionales. 352 pp. (enlace)
- Oren, D. C. & T. A. Parker (1997). Avifauna of the Tapajós National Park and vicinity, Amazonian Brazil. In Studies in Neotropical ornithology honoring Ted Parker (J. V. Remsen, Editor). Ornithological Monographs 48: 493–525. (enlace)
- Ortiz, D., Aráoz, R. & Alderete, C. (2011). Lista sistemática de las aves de la Reserva Experimental Horco Molle, provincia de Tucumán, Argentina. Nótulas Faunísticas, Segunda Serie, 62: 1-5. (enlace)
- Ortiz, D. & R. Aráoz (2014). Aves de la Sierra de San Javier. Universidad Nacional de Tucumán.
- Ortiz, D., Pastur, E. M., Juliá, J. & Quiroga, P. (2018). Lista de aves de la Reserva Privada San Pablo, provincia de Tucumán, Argentina. Nótulas Faunísticas (segunda serie), 246: 1-8. (enlace)
- Pagano, L. G. & S. A. Salvador (2017). Datos de pesos de aves Argentinas. Parte 4. Historia Natural 7:21–43. (enlace)
- Peters, J. L. (1940). Check-list of birds of the world. Volume IV. Harvard University Press, Cambridge, Massachusetts. (enlace)
- Planqué, R., Vellinga, W. P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Ficha especie: Antrostomus rufus (Boddaert, 1783); Recuperado el 14 noviembre de 2022 de https://xeno-canto.org/species/Antrostomus-rufus
- Raffaele, H. A., J. Wiley, O. Garrido, A. Keith & J. Raffaele (1998). A Guide to the Birds of the West Indies. Princeton University Press, Princeton, NJ, USA.
- Ridgely, R. S. & J. A. Gwynne (1989). A Guide to the Birds of Panama with Costa Rica, Nicaragua, and Honduras. Second edition. Princeton University Press, Princeton, NJ, USA.
- Ridgway, R. (1914). The birds of North and Middle America. Part VI. Bulletin of the United States National Museum 50, part 6. (enlace)
- Robbins, M. B. & Parker, T. A. (1997). Voice and taxonomy of Caprimulgus (rufus) otiosus (Caprimulgidae), with a reevaluation of Caprimulgus rufus subspecies. Pp. 601–607 in: Remsen, J.V. ed. (1997). Studies in Neotropical Ornithology Honoring Ted Parker. Ornithological Monographs 48. American Ornithologists’ Union, Washington, D.C. (enlace)
- Rohwer, S. A. (1971). Molt and the annual cycle of the Chuck-will’s-widow, Caprimulgus carolinensis. Auk 88: 485-519. (enlace)
- Rumelt, R. (2020). Rufous Nightjar (Antrostomus rufus), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.rufnig1.01
- SAAC. (2010). Proposal (466) to South American Classification Committee. Recuperado en noviembre 2022 de https://www.museum.lsu.edu/~Remsen/SACCprop466.htm
- Salvador, S. A., A. Bodrati & L. A. Salvador (2014). Aportes al conocimiento de la reproducción del Atajacaminos colorado (Antrostomus rufus) en Argentina. Nuestras Aves 59: 54-57. (enlace)
- Salvador, S. A. (2016). Distribución Reproductiva de las Aves de Argentina y sus Territorios. Recopilación Inédita. Edición del Autor, Córdoba. (enlace)
- Salvin, O. & E. Hartert (1892). Catalogue of the birds in the British Museum. Volume 16. British Museum (Natural History), London. (enlace)
- Schulenberg, T. S., D. F. Stotz, D. F. Lane, J. P. O’Neill & T. A. Parker III. (2010). Birds of Peru. Revised and updated edition. Princeton University Press, Princeton, New Jersey.
- Short, L. L. (1975). A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History 154(3):165–352. (enlace)
- Sibley, C. G. & Monroe, B. L. (1990). Distribution and taxonomy of birds of the world. Yale University Press, Connecticut. (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brazil.
- Sigurdsson, S. & J. Cracraft (2014). Deciphering the diversity and history of New World nightjars (Aves: Caprimulgidae) using molecular phylogenetics. Zoological Journal of the Linnean Society 170: 506-545. (enlace)
- Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina (s.f.); Ficha especie: Atajacaminos colorado (Antrostonmus rufus); recuperado el 10 noviembre 2022 de https://sib.gob.ar/especies/antrostomus-rufus
- Slud, P. (1964). The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History 128:1–430. (enlace)
- Stiles, F. G. & A. F. Skutch (1989). A Guide to the Birds of Costa Rica. Christopher Helm, London, UK. (enlace)
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker & D. K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA, and London, UK.
- Wetmore, A. (1968). The Birds of the Republic of Panama. Part 2. Columbidae (Pigeons) to Picidae (Woodpeckers). Smithsonian Miscellaneous Collections 150. Smithsonian Institution, Washington, D.C. 605 pp. (enlace)
- Wetmore, A. & Phelps, W. H. (1953). Notes on Rufous Goatsuckers of Venezuela. Proceedings of the Biological Society of Washington, 60:15-20. (enlace)
- Zyskowski, K., M. B. Robbins, A. T. Peterson, K. S. Bostwick, R. P. Clay & L. A. Amarilla (2003). Avifauna of the northern Paraguayan Chaco. Ornitología Neotropical 14: 247-262. (enlace)
-
-
Atajacaminos colorado | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR
Esta especie tiene un rango de distribución extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). A pesar que la población parece estar disminuyendo, esta declinación no se cree que sea lo suficientemente rápida para alcanzar los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población no ha sido cuantificada, pero no se cree que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como bastante “común” y de “preocupación menor” (Stotz et al., 1996:174; del Hoyo, 2020:119; BirdLife International, 2022)
Se estima que la población es de 5-50 millones de individuos maduros y que la pequeña disminución de la población es causada por la destrucción del hábitat.ARGENTINA (S.I.B.)
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs (2008:47) Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Atajacaminos colorado | Distribución
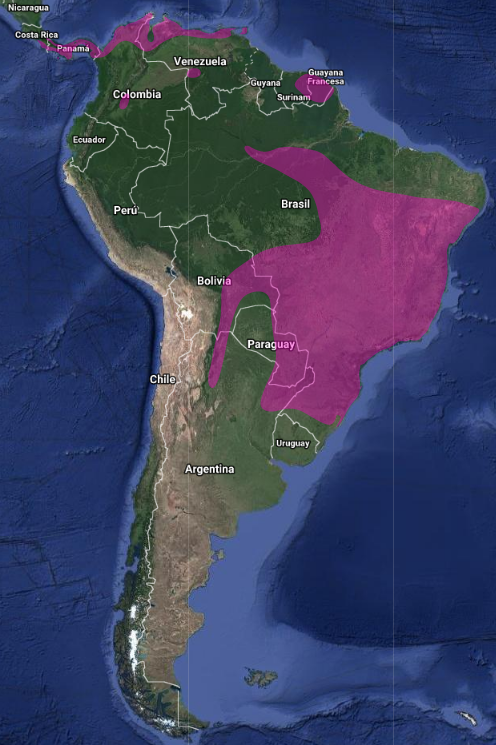
InfoNatura: Animals and Ecosystems of Latin America 2007 Endémico de América. La distribución se extiende desde el sur de América Central (Costa Rica – (Slud, 1964:138; Ridgely & Gwynne, 1989:195; Kiff, 1975:101; Stiles & Skutch, 1989:202) y recientemente registrado en el sureste de Nicaragua (Múnera-Roldán et al., 2007:155), noreste de Santa Lucía en las Antillas Menores (Raffaele et al., 1998:102), Trinidad y Tobago (ffrench, 1991:209) hasta Panamá y desde allí se distribuye en América del Sur tropical extraandina hasta Bolivia, Paraguay, sudeste de Brasil y norte de la Argentina (Stotz et al., 1996:316; de la Peña, 2020:250; de la Peña, 2015:330; Contreras et al., 2014:311)
En Venezuela es residente y bastante común localmente, aunque no se han comprobado movimientos estacionales. Probablemente el A. r. rutilus sea migrante austral durante el invierno desde Argentina y sur de Brasil (Hilty, 2003:376),
En Colombia (de la Peña, 2020:250); En Brasil registrado en centro de Amazonia (Oren & Parker, 1997:504), Belton, (1984: 561) para Rio Grande do Sul, Dubs, (1992:53) lo registra como común en cerrado y áreas cultivadas en los bordes del suroeste de Brasil; de abril a octubre registrado en región de Poconé (Pantanal-Mato Grosso) por Cintra & Yamashita (1990:12). El A. r. rutilus migra desde Mato Grosso y Río de Janeiro a Paraguay y norte de Argentina.
En Paraguay, según Contreras et al (2014:310), la información es insuficiente para establecer con claridad si es residente permanente, o si migra en los meses invernales en toda o en parte de su geonemia. Podría faltar en los meses más fríos. Anidaría localmente. Aunque Hayes (1995:66) lo considera residente, nidificante y poco común en campos cerrados, alto Paraná y Paraguay central y raro en Ñeembucú.
En Perú es raro y local; generalmente en valles secos (300-1650 m) aunque también en sitios húmedos (Schulenberg et al., 2010:204)
En Panamá se distribuye sobre colinas de la pendiente sobre el canal y al este de la provincia de Panamá; sobre la pendiente del Pacífico es menos numeroso aunque sobre la pendiente del Caribe solo se encuentra en el área del canal. Se reproduce entre finales de enero y principios de mayo (Ridgely & Gwynne, 1989:195).
Los movimientos del A. rufus no se conocen bien. Las especies de más al sur (A.r. rutilus), del norte de Argentina y sur de Brasil, migran hacia el norte durante el invierno austral y tal vez alcancen la costa del Caribe. También se sospecha que el A. r. saltarius, del noroeste de Argentina, puede ser migratorio. Las otras especies se considera que son sedentarias (ffrench, 1991:209).DISTRIBUCIÓN EN ARGENTINA (Contreras et al., 2014:311; de la Peña, 2020:250; de la Peña, 2015:330; Bodrati & Areta, 2010:68)
Según comentan Contreras et al. (2014:310), en Argentina es una especie que está mucho más extensamente distribuida en las zonas húmedas del este y apenas si llega, en forma muy dispersa y puntual a áreas chaqueñas secas, contando con algunos registros en el Chaco Boreal paraguayo y otros en el este de la Provincia de Chaco (Contreras et al., 1990:129) y en el norte de la de Santa Fe (Hartet & Venturi, 1909:224). Según Short (1975:236) la especie faltaría en la zona más seca del área chaqueña argentina.
Antrostomus rufus rutilus (Burmeister, 1856)
Según Short (1975: 236) la subespecie A. r. rutilus está bastante débilmente definida, con presencia en las Provincias de Misiones, norte de Corrientes, Chaco, Formosa, Tucumán, Jujuy, el noreste de Santa Fe, y noreste de Córdoba (de la Peña, 2020:250).
Antrostomus rufus saltarius (Olrog, 1979:135)
En Argentina: Jujuy, Salta, Tucumán, Santiago del Estero y Catamarca (Olrog, 1979:135; de la Peña, 2020:250; de la Peña, 2015:330; Salvador, 2016:98).HÁBITAT
A través de su amplio rango de distribución ocupa una gran variedad de bosques primarios como de segundo crecimiento (Meyer de Schauensee, 1978:123), desde hábitats secos en la región del Alto Chaco (Zyskowski et al., 2003:651) a húmedos en la cuenca del Amazonas (Borges 2004); también de distribuye a través de amplio gradiente de vegetación, desde bosques abiertos en la región del Chaco a bosques de matorrales densos en Costa Rica en la mitad sur de la vertiente del Pacífico (Kiff, 1975:101). En Santa Lucía la subespecie otiosus se encuentra predominantemente en zona de matorrales de tierras bajas secas (Robbins & Parker, 1997:603). También ha sido registrado en hábitats alterados por el hombre, como jardines suburbanos. Desde el nivel del mar hasta los 1.800 msnm (Cleere, 1998:198; de la Peña, 2020:249; de la Peña, 2015:330; Narosky e Yzurieta, 2010:192; Stotz et al., 1996:174).
Ecorregiones: Chaco húmedo; Chaco seco; Esteros del Iberá; Selva de Yungas; Selva Paranaense (Mazar Barnett & Pearman, 2001:48) -
Atajacaminos colorado | Comportamiento
Generalmente solitario. Socialmente monógamo (Cleere, 1998:198). Nocturno (ffrench, 1991:210; Ridgely & Gwynne, 1989:195) y raro de ver excepto cuando canta (Hilty, 2003:376).
Se posa en el suelo y en las ramas de los árboles (de la Peña, 202:249; de la Peña, 2015:330; Narosky e Yzurieta, 2010:192), a veces a través de la rama. No se posa por las noches en los caminos (Cleere, 1998:198; Rumelt, 2020; Hilty, 2003:376; Narosky e Yzurieta, 2010:192; Ridgely & Gwyne, 1989:195)
No existen datos publicados sobre defensa territorial (Rumelt, 2020)
© Luísa Mota. Camouflage (Antrostomus rufus). Mogi-Guaçu, São Paulo, Brasil. Septiembre 2011. Algunos derechos reservados VOCALIZACIONESLas llamadas comienzan después de oscurecer, se mantienen durante la noche y acaban justo antes del amanecer (ffrench, 1991:210). Durante estación reproductiva canta toda la noche (Ridgely & Gwynne, 1989:195). Emiten el llamado desde una percha a escasos metros del suelo dentro del bosque, algunas veces hasta de 10-20 m de altura. También desde rocas y desde el suelo (Cleere, 1998:198; Wetmore, 1968:216; Stiles & Skutch, 1989:202).
El canto se describe como rápid, resonante y rítmico “Chuk, wick-wick-weéoo”, con énfasis en la última sílaba (Ridgely & Gwynne, 1989:195; Hilty 2003:376; Belton, 1984:561; Raffaele et al., 1998:102; Schulenberg et al., 2010:204; Sick, 1997:418). La llamada se repite cada pocos segundos, ocasionalmente a frecuencia rápida (ffrench, 1991:209; de la Peña, 2020:249; de la Peña, 2015:330)
También tiene una llamada gutural tipo “croar” (Cleere, 1998:198)
El canto es bastante constante en todas las subespecies, incluyendo el A. r. otiosus de Santa Lucía (Robbins & Parker, 1997:603), aunque la variante con una repetición más rápida es más común en el otiosus que en las otras subespecies (Cleere, 1998:198).ALIMENTACIÓNInsectívoro. Su dieta no se conoce en detalle
Se alimenta durante el amanecer y atardecer, en partes bajas de vegetación o sobre el suelo.
Captura los insectos al vuelo desplazándose desde perchas bajas (Cleere, 1998:198; Hilty, 2003:376; Rumelt, 2020). Bodrati & Salvador (2015:84), lo observaron capturando termitas en el Chaco Oriental en la provincia del Chaco.REPRODUCCIÓNLas fechas de reproducción varían en las distintas poblaciones. En enero o febrero y mayo en el rango norte de distribución (Panamá y Trinidad) (Cleere, 1998:198; ffrench, 1991:210; Belcher & Smooker, 1936; Wetmore, 1968:215); finales de junio en Santa Lucía; mediados de abril a mayo en Colombia (Hilty, 2003:376); y noviembre y diciembre en el extremo sur (Argentina). No existen datos sobre las poblaciones del norte de Sudamérica, especialmente en la Amazonia (Cleere, 1998:198).
No construyen nido y depositan los huevos sobre el suelo desnudo, generalmente debajo de matorrales que lo cubren.
Puesta de 1-2 huevos (Wetmore, 1968:215; Cleere, 1999:198), pero en Argentina todas las nidadas halladas estaban compuestas por dos huevos (Salvador et al., 2014:55; de la Peña, 2020:250; de la Peña, 2015:330). Huevos elípticos, de colores cremoso, blanquecino o cremoso rosado con puntos, manchas y líneas de color gris o gris con tinte violáceo, castañas y pardas, distribuidas en toda la superficie, aunque algo más concentradas en la porción central del huevo.
Incubación durante el día, aparentemente cubierta por la hembra, aunque es posible que el macho lo haga durante la noche (Wetmore, 1968:215; Cleere, 1998:198; Salvador et al., 2014:55)
No existen datos sobre los cuidados parentales, aunque la alimentación de las crías probablemente sea realizada por ambos padres, como en el caso del A. carolinensis (O’Connor & Ritchison, 2013:818).
Cleere (1998:198), comenta que no se han registrado maniobras de distracción, pero Salvador et al., (2014:55) apuntan que todos las nidadas de Atajacaminos Colorado fueron descubiertas al salir la hembra espantada ante su presencia, haciendo vuelos y movimientos de distracción habituales en especies de la familia Caprimulgidae.
Salvador et al., (2014:55) reseñan que los pichones a las pocas horas de eclosionados tienen los ojos semiabiertos de color pardo oscuro; están cubiertos por un denso plumón canela con tinte castaño más oscuro en dorso y cuello con tinte amarillento sobre la cabeza. El pico de color pardo claro con un muy fino ápice blanco; el interior de la boca es rosado y las patas crema con tinte rosado.
En Argentina se han localizado nidos en Jujuy, Salta, Catamarca, Chaco, Santa Fe (de la Peña, 2020:249; Hartet & Venturi, 1909:224; Di Giácomo & López-Lanús, 1998:30; Salvador & Salvador en de la Peña, 2020:249; Salvador et al., 2014:54) -
Atajacaminos colorado | Descripción

© Tony Morris. Rufous Nighjar (Antrostomus rufus). Paraguay. Septiembre 2015. Algunos derechos reservados 
© Hector Bottai. Rufous Nightjar/João-corta-pau/Atajacaminos colorado (Antrostomus rufus). Dourado. Estado de São Paulo – Brasil. Septiembre 2014. Algunos derechos reservados Dimorfismo sexual. Los machos con blanco en la cola, mientras que las hembras tienen colas parduzcas.
Posee un patrón de plumaje críptico sobre todo marrón oxidado, con algunas motas marrón oscuro sobre el manto y cubiertas alares secundarias.
Cabeza con fino puntillado castaño y ocráceo con estrías negras en corona, nuca y espalda.
Garganta parda oscura barrada de castaño con banda blanquecina estrecha en garganta inferior. Fino collar ocre que se extiende desde parte posterior de la garganta a lo largo de la nuca.
Cara delineada por collar y tenue línea ocular que se extiende desde parte posterior del pico hasta la base de la nuca.
Pico corto, ancho y negruzco con la punta negra.
Iris pardo oscuro. Vibrisas suaves que carecen de filamentos laterales en la mitad basal (Cleere, 1998:198; Ridgely & Gwynne, 1989:195)
Dorso pardo rojizo oscuro moteado de castaño oscuro-grisáceo.
Alas: cubiertas alares pardo rojizas moteadas de castaño-rojizo, beige y marrón oscuro. Escapulares castaño oscuro moteadas de gris oscuro y bordes color beige; remeras primarias y secundarias marrones rojizas con barrado oscuro; ausencia de marcas blancas sobre las remeras (Cleere, 1998:198).
Ventralmente, en general, acanelado-rojizo, con veteado canela, beige y blanco, que se convierte en barrado marrón y beige en la zona sub-caudal.
Cola: generalmente como las remeras; en el macho, los vexilos internos de las 3 timoneras externas tienen un punto terminal blanco y grande (33 – 44mm), que se extiende por la mitad del vexilo interno de las timoneras externas T4 y T3. En la hembra las 3 timoneras externas con puntas muy finas color beige pálido (Meyer de Schauensee, 1982:123)
Tarsos y patas marrón carnoso (Cleere,1998:198).
(Cleere, 1998:198; Ridgely & Gwynne, 1989:195; Sick, 1997:418)
Hembra: Es más clara y menos rojiza; tiene el collar ocráceo y la cola sin blanco (de la Peña, 2020:249; de la Peña, 2015:330; Narosky e Yzurieta, 2010:192)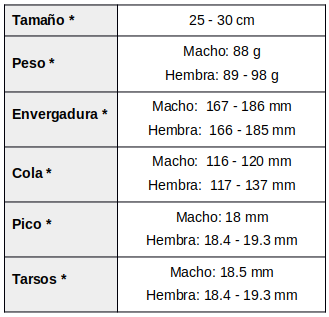
* (Cleere, 1998:198); Otros datos sobre medidas: (Robbins & Parker, 1997:602; Pagano & Salvador, 2017:29; Dubs, 1992:53; ffrench, 1991:209; Hilty, 2003:376) MUDAS
No han sido descritas para esta especie (Rohwer, 1971:487; Rumelt, 2020) -
Atajacaminos colorado | Taxonomía
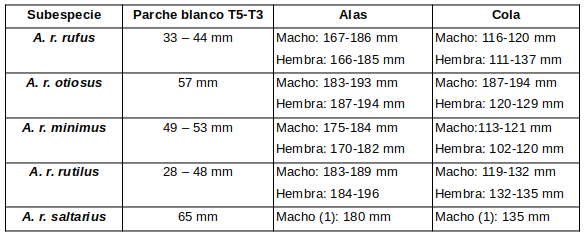
Subespecies y distribución
Actualmente se han reconocido 5 subespecies (Cleere, 1998:199; Dickinson 2003:241; Robbins & Parker, 1997:601)• A. r. minimus (Griscom & Greenway, 1937); Monotípico. Se distribuye por Sur de Costa Rica y Panamá; Noroeste de la costa del Caribe en Sudamérica, desde Colombia y Venezuela al Este hasta Trinidad. Menos rojizo que “rufus” y pecho más oscuro. El collar de la nuca es menos leonado, barba y garganta más pálidas. Macho con manchas blancas en timoneras T5-T3 de 49-53 mm (Cleere, 1998:199).
• A. r. otiosus (Bangs, 1911); Monotípico. Se distribuye por Noreste de Sta Lucía en las Antillas Menores (Greenway, 1958:353; Ridgway, 194:513; Rumelt, 2020); Sedentario; Alas largas, ligeramente maś grande y menos rojizo que “rufus nominal”, con manchas blancas en timoneras T5-T3 grandes (57 mm) (Cleere, 1998:199).
• A. r. rufus (Boddaert, 1783); Politípico. Se distribuye por Noreste de Sudamérica, Este de Venezuela, Guayanas, Noreste-sur y Centro de Brasil (Ridgway, 194:510).
• A. r. rutilus (Burmeister, 1856); Politípico. Se distribuye por Sureste de Bolivia (Santa Cruz, Chuquisaca? y Tarija?), Centro y Sureste de Brasil (Este de Mato Grosso a Río de Janeiro, sur de Río Grande do Sul) hasta Paraguay y Noreste de Argentina (Santiago del Estero y Corrientes). Sedentario y parcialmente migratorio; se mueven hacia el norte después de la reproducción y pueden hibernar (Mayo-Agosto) tan lejos como en Venezuela. Más pálido y menos rojizo que “rufus nominal”; collar de la nuca a menudo con algo de blanco; el punteado leonado de las primarias es más extenso y las cubiertas subcaudales ocasionalmente blanquecinas. Las manchas blancas sobre las timoneras T5-T3 del macho de 28-48 mm (Cleere, 1998:199).
• A. r. saltarius (Olrog, 1979:135); Politípico. Localizado típicamente en la confluencia de los Ríos Bermejo y Tarija en Salta (Argentina); Noroeste de Argentina (Tucumán?, Salta, y Jujuy) y Sureste de Bolivia (Tarija?, Chuquisaca?). Sedentario; parcialmente migratorio? Poblaciones en centro de Brasil (Pará?, Goiás?, y Bahía), Sur de Ecuador (Zamora, Chinchipe) y Perú (Junín y San Martín); Más grisáceo que “rufus nominal”, con manchas blancas en la remeras primarias (R5-R3) más grandes (65 mm) que en el macho del “rufus nominal” (Cleere, 1998:199). Considerado por Robbins & Parker (1997:601) como representante de una transformación grisácea del rutilus, restringida geográficamente, pero reconocido por Cleere (1998:199).
(Cleere, 1998:199) Nota taxonómica:
Durante casi todo el siglo XX, el C. rufus fue clasificado dentro del género Caprimulgus (género que abarcaba un gran número de especies de dormilones de todo el mundo) (Salvin & Hartert, 1892:566; Peters 1940:197; Dickinson 2003:241). Los recientes estudios filogenéticos que analizan datos de secuenciación de ADN (tanto de genes nucleares como mitocondriales) revelan que, el género Caprimulgus, tan ampliamente definido por Peters (1940:197) y otros autores, es altamente polifilético (Han et al. 2010:450; Sigurdsson & Cracraft 2014:533 y 538). Estos autores concluyen que el A. carolinensis y A. rufus son especies hermanas, quedando el género Caprimulgus limitado a especies del Viejo Mundo, y las especies de “Caprimulgus” del Nuevo Mundo se separan en varios clados. El C. rufus pertenece a un clado que es restablecido al género Antrostomus (Sigurdsson & Cracraft 2014:532). Aceptado por el SACC (South American Classification Committee), Propuesta Nª 466. -
Atajacaminos colorado (Antrostomus rufus)

© Buffon, Daubenton. Planches enluminées d’histoire naturelle. Vol 3: lámina 735 (Crapaud volant ou tette-chèvre de Cayenne) El Atajacaminos colorado es un chotacabras relativamente grande, parduzco, con un collar ocre estrecho en la parte posterior del cuello y una banda blanquecina en la garganta. No tiene blanco en las alas, y las hembras carecen de blanco en la cola. Se encuentra en el sur de América Central, en Santa Lucía (Antillas menores), en el norte y centro de Sudamérica y este de los Andes donde es bastante común. Se reconocen, al menos, 5 subespecies. El Atajacaminos Colorado se distribuye en forma discontinua desde Panamá hasta el norte de Argentina, donde se encontrarían dos de las cinco subespecies reconocidas (A. r. rutilus y A. r. saltarius) (Cleere, 1999:199; Salvador et al., 2014:54; Rumelt, 2020).
Sinónimos: (SIB)
Caprimulgus rufus (Antrostomus rufus)
Caprimulgus saltarius (Antrostomus rufus saltarius)
Caprimulgus rufus subsp. rutilus (Antrostomus rufus subsp. Rutilus)
Protónimo: Caprimulgus rufusNOMBRES COMUNES: Atajacaminos colorado, Chotacabras colorado (Argentina, Paraguay, Bolivia); Guardacaminos colorado (Colombia); Chotacabras rojico (Costa Rica); Pocoyo rojizo (Nicaragua); bacurau, curiangú, joao-corta-pau, joão-corta-pau, maria-faz-angu, mariangú (Brasil); Cacuí, Dormilón rubio, Pitanguá, Tarpuí, Tarpuí rubio, Dormilón rojizo, Tres cuatro cueros. En guaraní le dicen “Ateí tres cuatro cueros, Yvyja’u ravyta ” (de la Peña, 2020:249; de la Peña, 2015:330; Chébez, 1996:134)
EN OTROS IDIOMAS
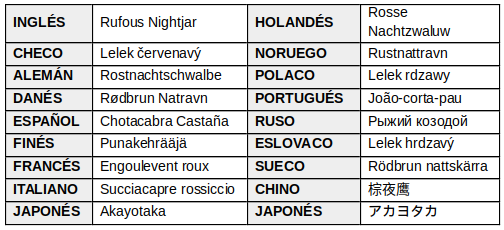
BREVES APUNTES HISTÓRICOS
- Planches enluminées d’histoire naturelle. Buffon, George Louis Leclerc, Daubenton, Edme-Louis. [Paris]: [Imprimerie Royale]; 1770-1783. Vol 3: lámina 735 (Crapaud volant ou tette-chèvre de Cayenne)
- Histoire naturelle des oiseaux. Buffon, Georges Louis Leclerc, comte de, Bexon, Gabriel Léopold Charles Amé, Guéneau de Montbeillard, Philippe. A Paris: De l’Imprimerie Royale, 1770-1786. Vol 6: 581 (Engoulevent roux de Cayenne)
- A general synopsis of birds. Latham, John. London: Printed for Benj. White, 1781-1785. Vol 2 (2º parte): 597 (Rufous Goatsucker)
- Nouveau dictionnaire d’histoire naturelle, appliquée aux arts, à l’agriculture, à l’économie rurale et domestique, à la médecine, etc. Par une société de naturalistes et d’agriculteurs. Paris,Chez Deterville, 1816-19. Vol 10: 244 (Engoulevens roux)
- Proceedings of the Zoological Society of London. Smit Joseph. Vol 1866: lámina XLV (Antrostomus ornatus)
- Zur Ornithologie Brasiliens: Resultate von Johann Natterers Reisen in den Jahren 1817 bis 1835. Pelzeln, August von, Natterer, Johann. Wien: A. Pichler’s Witwe & Sohn, 1871. pp 53-55 (Antrostomus cortapau)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London, 1874-98. Vol 16 (1892): 566-567 (Caprimulgus rufus)