- Contenido restringido para suscriptores. Suscripción gratuita para acceso a la bibliografía completa y sus enlaces. Pinchar en "Ingresar" para crear su perfil de suscriptor
-
Picaflor amatista | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOREspecie con rango extremadamente amplio, por lo tanto no se aproxima a los umbrales de Vulnerabilidad bajo criterio de tamaño del rango (extensión < 20.000 km² combinado con declinación o fluctuación del tamaño del rango, extensión/calidad del hábitat, o tamaño de la población y número pequeño de localizaciones o fragmentación severa). La tendencia de la población parece ser estable por lo que no alcanzan los umbrales de los criterios de tendencia de la población ( declinación > 30% en 10 años o 3 generaciones). El tamaño de la población es muy grande, y no alcanza los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (< 10.000 individuos maduros con una declinación continua estimada ( > 10% en 10 años o 3 generaciones, o con una estructura poblacional específica). Por estas razones la especie es considerada como: Preocupación menor
El tamaño de la población global no ha sido cuantificado, pero esta especie se describe como “poco común” (Stotz et al., 1996). Se sospecha que la población está en declive localmente por la pérdida de su hábitat (del Hoyo et al. 1999). Aparentemente más bien local en Colombia, donde no es muy conocido; Muy local en Venezuela, donde los registros se concentran en S del país.; poco común sobre E Perú; y también considerado como raro, aunque registrado regularmente, en la Guayana Francesa. Se extendió por gran parte de Brasil, pero el estado es poco conocido en el estado más al sur de Rio Grande do Sul, donde se registra principalmente en primavera y verano, y en un número relativamente pequeño de localidades. A lo largo de toda la gama parece aceptar hábitats artificiales como jardines y zonas verdes.
En Argentina: AMENAZADA
Según comenta Chébez (2008), las causas de su actual rareza no resultan demasiado claras. La fragmentación del hábitat con la consiguiente pérdida de determinadas plantas fanerógamas de cuyo néctar se alimenta podría llegar a ser una de las causas de su enrarecimiento y escasez.
Lugares donde se la ha encontrado (de acuerdo a las citas documentadas en el SIB): Misiones.
Los registros conocidos hasta el presente para la Argentina se produjeron entre los meses de octubre a abril (primavera-verano) etapa reproductiva de la especie (Castillo, et al., 2012)
Estado de conservación
AvA-SADS-AM: Amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable) López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
MADS-AA-AM: Amenazada según MADS&AA 2015 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas) Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p 2015
Res 348 SA-A: Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable) Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010.
-
Picaflor amatista | Distribución
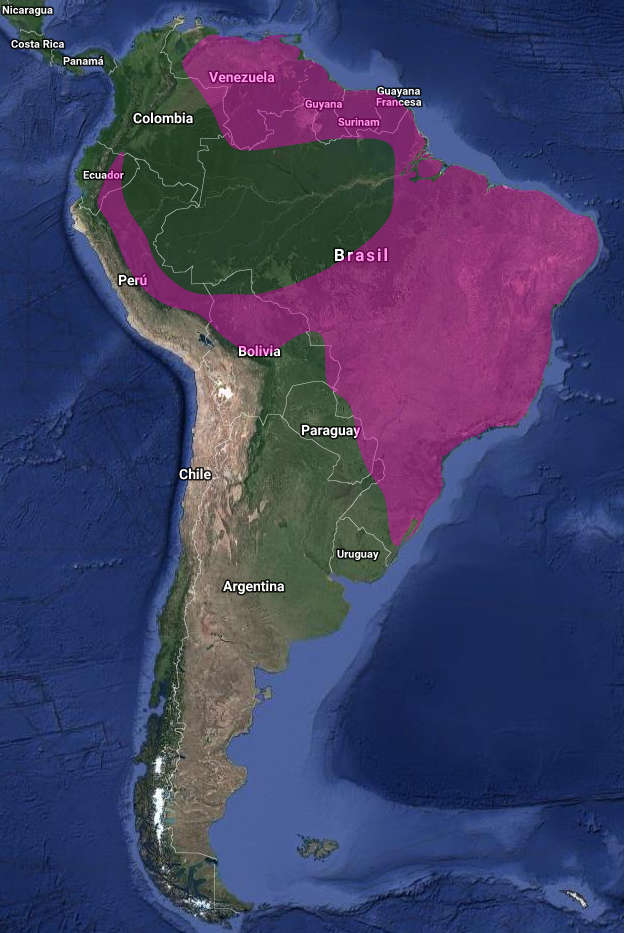
InfoNatura: Animals and Ecosystems of Latin America 2007 Sudamérica: Este de Colombia, Venezuela y las Guayanas, sur a este de Ecuador, este de Perú y norte de Bolivia, este de Brasil y por el sur hasta Paraguay y noreste de Argentina (Misiones) (De la Peña, 2016). Común en la mayor parte del rango; Aparentemente más bien local en este de Colombia, donde no es muy conocido. Muy local en Venezuela, donde los registros se concentran en el sur del país (Guilliard, 1941). Poco común en el este de Perú y Ecuador (Zimmer, 1953). También considerado como raro, aunque registrado regularmente, en la Guayana Francesa (Renaudier, 2009). En Bolivia muy raro con escasos registros (Remsen & Traylor, 1983; Herzog, Kessler, Maijer & Hohnwald, 1996). Se extiende por gran parte de Brasil; poco conocido en el estado más al sur de Rio Grande do Sul, donde la especie sería visitante estival (Belton, 1984; Saibene, Castelino, Rey, Herrera & Caló, 1996; Bodrati, Maders, Cockle & Pugnali, 2008), y en un número relativamente pequeño de localidades.
En Paraguay, Guyra Paraguay (2004) lo considera residente nidificante, pero Chebez y Rodríguez (2008) cuestionan esta designación, ya que no hay evidencia de su reproducción ni registros que demuestren su residencia a lo largo del año. Se lo considera raro en las regiones de Campos Cerrados, Centro de Paraguay y Alto Paraná (Hayes, 1995)
En Argentina: La especie fue incluida para la provincia de Misiones por Bertoni (1913); a posteriori Morgensen (1930) cita ejemplar recolectados en Bonpland (Dto Candelaria) y Puerto San Segundo (Dto Iguazú); según comenta Chébez (2008) es Partridge (1954) el que aporta nueva información en base a 5 ejemplares depositados en el MACN recogidos en la provincia de Misiones.
En el noreste de Argentina, la población parece haber disminuido y la especie se ha convertido en las más rara de los colibríes registrados regularmente en el Parque Nacional Iguazú (Castillo et al., 2012; Saibene et al, 1996)
Chébez (2008) comenta que en nuestro país posee un status raro, solo conocido por varios ejemplares colectados a principios y mediados del siglo XX, en la provincia de Misiones y un registro en el Parque Nacional Iguazú en enero de 1988 (Saibene et al., 1996), que ha sido puesto en duda aunque, en el año 2006, fue vuelto a observar en el área proyectada como Parque Provincial Caá-Yarí dentro de los límites de la Reserva Yabotí. Esto reconfirmaría su presencia en la provincia (Chebez, 2008)
Chebez (2008) la considera “en peligro” aunque considera que los datos son insuficientes.
Hay poca información sobre la presencia estacional de este picaflor en Argentina y zonas limítrofes. Narosky e Yzurieta (2003) lo consideran entre las especies que anidan en nuestro país y migran hacia el norte en invierno. En contraste, Mazar Barnett y Pearman (2001) no lo incluyen entre los migrantes.
Misiones (Bertoni 1913; De la Peña, 1999; De la Peña, 2013; De la Peña, 2016); citado para Parque Provincial Cruce caballero (Departamento de San Pedro) como raro, visitante estival de presencia indeterminada (Bodrati et al., 2010) y en el Parque Provincial Caá Yarí (Departamento de Guaraní (Chébez, 2008). Un registro en PN Iguazú en enero 1998 (Saibene et al., 1996), puesto en duda por Chébez (1998) y varios registros en 2011 en el Jardín de los Picaflores, en la ciudad de Puerto Iguazú (Bodrati et al., 2008; Castillo et al., 2012); Citada para los departamentos de Iguazú, San Pedro, Candelaria, General Belgrano y posiblemente Montecarlo (Bertoni, 1913; Partridge, 1954; Chebez, 1996; Chebez, 2008). (en Castillo y col. 2012). En determinadas regiones de Misiones se lo avista reiteradamente, lo cual podría indicar la tendencia de la especie a establecerse como posible residente y nidificante (Castillo et al., 2012)
Ecorregiones: Selva paranaense (Barnett & Pearman, 2001; Stotz et al, 1996; Chébez, 2008)
Hábitat: A lo largo de toda su distribución parece aceptar hábitats artificiales como jardines y zonas verdes, desde las fronteras de los bosques húmedos, los claros y las sabanas hasta los bosques abiertos (no está presente dentro de los bosques); Hasta 1500 msnm. Forrajea en arbustos y árboles bajos (Chébez, 2008)
-
Picaflor amatista | Comportamiento
Más tranquilo que otras especies (Chébez, 2008)
Es probable que sea principalmente sedentario con alguna dispersión local, se supone que asociada a la búsqueda de áreas más ricas en recursos florales durante periodos de escasez y a factores reproductivos (Las-Casas, Azevedo Jr. & Dias-Filho, 2012). Por ejemplo, en Chapada Diamantina, Bahía (Brasil), al C. amethystina solo se lo ve en enero-julio. La especie también se considera que es muy local y probablemente estacional al norte del Orinoco en Venezuela, con registros en Guárico únicamente desde agosto, octubre y diciembre hasta enero. Según Ruschi (1973) se estima que las poblaciones de Calliphlox amethystina que habitan el centro y nordeste de Brasil son de residencia permanente, mientras que aquellas que viven en el sudeste de ese mismo país, serían proclives a efectuar algún tipo de desplazamiento local como lo señala Ruschi (1973), aunque poco conocido como destaca Del Hoyo et al. (1999) (citado en en Castillo, Güller & Veiga, 2012: 3-4)
El macho tiene el batido más rápido de las alas registrado para un picaflor (cerca de 80 aleteos/s), así como como el mayor consumo metabólico conocido en vertebrados (Mobbs, 1975; Chébez, 2008)
VOCALIZACIONESCanto: casi inaudible
Llamada: emite un extraño zumbido ” Zzzzzzz” emitido al batir las alas en señal de alarma y agresión (Sick, 1997; Chébez, 2008)
ALIMENTACIÓNSe alimenta desde el sotobosque hasta el dosel (Stotz et al., 1996). Toma néctar de una gran variedad de flores (nicho muy amplio de alimentación): Anacardium, Bowdichia, Calliandra, Canna, Cítricos, Cnidoscolus, Convolvulus, Cuphea, Delphinium, Duranta, Erythrina, Fucsia, Genipa, Grevillea, Helicteres, Hohenbergia, Humiria, Inga, Lantana, Leonurus, Mabea, Maranta, Nicotiana, Oenothera, Palicourea, Passiflora, Pavonia, Plectranthus, Psychotria, Saranthe, Stachytarpheta, Struthantus, Tacinga, Vochysia y árboles de Eucalipto introducidos. Probablemente en esta especie el néctar de especies no-ornitófilas puede funcionar como un suplemento importante en los periodos de escasez de recursos florales, sobre todo para los picaflores residentes. Al ser menos hábiles en la utilización de recursos no-ornitófilos y menos agresivos en la demarcación de sus territorios dejan el área en busca de localizaciones más ricas en recursos (Machado, Góes Coelho, Silveira Santana & Rodrigues, 2007); Los insectos son atrapados en el aire.
Dominado por la mayoría de los otros colibríes en el este Brasil, por ejemplo, Leucochloris albicollis, Hylocharis chrysura, Thalurania glaucopis, Stephanoxis lalandi, y Eupetomena macroura. No defiende territorios y frecuentemente son expulsadas por las especies dominantes (los autores correlacionaron más peso de la especie con mayor grado de dominancia). Al ser competitivamente subordinados, estas especies itinerantes se aprovechan de las brechas dejadas por otras especies actuando como oportunísticas, explorando de manera fortuita recursos no-defendidos y ocasionalmente invadiendo territorios de aves más dominantes (Rojas & Ribon, 1997; Olmos & Boulhosa, 2000; Antunes, 2003; Justino, Maruyama & Oliveira, 2012).
REPRODUCCIÓNAnida en lugares abiertos, de noviembre a abril, al menos en Brasil. Nido en forma de copa construido con material vegetal suave de Typha, Bromeliaceae y Gramineae, unido con telarañas y decorado en el exterior con líquenes Colocado en una rama horizontal dentro de la vegetación. Puesta de dos huevos. Incubación 13-14 días. Los pichones abandonan el nido entre los 20-22 días. La hembra se encarga de la construcción del nido, incubación y cuidado de los pichones (Chébez, 2008)

Les trochilidées. Lesson R.P. (1832) Lámina 30 -
Picaflor amatista | Descripción
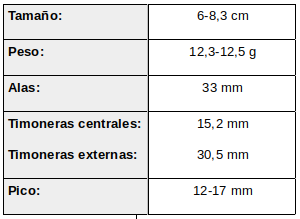
Marcado dimorfismo sexual.
Macho: Pico negro, recto, de tamaño mediano, en proporción más corto que en otras especies. Mancha post-ocular y/o gular blancas. Garganta y lados del cuello púrpuras-violáceos brillantes, que cambia a marrón-púrpura si se coloca contra el sol (Vieillot, 1817).
Dorso verde-bronceado brillante. Pecho blanco, zona ventral gris-verdosa con pequeñas manchas blancas abdominales y flancos inferiores canela-parduzcos. Alas pardas o rufas.
Cola relativamente larga y profundamente ahorquillada , morada-negra, con punta verde que cuando está posado balancea hacia delante y detrás. Timoneras cortas y puntiagudas; centrales verde-oliva brillantes; timoneras externas púrpura oscuro aunque más verdosas sobre el vexilo interno. Cuando está en reposo, las plumas de la cola se mantienen en posición cruzada.
Muda: A finales de verano y comienzo del otoño cambian sus plumas relucientes de la garganta por plumas blanquecinas moteadas de gris. Este nuevo cambio solo dura 4-8 semanas, pasando luego a una muda completa con reaparición de las plumas brillantes en la garganta. Esta muda no se corresponde con el periodo de reproducción y se conoce como “plumaje eclipse” o de reposo reproductivo (Mobbs, 1975; Chébez, 2008)
Hembra: Partes superiores similares a las del macho. Línea alargada detrás de los ojos; garganta ocrácea con algunos puntos verdes.
Banda blanquecina en el pecho con el resto del vientre de color canela. Mancha blanca a cada lado de la rabadilla (zona inferior de los flancos)
Cola corta, menos furcada que el macho, rectangular, principalmente verde opaca, con las timoneras centrales verdes y las externas negras con punta canela (Zimmer, 1953)

© Dario Sanches (abril 2008) Male Amethyst Woodstar (Calliphlox amethystina) Chácara Antonio Wuo, Mogi das Cruzes-SP (Brazil). Algunos derechos reservados 
© Dario Sanches (abril 2008) Female Amethyst Woodstar (Calliphlox amethystina) Chácara Antonio Wuo, Mogi das Cruzes-SP (Brazil) Algunos derechos reservados -
Picaflor amatista | Taxonomía
Monotípico
Protónimo: “Trochilus amethystinus”
-
Picaflor amatista (Calliphlox amethystina)

Histoire naturelle des oiseaux-mouches : ouvrage orné de planches dessinées et gravées par les meilleurs artistes … Lesson R.P (1830) Lámina 47 Según cita de Bodrati et al. (2008) El picaflor amatista (Calliphlox amethystina) es un Trochílido de amplia distribución, que habita desde la Argentina hasta Venezuela y Colombia (Olrog, 1979). Es raro en la Argentina: sólo existirían 11 ejemplares colectados a principios y mediados del siglo XX, en cinco localidades de la provincia de Misiones (Mogensen, 1930; Partridge, 1954; Chebez y Rodríguez, 2008; M. Pearman, in litt. 2009) y un registro de Parque Nacional Iguazú en enero de 1988 (Saibene et al., 1996), que ha sido puesto en dudas (Chebez et al., 1998). Chebez y Rodríguez (2008) mencionan además un especímen perdido que probablemente corresponde con esta especie. Debido a la falta de registros modernos, Fraga (1997) la considera con datos insuficientes para evaluar su estatus de conservación, y Chebez et al. (1998) la consideran como de estatus “crítico.
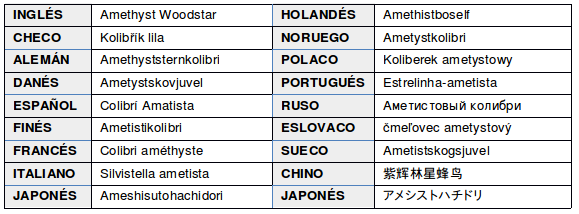
NOMBRES COMUNES: Picaflor amatista (Argentina, Bolivia y Paraguay); Rumbito amatista, Zumbador amatista (Colombia); Estrellita amatista (Perú); Tucusito amatista (Venezuela); Beija-flor-besouro, beija-flor-estrelinha-ametista, beija-flor-mosca, besourinho-ametista, besouro-zumbidor, estrelinha, Estrelinha-ametista, tesourinha (Brasil); en guaraní: Mainumby michiete, Mainumby-michiete; otros: Esterlina,
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS:
- Nouveau dictionnaire d’histoire naturelle, appliquée aux arts, à l’agriculture, à l’économie rurale et domestique, à la médecine, etc. Paris,Chez Deterville,1816-19. Vol VII (1817): 358 (Le oiseau-mouche amhyste/Trochilus amethystinus)
- Tableau encyclopédique et méthodique des trois règnes de la nature. Ornithologie. Bonnaterre, abbé (Pierre Joseph), Bénard, Robert, Vieillot, L. P. A Paris :Chez Mme. veuve Agasse …,1823. Vol II: 561 (L’oiseau-mouche améthyste)
- Histoire naturelle des oiseaux-mouches : ouvrage orné de planches dessinées et gravées par les meilleurs artistes … Lesson R.P. Paris :Arthus Bertrand,[1829-1830]. pp: 150 y lámina 47 (L’oiseau-mouche améthyste/ ornismya amethystina)
- Histoire naturelle des colibris : suivie d’un supplément à l’Histoire naturelle des oiseaux-mouches : ouvrage orné de planches dessinées et gravées par les meilleurs artistes : et dédié A.M. le Baron Cuvier. Lesson R.P. Paris :Arthus Bertrand,[1830-1832]; pp: 138; Láminas 20, 21 y 22 (L’améthiste/Ornismya amethystina)
- Les trochilidées : ou, Les colibris et les oiseaux-mouches, suivis d’un Index général, dans lequel sont décrites et classées méthodiquement toutes les races et espèces du genre Trochilus. Lesson R.P. Paris :A. Bertrand,[1832?]; pp: 79; láminas 25, 26 y 27 (Le petit améthyste/Ornismya amethystoides)
- Avium species novae, quas in itinere annis MDCCCXVII-MDCCCXX per Brasiliam. Spix, Johann Baptist von. Monachii :Impensis editores,1838-1839. Vol I: 79; Lámina 80 (Fig.2) (Trochilus brevicauda)
- A monograph of the Trochilidæ, or family of humming-birds. Gould John. London :Printed by Taylor and Francis ;1861 [i.e. 1849-1861]; Vol III: Texto y lámina 159 (Calliphlox amethystina)
- Histoire naturelle des oiseaux-mouches, ou, Colibris constituant la famille des trochilidés. Mulsant M.E. Lyon :Au Bureau de la Société Linnéenne,1874-1877. Vol IV: 45 (Le calliphlox améthyste)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London,1874-98. Vol 16: 387 (Calliphlox amethystina)