- Administración de Parques Nacionales. Sistema de Información de Biodiversidad. Argentina. (s.f.) Ficha: Eupetomena macroura. Recuperado de https://sib.gob.ar/especies/Eupetomena-macroura, el 13/01/2020.
- Antunes, A.Z. (2003). Partilha de néctar de Eucalyptus spp., territorialidade e hierarquia de dominância em beija-flores (Aves: Trochilidae) no sudeste do Brasil. Ararajuba, 11(1), 39-44. (enlace)
- ArgentAvis. (s.f.) Picaflor tesoro. Recuperado de http://argentavis.org/2012/sitio/especie_co.php?id=630, el 13/01/2020.
- Argentina Nativa. (2011). Colibrí golondrina: Eupetomena macroura. Recuperado de http://faunayfloradelargentinanativa.blogspot.com, el 13/01/2020.
- Barbosa-Filho y Cardoso de Araujo A (2013) Flowers visited by hummingbirds in an urban Cerrado fragment, Mato Grosso do Sul, Brazil. Biota Neotrop., vol. 13, no. 4 (enlace)
- Barnett, J.M. & Pearman M. (2001). Lista Comentada de las Aves Argentinas (1º Ed.). Lynx Edicions.pp. 92 y 117
- Baza Mendonça, L. B., & Anjos, L. dos. (2005). Beija-flores (Aves, Trochilidae) e seus recursos florais em uma área urbana do Sul do Brasil. Revista Brasileira de Zoologia, 22(1), 51-59. (enlace)
- Baza Mendonça, L. B., & Anjos, L. dos. (2006). Feeding behavior of hummingbirds and perching birds on Erythrina speciosa Andrews (Fabaceae) flowers in an urban area, Londrina, Paraná, Brazil. Revista Brasileira de Zoologia, 23(1), 42-49. (enlace)
- Bech, C., Abe, A., Steffensen, J., Berger, M., & Bicudo, J. (1997). Torpor in Three Species of Brazilian Hummingbirds under Semi-Natural Conditions. Condor, 99(3), 780-788. (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bull. Amer. Mus. Nat. Hist., 178(4), 369-636. (enlace)
- Bernaconi, F., César, I.A., & Franzony, A.V. (2019). Primeros registros del Picaflor Tijereta (Eupetomena macroura) para la provincia de Corrientes, Argentina. EcoRegistros, Revista, 9(1), 1-3. (enlace)
- BirdLife International (2018) Species factsheet: Eupetomena macroura. Downloaded from http://www.birdlife.org on 08/01/2018.
- Bodrati, A., Gómez M., & Ferreyra C. (2015). Proyecto Selva de Pino Paraná. Misiones, Argentina. Nuestras Aves, 61, 26. (enlace) https://issuu.com/avesargentinas/docs/revista_nuestras_aves61_color_distr/31
- Castillo, L., Moschen M., & Lowen J.C. (2009). Nuevos registros del Picaflor Tijereta (Eupetomena macroura) en la Ciudad de Puerto Iguazú, Misiones, Argentina. Nuestras Aves, 54, 68-69. (enlace)
- Chaui-Berlinck, J.G., & Bicudo, J.E.P.W. (1995). Unusual metabolic shifts in fasting hummingbirds. Auk, 112(3), 774-778. (enlace)
- Chebez, J. C., Castillo, R., Güller, R., & Ferrari, C. (2006). Confirmation of the presence of the swallow-tailed hummingbird (Eupetomena macroura) in Argentina. El Hornero, 021(01), 049-051. (enlace)
- Chébez, J.C., & Güller, R.M. (2012). Misiones. Aves/Birds (2o). Golden Company.
- Costa Straube, F., Urben.Fiho, A., & de Queiroz Piacentini, V. (2006). O Beija-flor-tesoura Eupetomena macroura (Gmelin, 1788) e sua ampliação de distribuição pelo Sul do Brasil. Atualidades Ornitologicas, 132. (enlace)
- Davis, S.E. (1993). Seasonal status, relative abundance, and behavior of the birds of Concepción, Departamento Santa Cruz, Bolivia. Fieldiana Zool., 71, 1-33. (enlace)
- De la Peña, M.R. (1999). Aves Argentinas. Lista y Distribución (1o). Buenos Aires, Argentina, Editorial L.O.L.A. (Literature of Latin America). pp 95 (441)
- De la Peña M.R. (2013). Citas, observaciones y distribución de aves argentinas: Edición ampliada. Ediciones Biológica, Serie Naturaleza, Conservación y Sociedad (7), 786. (enlace)
- De la Peña M.R. (2015). Aves Argentinas. Buenos Aires, Argentina. EUDEBA, UNL; Vol. 1: 344
- De la Peña M.R., & Salvador S. (2016). Aves Argentinas: Descripción, comportamiento, Reproducción y Distribución. Charadriidae a Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), 20(1), 627 pp. (enlace)
- De Las-Casas, F.M.G., S. M. A., Mendes-Azevedo, S. Jr., & Dias Filho, M.M. (2012). The community of hummingbirds (Aves: Trochilidae) and the assemblage of flowers in a Caatinga vegetation. Brazilian journal of biology, 72(1), 51-58. (enlace)
- Del Castillo, H., Kruchowski, S., Castillo, L., Allende, S. M., & Krauczuk, E. R. (2012). Distribution of Eupetomena macroura in Paraguay, new records for Misiones Province, Argentina, and comments on its geographic expansion. Atualidades Ornitológicas, 170, 12-15. (enlace)
- De Lyra-Neves, Rachel M.; Oliveira, Maria A.B.; Wallace R. & dos Santos, Ednilza M. (2007): «Comportamentos interespecíficos entre Callithrix jacchus (Linnaeus) (Primates, Callitrichidae) e algumas aves de Mata Atlântica, Pernambuco, Brasil» [Interspecific behaviour between Callithrix jacchus (Linnaeus) (Callitrichidae, Primates) and some birds of the Atlantic forest, Pernanbuco State, Brazil]. Revista Brasileira de Zoologia 24(3): 709–716 (enlace)
- EcoRegistros. (2020). Picaflor Tijereta Eupetomena macroura (Gmelin, 1788) Ficha de la especie. Recuperado de http://www.ecoregistros.org/site/index.php el 13/01/2020.
- Hayes, F.E. (1995). Status, Distribution and Biogeography of the Birds of Paraguay. (1o Ed.). American Birding Association.; (enlace)
- Hellmayr, C.E. (1929). A contribution to the ornithology of northeastern Brazil. Field Mus. Nat. Hist. (Zool. Ser.), 12(18), 235-501. (enlace)
- Helme, N.A. (1996). New departmental records for Dpto. La Paz, Bolivia, from the Pampas del Heath. Bull. Brit. Orn. Club, 116(3), 175-177. (enlace)
- Justino, D.G., Maruyama, P.K., & Oliveira, P.E. (2012). Floral resource availability and hummingbirds territorial behavior on Neotropical savanna shrub. Journal of Ornithology, 153, 189-197. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Colibrí Golondrina Eupetomena macroura (Gmelin, JF, 1788). Recuperado de https://avibase.bsc-eoc.org/species.jsp?avibaseid=BEB1ADD22A94A658 el 13/01/2020.
- Marini, M. Â., Borges, F. J., Lopes, L. E., Sousa, N. O., Gressler, D. T., Santos, L. R., … & França, L. F. (2012). Breeding biology of birds in the Cerrado of central Brazil. Ornitologia Neotropical, 23, 385-405. (enlace)
- Martínez-García, V., Lara C. & Ornelas J.F. (2013) Lek characteristics and the static male song of the Green violet-ear (Colibri Thalassinus) during 3-year study in a temperature forest of central Mexico. Ornitologia Neotropical; 24: 183-200 (enlace)
- Martínez Gamba, R. (2014). Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones, Argentina. Nótulas Faunísticas, Segunda Serie(163), 1-10. (enlace)
- Melo, C. (2001). Diurnal bird visiting of Caryocar brasiliense Camb. In Central Brazil. Revista Brasileira de Biologia, 61(2), 311-316. (enlace)
- Mendonça, L.B., L. dos, & Dos Anjos, L. (2006). Flower morphology, nectar features, and hummingbird visitation to Palicourea crocea (Rubiaceae) in the Upper Paraná River floodplain, Brazil. Anais Da Academia Brasileira de Ciências, 78(1), 45-57. (enlace)
- Narosky, T., & Yzurieta, D. (2010). Aves de Argentina y Uruguay. Guía de identificación (16.a ed.). Buenos Aires, Argentina, Vázquez Mazzini Editores. p. 208 (455)
- Olmos, F., & Boulhosa, R.L.P. (2000). A meeting of opportunists: Birds and other visitors to Mabea fistulifera (Euphorbiaceae) inflorescences. Ararajuba, 8(2), 93-98. (enlace)
- Oniki, Y., & Willis, E. O. (2000). Nesting behavior of the swallow-tailed hummingbird, Eupetomena macroura (Trochilidae, aves). Revista Brasileira de Biologia, 60(4), 655-662. (enlace)
- Pinto, Oliveiro M. de Oliveira (1938) Catalogo das Aves do Brasil e Lista dos exemplares que as representam no Museo Paulista: 255 (enlace)
- Pizo, M.A., & Silva, W.R. (2001). The dawn lek of the swallow-tailed hummingbird. The Wilson Bulletin, 113(4), 388-397. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Colibrí golondrina · Eupetomena macroura · (Gmelin, JF, 1788). Recuperado de https://www.xeno-canto.org/species/Eupetomena-macroura el 13/01/2020.
- Rojas, R., & Ribon, R. (1997). Guilda de aves em Bowdichia virgilioides (Fabaceae: Faboideae) em área de cerrado de Furnas, Minas Gerais. Ararajuba, 5(2), 189-194. (enlace)
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J., & Calo, J. (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina (1o Ed.). Buenos Aires, Argentina. Editorial L.O.L.A. (Literature of Latin America).
- Sazima, I. (2008). Dancing in the rain: Swarms of winged termites congregate a varied bird assemblage at an urban backyard in southeastern Brazil. Revista Brasileira de Ornitologia, 16(4), 402-405.(enlace)
- Schuchmann, K.L. & Kirwan, G.M. (2020). Swallow-tailed Hummingbird (Eupetomena macroura). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (retrieved from https://www.hbw.com/node/55395 on 17 January 2020).
- Short, L.L. (1975). A zoogeographic analysis of the South American Chaco avifauna. Bull. Amer. Mus. Nat. Hist., 154(3), 165-352. (enlace)
- Sick, H. (1997). Ornitologia Brasileira. (3o Ed.). Río de Janeiro, Brasil. Editora Nova Fronteira.
- Souza de Moura, A., & Soares, F.J. Jr. (2010). Ornitofilia (polinização por aves) em Aechmea maculata L. B. Smith (Bromeliaceae), registrada em um pequeno fragmento florestal no Município de Lavras, região sul de Minas Gerais, Brasil. Atualidades Ornitológicas On-Line, 158, 57-60. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A., & Moskovits, D.K. (1996). Neotropical Birds, Ecology and Conservation (1o Ed.). University of Chicago Press, Ltd.,London.
- Swallow-tailed Hummingbird (Eupetomena macroura), In Neotropical Birds Online (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. retrieved from Neotropical Birds Online: https://neotropical.birds.cornell.edu/Species-Account/nb/species/swthum1
- Toledo, M.C.B., & Moreira, D,M. (2008). Analysis of the feeding habits of the swallow-tailed hummingbird, Eupetomena macroura (Gmelin, 1788), in an urban park in southeastern Brazil. Brazilian journal of biology, 68(2), 419-426. (enlace)
- Vasconcelos, M.F., & Lombardi, J.A. (1999). Padrão sazonal na ocorrência de seis espécies de beija-flores (Apodiformes: Trochilidae) em uma localidade de campo rupestre na Serra do Curral, Minas Gerais. Ararajuba, 7(2), 71-79. (enlace)
- Vasconcelos, M.F. (2008). Notas sobre Phaethornis eurynome pinheiroi Ruschi, 1965. Atualidades Orn., 146, 8-10. (enlace)
- Zimmer, J.T. (1950). Studies of Peruvian birds 56. The genera Eutoxeres, Campylopterus, Eupetomena and Florisuga. Amer. Mus. Novit., 1450, 1-14. (enlace)
-
-
Picaflor tesoro | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOREsta especie tiene un rango extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). Se desconoce la tendencia de la población, pero no se cree que esté disminuyendo lo suficientemente rápido como para alcanzar los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población no se ha cuantificado, pero no se cree que se aproxime a los umbrales umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como de «preocupación menor».
El tamaño de la población mundial no se ha cuantificado, pero esta especie se describe como «bastante común» (Stotz et al., 1996)
La pronta ocupación de hábitats hechos por el hombre sugiere que la pérdida de hábitat probablemente no sea un problema. La captura para el comercio de aves silvestres fue significativa hasta 1970, pero ahora ha cesado.
En Argentina: 1º registro en el mes de julio de un individuo en el P.N. Iguazú, en la Sección Timbó (Povedano, H., 1993; citado en Saibene et al., 1996, p.36). Aparentemente se han expandido desde el estado adyacente de Paraná (Brasil). Recientemente (enero de 2005) se confirmó su presencia en Argentina (Misiones – Jardín de los Picaflores, en Puerto Iguazú (departamento Iguazú) (Chébez, Castillo & Güller,. 2006) ), donde Povedano H. lo avistó por primera vez (Saibene et al., 1996; De la Peña, 1999; Barnett & Pearman, 2001). El Parque Nacional Iguazú es el único Parque Nacional en que se ha encontrado la especie hasta el momento. Su escasa presencia en áreas protegidas no justifica una atención especial. Barnett y Pearman (2001: 117) lo incluyen en la lista de «Especies hipotéticas»
AvA-SADS-IC: Insuficientemente conocida según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable) López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res348 SA-IC: Insuficientemente conocida según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable) Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010
En el sur de Brasil su población es cada vez mayor y su área parece haber ampliado en las últimas décadas
-
Picaflor tesoro | Distribución
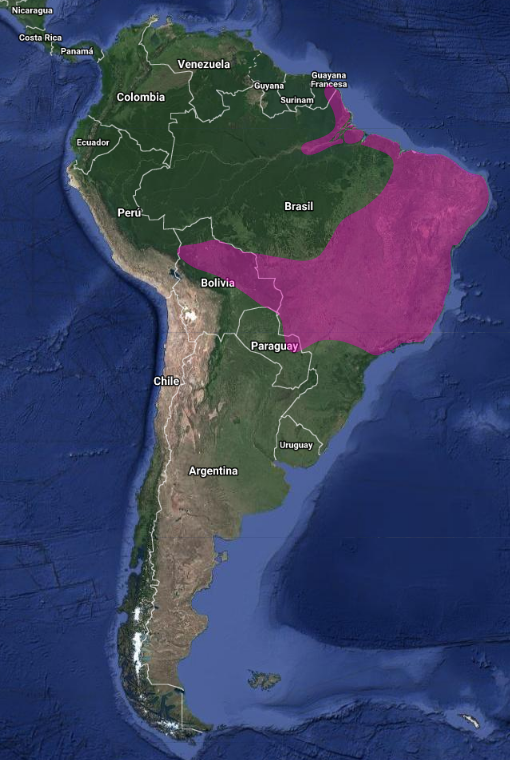
InfoNatura: Animals and Ecosystems of Latin America 2007 América: Endémico de Sudamérica. Se distribuye desde el sur de Surinam (sabana Sipaliwini), Guayana Francesa, Amazonia incluyendo sureste de Perú (parte superior del rio Urubamba y Pampas del Heath) a través del norte y este de Bolivia (Zimmer, 1950), noreste, sur (Santa Catarina y Sao Pablo) y centro-oeste de Brasil (Costa-Straube et al., 2006); extremo norte de Paraguay – Villa Concepción – y noreste de Argentina (Hellmayr, 1929; Hayes, 1995; Short, 1975; Stotz et al., 1996; Pinto & Oliveiro M. de Oliveira, 1938; Hellmayr, 1929).
En Argentina:
Misiones: Rara, visitante ocasional. El primer registro fue realizado por H. Povedano, que observó un individuo en Misiones (P.N. Iguazú) el 22 julio de 1993 (como se cita en: Saibene et al.,1996 y De la Peña, 1999 y 2016; Barnett y Pearman, 2001; Chébez, Castillo, Güller y Ferrari, 2006 y 2012). Aunque Dabbene (1910) menciona que la especie fue obtenida por C. Berg en Misiones sin dar más detalles, Barnett y Pearman (2001), consideran la especie como “hipotética”.
Citado como registro novedoso en el centro urbano de San Pedro, lo que los autores interpretan como una rápida expansión por la cuenca del Río Paraná hasta Posadas (Bodrati et al., 2009); varios registros entre los años 2006 y 2009 en el Jardín de los Picaflores (Iguazú) (Castillo et al., 2009); Del Castillo (2012) lo cita en el barrio de Itaembé Miní en Posadas, Piñalito Norte en la Municipalidad de San Antonio (Departamento de General Belgrano); en Puerto Iguazú presencia confirmada durante todo el año, aunque mayor en Enero y probablemente pertenezcan a una población de pocos individuos.
Martínez Gamba (2014) lo cita para el Parque Natural Municipal Monte Seguín (Departamento General San Martín) aunque los datos fueron insuficiente durante el relevamiento de aves realizado.
Últimamente ha sido registrado en Corrientes, en las localidades de Santo Tomé, Corrientes capital e Ituzaingó (Bernasconi et al., 2019)
Ecorregiones: Selva paranaense
Hábitat: Vegetación abierta tipo sabana con arbustos y árboles, incluidos campos rupestres y caatingas , hábitats artificiales como jardines, parques y plantaciones, también bosques primarios y bordes de bosques. Común desde el nivel del mar hasta 1800 msnm (Stotz et al, 1996; La especie E.m. hirundo (Perú) encontrada solo a 1000–1500 msnm. Se alimenta desde estratos medios hasta copas de los árboles.
En Brasil en campos rupestres y caatingas (De Las-Casas et al., 2012)
-
Picaflor tesoro | Comportamiento
Los colibríes parecen presentar diferentes mecanismos de utilización de los recursos, lo que se refleja en su comportamiento que es influenciado por las interacciones con otras especies de colibrís, morfología y estacionalidad de la floración.
Es una especie dominante sobre otras de menor tamaño (Barbosa-Filho & Cardoso de Araujo, 2013). Defiende vigorosamente su territorio de alimentación (Las-Casas et al., 2012; Pizo & Silva, 2001; Antunez, 2003; Justino et al., 2012). Este comportamiento es más evidente mientras obtiene néctar que cuando su objetivo es la adquisición de artrópodos. Según comentan Toledo & Moreira (2008), la mayor o menor disponibilidad de especies de plantas utilizadas para defensa del territorio no parecen estar asociadas con ninguna preferencia por ciertos recursos de ellas. Normalmente las especies de plantas que elige para descansar están compuestas por pocas hojas, una localización estratégica que le podría permitir una mejor visibilidad espacial.
También influyen las diferencias en la habilidad para explorar diferentes tipos de plantas, lo que está determinado por sus características morfológicas. Debido a su mayor masa corporal el Picaflor tesoro generalmente es dominante sobre otras aves de la misma especie de menor tamaño restringiendo su acceso a las flores defendidas (Oniki & Willis, 2000). También les permite explorar una mayor variedad de recursos, lo que les hace competir entre ellas (Mendonça & dos Anjos, 2006).
Comportamiento antipredatorio: se ha observado ataques con el pico a la cabeza de los monitos sagüis hasta que se distanciaban del nido (De Lyra-Neves et al., 2007); En un estudio de un nido, en la zona urbana de São Paulo, se observó que una madre colibrí alejó a palomas Columbina talpacoti que intentaban de anidar cerca. Se interpretó que así redujo la posible atracción de las palomas a los depredadores, en los alrededores de su propio nido. Sin embargo, pequeños mamíferos, como el tití común (Callithrix jacchus), puede lograr de vez en cuando saquear los nidos, a pesar de los intentos de las aves para defenderlos (Oniki & Willis, 2000).
Martínez-García, Lara & Ornelas (2013) concluyen en que un periodo de floración extenso puede jugar un papel importante en el mantenimiento de la población local de E. macroura y que el comportamiento territorial es más evidente mientras obtiene néctar.
Los machos forman leks que son activos durante todo el año. Estos territorios no contienen ningún recurso para las hembras, salvo los machos en sí mismos. Las hembras visitan los leks para elegir libremente al macho. De aproximadamente 12 individuos, están separados de otros leks por lo menos por 50 m. Nunca se los observó alimentándose en la misma zona del lek.
No pasan la noche en estos territorios. Los machos comienzan sus vocalizaciones antes del amanecer (unos 27 min antes) y continúan durante 17 min aproximadamente. Luego de este periodo, mientras están en la percha, están unos minutos en silencio para luego abandonar el área de lekking hasta la mañana siguiente.
Este comportamiento es inusual, comparado con leks de otras especies de colibríes, dado el corto periodo de lekking, restringido justo antes del amanecer. Dado que los machos y hembras defienden sus territorios de alimentación el resto del día, este corto periodo puede representar 2 tiempos diferentes: de lekking y de alimentacion (Pizo & Silva, 2001; Martínez-García et al., 2013)
VOCALIZACIONESDan llamadas de advertencia cuando detectan aves o mamíferos carnívoros.
Su llamada incluye un «psek» y gorjeos más débiles. Llama con un «tik», cuando está asustado o excitado. Sonoro «tsak» «tsuk» (Pizo & Silva, 2001)
Canto: rápido y repetitivo “tsuc tsuc tsuc” que se trnasforma en un sonoro “tsi tsi tsi tsi tsi tsuit tsuc”, más frecuente en los machos en los leks y ocasionalmente durante encuentros agresivos. También durante interacciones agonísticas entre los leks (Pizo & Silva, 2001)
MIGRACIONESMigran cortas distancias entre norte y sur de Brasil, aparentemente relacionadas con la floración de ciertas especies de plantas en los meses secos de invierno (Vasconcelos y Lombardi, 1999). Sin embargo, la especie se considera residente en algunas áreas, por ejemplo, en la caatinga de Pernambuco (Las-Casas, Azevedo Jr. & Dias-Filho, 2012).
ALIMENTACIÓNBusca alimento más frecuentemente en los niveles medios, pero aprovecha fuentes de alimento a cualquier nivel, desde muy cerca del suelo, hasta el dosel (Stotz et al., 1996). No solo visita especies productoras de néctar, ya que existen evidencias de que tienen una estrecha relación con aquellas especies de plantas donde pueden capturar artrópodos.
Se cree que existe un mayor o menor consumo de artrópodos o de néctar en relación con las estaciones seca y lluviosa (Sick, 1997; Toledo & Moreira, 2008)
Esta variación podría estar en relación con su periodo reproductivo, periodo en el cual es muy importante obtener la mayor cantidad de energía útil, aunque se necesitan estudios futuros que lo corroboren. Lo que sí está reconocido en la mayoría estas especies es que la relación entre estacionalidad y tipo de alimento consumido coincide con los periodos de floración (Toledo & Moreira, 2008)
Utiliza tanto flores de especies nativas, como de algunas plantas ornamentales introducidas, incluyendo:
Leguminosae; Malvaceae: Pavonia viscosa (Vasconcelos & Lombardi, 1999), Malvaviscus arboreus (Marini et al., 2012), Hibiscus (Costa-Straube et al., 2006), Melochia tomentosa (De Las-Casas et al., 2012); Bombacaceae; Euphorbiaceae: Mabea fistulifera (Olmos & Boulhosa, 2000), Cnidoscolus, Jatropha mollissima, Croton blanchetianu (De Las-Casas et al., 2012); Fabaceae: Erythrina speciosa (Pizo & Silva, 2001; Baza Mendonça & dos Anjos, 2006), Bauhinia variegata, B. brevipes (Vasconcelos, 2008), Bauhinia cheilantha (De Las-Casas et al., 2012), Bowdichia virgilioides (Justino et al., 2012; Rojas & Ribon, 1997), Eythrina crista galli (Sick, 1997); Myrtaceae: Eucalyptus (Antunes, 2003), Callistemon viminalis (Pizo & Silva, 2001); Rubiaceae: Palicourea rigida (Justino et al., 2012); Verbenaceae: Clerodendrum sp. (Pizo & Silva, 2001), Stachytarpheta glabra (Vasconcelos et al., 1999); Vochysiaceae: Vochysia mapirensis (Helme 1996); Bromeliaceae: Aechmea maculata (Souza de Moura & Soares, 2010), Encholirium spectabile (De Las-Casas, 2012); Gesneriaceae (Souza de Moura & Soares, 2010); Bignoniaceae: Tabebuia impetiginosa (De Las-Casas, 2012), Spathodea campanulata (Baza Mendonça & dos Anjos, 2006); Cactaceae: Melocactus zehntneri, Tacinga palmadora y T. inamoena Pilosocereus (De Las-Casas et al., 2012); Plumbaginaceae: Plumbago scandens (De Las-Casas et al., 2012); Asteraceae: Stifftia chrysantha (Baza Mendonça & dos Anjos, 2005) e incluso de Caryocaraceae: Caryocar brasiliense en la estación seca (Melo, 2001)
También se alimenta de artrópodos tipo Homoptera (pulgones, cochinillas), Psocoptera, Diptera (moscas, mosquitos), Hymenoptera (abejas, avispas, hormigas) y Coleoptera (escarabajos) (Toledo & Moreira, 2008) incluso “swarming winged termites” (Sazima, 2008).
REPRODUCCIÓN
© Jos Roberto Peruca. Eupetomena macroura. Araatuba/SP – Brasil. Junio 2012. Algunos derechos reservados Se reproduce durante todo el año, incluidos lo meses de invierno ya que el nido generalmente está expuesto y es calentado por el sol; En Brasil de octubre a marzo y hasta junio en el estado de San Pablo (Pizo & Silva, 2001), y en en la región central entre septiembre y diciembre (Marini et al., 2012)
Mide exteriormente 44 mm de diámetro por 48 mm de altura. En su interior 32×18 mm (Oniki & Willis, 2000).
El nido en forma de copa construido en débiles ramas horizontales de arbustos o árboles (generalmente entre 1-3 m de altura, de fibra vegetal suave y pasto unido con tela de araña; revestido en el exterior con liquen y musgos (Davis, 1993; Marini et al., 2012). A veces reutiliza el nido.
La hembra pone dos huevos blancos y al igual que otros colibríes y se ocupa de la incubación (15-16 días) y cuidado de las crías (Oniki & Willis, 2000).
Cría altricial. Las plumas comienzan a aparecer al 5º día. Abandonan el nido a los 22-24 días, pero vuelven a dormir al nido siendo totalmente independientes unas 2-3 semanas después de emplumar.
En algunas situaciones, las larvas de moscardón Philornis pueden infestar las aves en el nido e incluso los polluelos pueden morir por la infección de estos parásitos (Oniki & Willis, 2000)
En el cortejo, el macho se sitúa frente a la hembra, despliega las alas y con la cabeza en posición estacionaria gira el cuerpo en un círculo horizontal durante unos 10 segundos; otra comportamiento del cortejo, previo a la copulación y preparación del nido: vuelo recto hacia arriba unos 3-5 m por encima de los matorrales, se mantiene en vuelo unos segundos y luego vuela horizontal o verticalmente unos 0,25 o 0,5 m, de nuevo se mantiene en vuelo unos segundos antes de cambiar rápidamente de posición (Davis, 1993).
-
Picaflor tesoro | Descripción

© Cláudio Dias Timm. Beija-flor-tesoura (Eupetomena macroura macroura) Octubre 2013. Algunos derechos reservados. Es la especie más grande de colibrí, entre 15 y 19 cm de longitud, aunque casi la mitad corresponde a la cola.
Los sexos son similares en color aunque en la hembra son más apagados, pero al mismo tiempo gran diferencia de tamaño y largo de la cola.
Macho: Pico negro, de tamaño medio, ligeramente curvado (Chaui -Berlinck & Bicudo, 1995) con bordes de la mandíbula lisos; las dos lamelas de la bifurcación de la lengua son largas, membranosas, cubiertas de papilas muy desarrolladas.
Cabeza, garganta y pecho azul violeta profundo. Pequeña mancha blanca, casi invisible, detrás del ojo.
Dorso, cubiertas alares, tapadas, flancos y vientre azul verdoso o verde bronceado iridiscente.
Alas más largas que las de las otras especies, de color marrón -negruzco oscuro.
Cola muy larga, ahorquillada, de color azul intenso. Remeras de color marrón negruzco
Rabadilla con banda castaño-rojiza. Mechón a cada lado del cuerpo y de la cloaca blancos. Su rasgo distintivo peculiar es la cola azul, larga y bien furcada.
Hembra: Ligeramente más pequeña (25%) y de colores más apagados. Cabeza y pecho azul pálido.
© Osvaldo Scalabrini. Eupetomena macroura, colibrí cola de golondrina, espectáculos de la fauna brasileña, Mato Grosso do Sul
-
Picaflor tesoro | Taxonomía
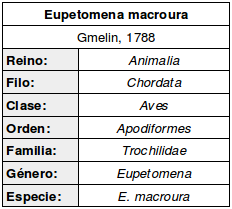
Protónimo: «Trochilus macrourus»
La mayoría de las autoridades clasifican esta especie como monotípica, en el género Eupetomena, aunque algunos la colocan en el género Campylopterus basados en los cantos y en el espesor de los ejes de las primarias de los machos Chébez et al., (2006) concluyen: En cuanto al uso del género monoespecífico Eupetomena -Gould,1849-61-para la especie, seguimos el criterio conservador adoptado por Remsen et al. (2005), a pesar de que Schuchmann (1999) la incluyó en el género Campylopterus -Swainson,1827- junto con otras tres especies, basándose en similitudes del canto y la morfología alar, que no fueron a nuestro entender claramente demostradas. (p. 50)
Subespecies y Distribución
Se reconocen 5 subespecies que se diferencian principalmente por el color de su plumaje, matices de azul (que van desde el azul verdoso al azul profundo) y de verde (desde verde-dorado hasta verde-azulado).
- E. m. macroura (J. F. Gmelin, 1788) – Surinam y norte, centro y sureste de Brasil (Amazonas–bordes de Rondonia; Amapá y Pará; Mato Grosso, Goiás y Minas Gerais hasta São Paulo) a Paraguay y extremo noreste de Argentina (Misiones) (Chébez et al., 2006) Partes azules de color ultramarino, partes verdes, verde botella.
- E. m. simoni (Hellmayr, 1929) – Ampliamente distribuida: Noreste de Brasil (Sur de Marañón, Piauí, Ceará, Pernambuco y Bahía hasta centro de Goiás y Minas Gerais). Partes azules, azul marino oscuro y partes verdes azuladas.
- E. m. cyanoviridis (Grantsau, 1988) – Sureste de Brasil (Sierra do Mar, al este de São Paulo). Partes azules teñidas de verde, partes verdes doradas a bronceadas.
- E. m. hirundo (Gould, 1875) – Sureste de Perú (Valle superior Río Urubamba, en centro Cuzco). Azul opaco, cola poco bifurcada.
- E. m. boliviana (J. T. Zimmer, 1950) – Sureste de Perú (Pampas del Heath – sureste de Perú cerca del límite con Bolivia) y Norte de Bolivia (La Paz, Beni). Es la subespecie más verde (la cabeza es más verde que azul, siendo el verde brillante más puro).
-
Picaflor tesoro (Eupetomena macroura)

Histoire naturelle des oiseaux-mouches: ouvrage orné de planches dessinées et gravées par les meilleurs artistes … Lesson, R. P . (1829) Lámina XXV Especie muy extendida en el centro y este de América del Sur.
Fácilmente reconocible por su tamaño grande, vistoso plumaje violeta-verdoso, larga cola ahorquillada (semejante a la de las golondrinas) y pico corto y semicurvado.
Entre todos los miembros de la familia Trochilidae esta especie de picaflor es fácilmente reconocible por su tamaño, llegando a los 15–18 cm de longitud total, correspondiendo a la cola unos 7–9 cm; es el colibrí más grande del noreste argentino, aventajado en el país solo por el Picaflor Gigante (Patagona gigas) y el Picaflor Cometa (Sappho sparganura). Atrae muchísima atención por su comportamiento agresivo en defensa de su territorio y por ser una de las especies más abundantes en las ciudades.
NOMBRES VULGARES: Colibrí golondrina (España); Picaflor golondrina (Bolivia), Picaflor tijereta (Argentina y Paraguay); Colibrí de cola ahorquillada (Perú); Beija-flor-cauda-de-andorinha, beija-flor-grande, beija-flor-preto, beija-flor-rabo-de-tesoura, Beija-flor-tesoura, tesourão (Brasil); en guaraní «Mainumby jetapa»
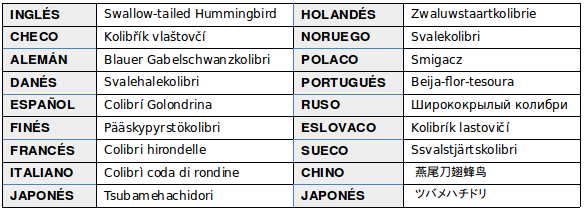
EN OTROS IDIOMAS:
BREVES APUNTES HISTÓRICOS:
- Ornithologie. Brisson, Mathurin-Jacques, Martinet, François Nicolas. Parisiis :Ad Ripam Augustinorum, apud Cl. Joannem-Baptistam Bauche, bibliopolam, ad Insigne S. Genovesae, & S. Joannis in Deserto,1760. Vol III: 704 ; Lámina XXXVI (Fig 3) (Mellisuga cayenensis)
- Index ornithologicus. Latham, John. Londini :Sumptibus authoris :1790. Vol I: 304 (Trochilus forcipatus)
- Histoire naturelle des oiseaux-mouches : ouvrage orné de planches dessinées et gravées par les meilleurs artistes … Lesson, R. P . (1829) Ilustración XXV (Oiseau-mouche hirondelle)
- Oiseaux brillans du Brésil. Descourtilz, J. T. (Jean Théodore). Paris, 1834. Lámina LIV (Oiseaux-mouche hirondelle)
- An introduction to the Trochilidae, or family of humming-birds. Gould, John. London :Taylor & Francis,1861.
- A monograph of the Trochilidæ, or family of humming-birds. Gould, John, Richter, Henry Constantine, lithographer. Hullmandel & Walton, printer of plates. Walter & Cohn printer of plates. (1861); Vol I: Lámina II (Eupetomena hirundo)
- Histoire naturelle des oiseaux-mouches, ou, Colibris constituant la famille des trochilidés. Mulsant, Martial Étienne. Lyon :Au Bureau de la Société Linnéenne,1874-1877. Vol I: 111 (Eupetomena macroura)
- Catalogue of the birds in the British Museum. British Museum (Natural History). Department of Zoology. London, 1874-98; Vol 16: 295-296 (Eupetomena macrura)