-
-
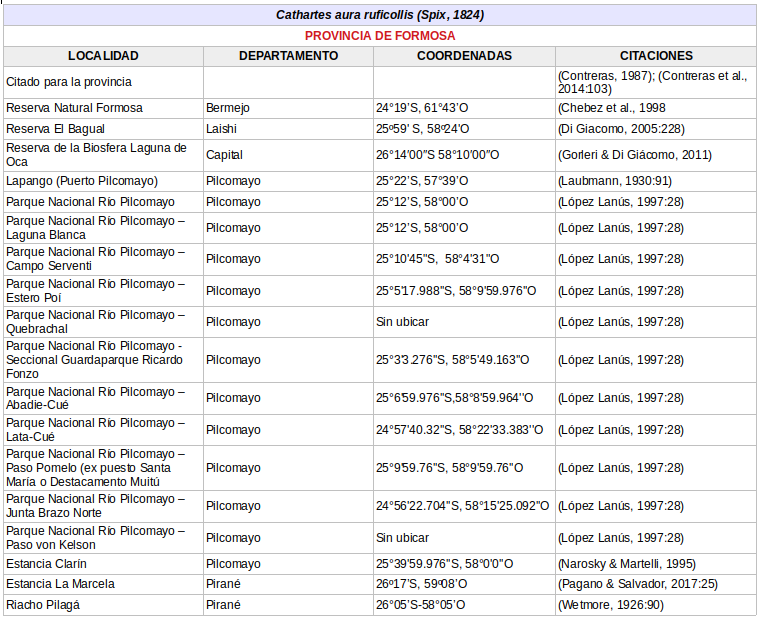
Provincia de Formosa
-
Provincia de Buenos Aires
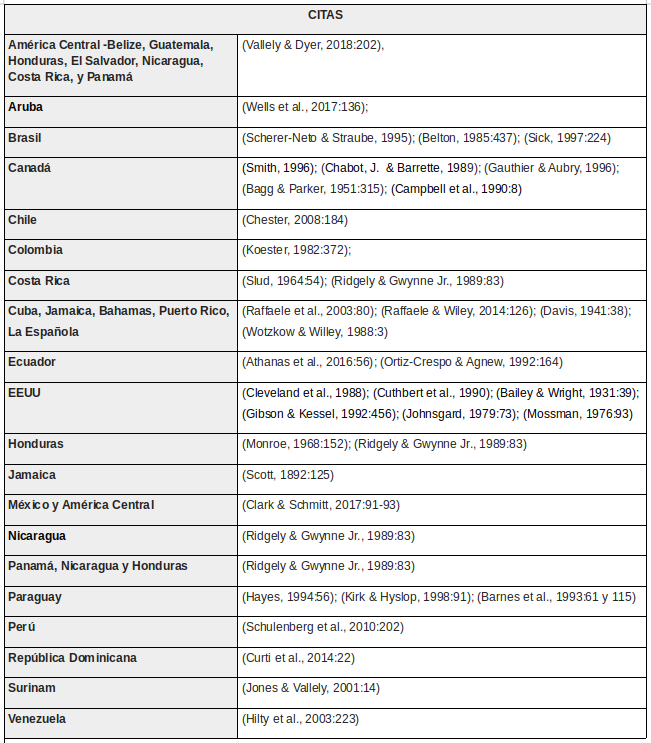
Cathartes aura jota (Molina, 1782) Localidad Partido/Departamento Coordenadas Citaciones Citado para la provincia (Darrieu & Camperi, 2001:12); (Darrieu, et al., 2013:14); (Roesler & Agostini, 2012:107); (Narosky & Di Giacomo, 1993:34) Punta Rasa Partido de la Costa 36°22’S, 56°43’O (Bremer & Bremer, 1987) Sierra de la Ventana Torquinst 38°08’S, 61°47’O (Doiny Cabré & Lejarraga, 2007) Reserva Natural Integral de Selva Marginal de Punta Lara Berazategui y Ensenada 34°47’S, 58°01’O (Klimaitis & Moschione, 1986); (Klimaitis & Moschione 1987) Bahía Blanca Bahía Blanca 38°44’S, 62°16’O (Marelli, 1933:194) Monte Veloz Punta Indio 35°27′00″S, 57°17′00″O (Pagano & Mérida, 2009: 210) Reserva Costanera Sur CABA 34°38’S-59°28’O (Pugnali, et al., 2016:3) Saladillo Saladillo 35º45’S, 59º47’O (Roda & Danti, 2015:33) -
Jote cabeza colorada | Bibliografía
Contenido restringido para suscriptores. Suscripción gratuita para acceso a la bibliografía completa y sus enlaces. Pinchar en "Ingresar" para crear su perfil de suscriptor -
Jote cabeza colorada | Conservación
Esta especie tiene un rango extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). La tendencia de la población parece estable, por esto esta especie no alcanza los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población es extremadamente grande, por lo tanto esta especie no se aproxima a los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como de “preocupación menor” (Stotz, 1996:142)
En Argentina:
CARPFS-NA: No amenazada según CARPF (Consejo Asesor Regional Patagónico de la Fauna Silvestre) Recalificación del estado de conservación de la Fauna Silvestre 1ra. edición
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable) López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable) Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010.
-
Jote cabeza colorada | Distribución
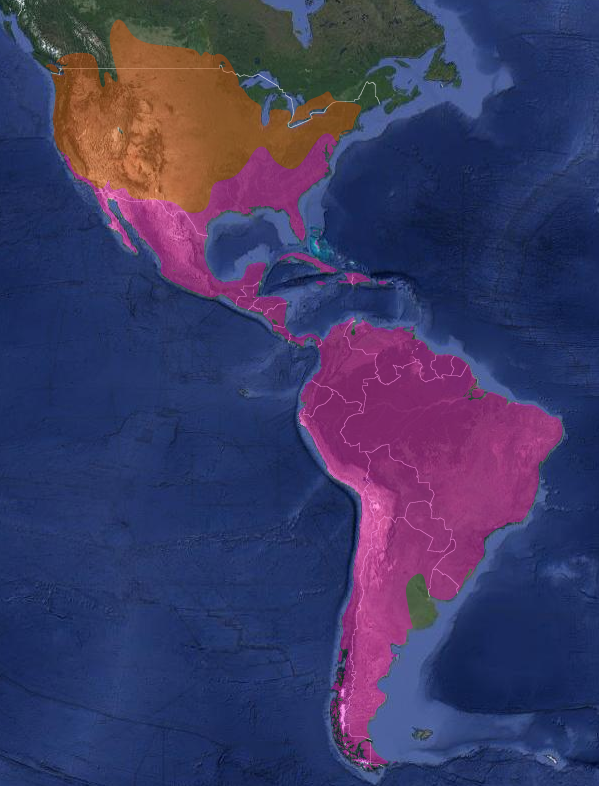
InfoNatura: Animals and Ecosystems of Latin America 2007 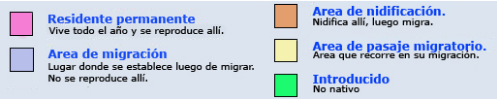
Se distribuye desde Canadá (donde nidifica desde el sur de Columbia Británica, sur de Prairies – en el oeste de Canadá, incluyendo la porción canadiense de las grandes praderas y las provincias de Alberta, Saskatchewan, y Manitoba-, sur de Ontario y norte de Nueva Inglaterra) hacia el sur, hasta México, América Central y Sudamérica hasta Tierra del Fuego e Islas Malvinas. Pasa el invierno desde centro de California, sur de Arizona y Nuevo México, Texas, y sur de Nueva Jersey (Stotz, 1996:142); (Raffaele, 1989). En Centroamérica nidifica también en la mayoría de las islas, como Isla Margarita (Venezuela), Trinidad, Bahamas, Cuba e Isla de Pinos, Jamaica, República Dominicana y Puerto Rico (Raffaele, 1989).
En Argentina: (De la Peña, 1999:37); (De la Peña, 2015:139); (De la Peña & Salvador, 2016:152); (Barnett & Pearman, 2001:30); (Olrog, 1959:74)
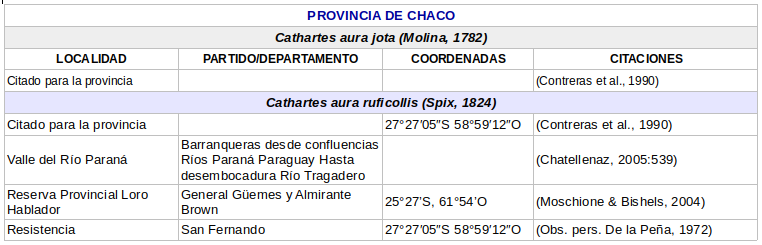
- Cathartes aura ruficollis (von Spix, 1824), en las provincias de: Formosa, Chaco, Corrientes, Misiones, Entre Ríos y Santa Fe. (Enlaces a citaciones y coordenadas)
- Cathartes aura jota (Molina, 1782), Jujuy, Salta, Tucumán, Santiago del Estero, Catamarca, La Rioja, San Juan, Mendoza, Córdoba, San Luis, La Pampa, y sur de Buenos Aires, Neuquén, Río Negro, Chubut, Santa Cruz, Tierra del Fuego, Isla de los Estados e Islas del Atlántico Sur. Nidifica en las Islas Malvinas (Carma, 2009:97) (Enlaces a citaciones y coordenadas)
HÁBITAT
Según el autor (Kiff, 2000:176), en Norteamérica su hábitat preferido para alimentarse incluye cultivos (Graber & Graber, 1963:464) y bosques, aunque para nidificar prefiere áreas forestadas, aisladas de los humanos y tal vez de los depredadores (Coleman & Fraser, 1989b:34).
Para el descanso comunitario, prefiere árboles grandes alejados del ser humano, preferiblemente en zonas altas (colinas, montañas) que le proporcionen corrientes de aire ascendente para volar, especialmente en el norte de EEUU, donde las térmicas pueden ser débiles e impredecibles (Coleman & Fraser, 1989b:16); (Mossman & Hartman, 1992:39); observado también a orillas de carreteras en Pennsylvania (Bunn et al., 1995:544)
En Puerto Rico, más frecuente en bosque seco subtropical y menos común en bosque subtropical y bosque húmedo (Santana et al., 1986b:236)
Desde el nivel de mar hasta los 4.300 msnm (Kiff, 2000:176); (Stotz, 1996:142)MIGRACION
Las poblaciones del este de EEUU en su mayor parte pasan el invierno al sur del país, mientras que las del oeste migran hacia el sur, a Centroamérica hasta Paraguay (Brown & Amadon, 1968); (Kiff, 2000:176); (Brown, 1976:911); (Purdue et al, 1972:92); (Smith, 1985:273); (Van Tyne & Trautman, 1945:203); Esto demuestra que muestran diferencias en su migración, algunos individuos migran grandes distancias, otros cortas o permanecen sedentarios (Kirk, 1988:3)
Los autores (Bussjaeger et al., 1967:425), observaron durante los meses de marzo y abril grandes bandadas migrantes de C. aura sobre Veracruz, al igual que Ruelas-Inzunza et al. (2010:124); bandadas similares fueron avistadas durante el otoño en Panamá por Loftin, (1963:64); Cayos de Florida, (Darrow, 1983:36) en el mes de noviembre. Muchas veces migran en bandadas mixtas inmensas (C. atratus, C.aura y unos pocos buteos (Hicks et al., 1966:123) y Costa Rica (Riba- Hernández et al., 2012:234)
El vuelo del C. Aura involucra en su mayoría las corrientes térmicas (Bohrer et al. 2012). Cuando migran no es frecuente que desciendan a tierra en América Central, excepto en las malas condiciones de vuelo.
Se privan de alimento durante mucho tiempo en las migraciones de largas distancias (Bildstein 2006), y en promedio requieren hasta 40 días para recuperar la pérdida de masa corporal cuando llegan a Venezuela (Kirk and Gosler, 1994:941); (Hedlin et al., 2013:149)
En las zonas con población estable durante todo el año, el uso del hábitat puede variar, por ej. pasan más tiempo en zonas sin carreteras, o aumentan el uso de zonas urbanas (Gaby, 1982); y los residentes pueden cambiar su hábitat habitual en respuesta al flujo de migrantes.
En los llanos de Venezuela, los migrantes invernales de C. a. meridionalis prefieren hábitats abiertos o semi-abiertos (sabanas, zona de matorrales, humedales abiertos) más que bosques en galería y semi-deciduos, mientras que el residente C. ruficollis restringe su área de alimentación durante este periodo, mayoritariamente a los bosques en galería y aparentemente se mueven hacia zonas más abiertas cuando los migrantes se van (Kirk & Currall, 1994:332); (Kirk, 1988:10); (Kirk, & Houston, 1995:323) -
Jote cabeza colorada | Comportamiento
Pasa la mayor parte del día buscando carroña, volando a alturas moderadas. Localizan la carroña con el olfato y la vista (Applegate, 1990:141), (Bang & Cobb, 1968:58); según Bang (1972:153), el bulbo olfatorio es más grande cuando se compara con los hemisferios cerebrales del C. atratus. Se los ha registrado, de forma aislada, cazando peces y animales vivos, generalmente por estar enfermos o discapacitados. Los estudios demuestran que comen carroña de presas más pequeñas que el C. atratus.
Se posa en árboles muertos, sin follaje, o en estructuras artificiales como torres de agua (Clark & Schmitt, 2017:92-93). Suelen hacerlo en grandes grupos, aunque durante el día buscan alimentos de forma independiente.
Pasa la noche en grupos comunitarios (pudiendo agruparse varios cientos de buitres para pasar la noche), a veces incluso con Jotes Cabeza Negra (Coragyps atratus) (Davis, 1979:124); (Buhnerkempe & Westemeier, 1984:496; (Clark & Schmitt, 2017:92-93)
A pesar de que anida en cuevas, no entra en ellas para descansar, excepto durante la época de reproducción. Durante la noche, reduce su temperatura corporal cerca de 6 grados centígrados hasta 34º C, volviéndose ligeramente hipotérmico. (Hatch, 1970:111); (Heath, 1962:234)
Frecuentemente posa con las alas extendidas. Se cree que esta postura cumple con múltiples funciones: secar las alas, calentar el cuerpo y combatir bacterias, sobre todo después de noches lluviosas o húmedas (Clark & Ohmart, 1985:353). El mismo comportamiento es observado en otros buitres americanos, buitres del Viejo Mundo, y cigüeñas. A menudo defeca sobre sus propias patas como medio para disipar el calor tras la evaporación del líquido contenido en las heces y la orina, un proceso conocido como urohidrosis (Hatch, 1970:111) De esta forma enfría los vasos sanguíneos que pasan por las patas y pies y causa manchas blancas por el ácido úrico que cubre las piernas. Cuando se encuentran expuestos a alta temperatura ambiente, controlan su temperatura extendiendo el cuello, desplegando las alas y mediante la urohidrosis (Arad & Bernstein, 1988:917); Arad et al. (1989:505), demostraron la extensa vascularización de la piel en la cabeza implume, cuello, nuca y pies; significa que los C. aura tienen un muy bien desarrollado sistema arterio-venoso intercambiador de calor en la cabeza, alas y patas (Arad et al., 1989:514)
Requiere de un gran esfuerzo para alzar el vuelo, batiendo sus alas mientras salta. El vuelo activo es lento, con aleteos profundos (cuando inclinan las alas hacia abajo, algunas veces tocan las puntas de las alas (Clark & Schmitt, 2017:92-93); (Mueller, 1972:221). Se elevan y planean con las alas en “V” (diedro). Las alas largas y anchas, y sus colas relativamente cortas están bien adaptadas para el vuelo planeado sobre la horizontal, balanceándose frecuentemente de un lado a otro (De la Peña & Salvador, 2016:151); (Narosky & Yzurieta, 2010:90); es un ejemplo de vuelo estático, aprovechando térmicas para mantener su altitud, a veces durante horas, sin necesidad de batir sus alas. Se desplaza en el suelo, con saltos torpes y muy desgarbados.
El C. aura tiene pocos depredadores naturales. Pueden caer presa de águilas reales, águilas, y búhos cornudos. Los huevos y polluelos pueden caer presa de mamíferos tales como mapaches y zorros. Su principal forma de defensa es regurgitar carne semi-digerida, una sustancia maloliente que irrita los ojos, con la que logra disuadir a la mayoría de las criaturas con intenciones de asaltar un nido de buitres. Un buitre también puede verse obligado a regurgitar una comida semi-digerida para deshacerse rápidamente del peso en su buche y poder tomar vuelo con el fin de huir de un depredador potencial. (Forbush, 1927: 91); (Vogel, 1959:213). No defienden su territorio.
VOCALIZACIONESComo la mayoría de los buitres, carecen de complejidad en las vocalizaciones. Producen gruñidos y silbidos principalmente para disuadir a los depredadores.
Pemberton (1925:38) las describe así, “Emiten una voz distintiva nasal, un quejido de tono bajo, suave y repetido a intervalos de 3 segundos y que semeja a los quejidos de los cachorritos”; el autor hace notar que no abren el pico cuando emiten sonidos.
Según Allard (1934:515), antes de emprender vuelo emiten varias notas peculiares, comenzando con un corto, “tschuck, tschuck”, repetido varias veces y seguido una nota quejosa que repite 2 á 3 veces. A continuación despegan y vuelan.
ALIMENTACIÓNBusca alimento utilizando su sentido del olfato, un sentido compartido con los demás buitres del género Cathartes, pero poco común en el mundo de las aves. Localiza carroña al detectar el olor del etilmercaptano, un gas producido al inicio de la descomposición en los animales muertos. El lóbulo olfativo de su cerebro, responsable del procesamiento de los olores, es particularmente grande en comparación con otros animales. Se sabe que el Cathartes aura posee un sistema olfatorio anatómicamente bien desarrollado y fisológicamente funcional. Estudios anatómicos comparativos indican que, el tamaño relativo del bulbo olfatorio del C. aura es ocho veces más grande que el de 108 especies estudiadas por Bang & Cobb (1968:58); (Smith & Paselk, 1986:586)
Los seres humanos también aprovechan del sentido del olfato de los buitres americanos: se inyecta etilmercaptano en los oleoductos, y a continuación los ingenieros en busca de fugas monitorizan los vuelos de los buitres que buscan alimento.
Con su sentido del olfato superior tiene ventajas en la localización de la carroña y suele ser el primero en llegar a ella (Houston, 1986:318); (Houston, 1988:130); (Stager, 1964:3). Sin embargo, a pesar de su superior habilidad para detectar comida, los C. aura tienen pocas oportunidades de consumir los cadáveres de animales que descubren porque, los C. atratus frecuentemente se apropian de la comida. Las diferentes estrategias de alimentación de las dos especies se reflejan perfectamente en la altura a la que vuelan. El C. aura vuela cerca del suelo, donde la percepción olfatoria es más fuerte y sus posibilidades de encontrar cadáveres pequeños es mayor, mientras que el C. atratus busca comida volando más alto u observando los individuos que descienden, como señal para localizar las carcasas (Buckley et al., 1996:485); (Wallace et al.,1987:293); (Lemon, 1991:700).
Los C. aura pueden desgarrar carcasas de pequeño y mediano tamaño, pero no pueden con las de gran tamaño. Si ellos consiguen llegar a las carcasas pequeñas antes que otras especies, pueden obtener alimento sin interactuar con otros especímenes más dominantes que llegan más tarde. Aunque los C. aura individualmente son dominantes sobre un solo C. atratus, son intimidados los grupos de C. atratus, que a menudo suelen ser muy numerosos (50 individuos) (Wallace et al., 1987:293)
Es muy raro que los C. aura compartan la comida entre ellos y son reticentes a comer cerca de otros individuos (< 2m). Alimentarse en grandes grupos parece ser menos eficiente en los C. aura. Parece que defienden áreas a distancias mínimas unos de otros, en los sitios de alimentación. Las distancias individuales podrían ser mantenidas a través del reconocimiento pasivo del estatus social, reivindicando su posición dominante con picoteos amenazantes y más raramente con peleas. Estos actos o demostraciones agresivas pueden interferir con la alimentación del agresor (Prior et al., 1991:1555).
Se alimenta principalmente de una amplia variedad de carroña, desde pequeños mamíferos a herbívoros grandes (Coleman & Fraser, 1987:733); (de la Peña & Salvador, 2016:151); (Di Giacomo, 2005); (Salvador et al., 2017:103); (Hiraldo et al., 1991:321); (Prior, 1990:709), prefiriendo los recién muertos (Lemon, 1991:702), y evitando los cadáveres que han llegado al punto de putrefacción (Owre & Northington,1961:200). Raramente se alimenta de materia vegetal (vegetación de ribera, calabazas u otros cultivos), y de insectos vivos y otros invertebrados (Crafts Jr., 1968:327); (Paterson, 1984:469). (Pinto (1965:276), lo observó alimentándose de frutos de Palmera (Elaeis guineensis)
Se ha observado a los C. aura y C. atratus consumiendo huevos de tortugas verdes (Chelonia mydas) (Fowler, 1979:946) y a los C. aura alimentándose de huevos en colonias de aves marinas (Kirk and Mossman, 2020), de cocodrilo americano (Crocodylus acutus) (Platt et al., 2014:39) y de phoenicopterus chilensis (Sosa, 1999:95)
Es poco común que cace y mate a sus presas (Galding & Glading, 1970:244); (Mueller & Berger, 1967:431). Hamilton (1941:254), comenta que el ataque de Cathartes aura a unas crías de cerdos, cerca de Fort Myers (Florida), pudo haber sido un “caso de error de identificación” (Parmalee, 1954:443). A menudo se le puede observar a lo largo de las carreteras (Rea, 1973:210), alimentándose de los cadáveres de animales atropellados, o cerca del agua, alimentándose de peces varados en bancos a orillas de ríos (Jackson et al, 1978:142); (Platt et al., 2009:840). Al igual que otros buitres, desempeña un papel importante en su ecosistema, librando al ambiente de la carroña que de otro modo podría producir enfermedades.
Los autores (Coleman et al.,1985:291), mientras estudiaban los hábitos alimenticios de los Cathartes, los observaron comiendo sal a 4 km al sur de Gettysburg (Pennsylvania).
REPRODUCCIÓNA menudo, el apareamiento entre los C. aura, es precedido por una especie de danza gregaria: varios individuos se juntan en el suelo de un claro, rodeando a una hembra; realizan movimientos de salto con las alas extendidas en todo el perímetro del círculo; un individuo salta hacia su vecino, el cual a continuación salta y se aproxima a un tercero, etc, mientras, otros buitres posados en árboles cercanos bajan para sumarse a la “danza”, mientras otros “bailarines” se retiran (Loftin & Tyson, 1965:193). También realizan vuelos de cortejo, lanzándose o persiguiéndose entre sí.
No construyen nido. Depositan los huevos en cuevas pequeñas, sobre el piso, bajo vegetación espesa, e incluso en edificios y coches abandonados (Igl & Peterson, 2010:73). Tiene más cuidado en la elección del sitio que en la construcción del mismo (Coles, 1944:222)
El Cathartes aura septentrionalis, por el contrario, tiene una mayor diversificación en la elección de sitios para anidar. Se han encontrado nidos en acantilados, así como, en pantanos, cuevas, laderas abruptas o escondidos en ciénagas saladas. Ubica sus nidos en bosques, arbustos y matorrales, a lo largo de cursos de agua y en estructuras abandonadas (Coles, 1944:219); (Sarasola, 2000:60)
Moroni et al. (2014:51-52), comenta: “El Jote Cabeza Roja nidifica en forma variada en nuestro país: en huecos de árboles (Hartert & Venturi 1909, de la Peña 2005), entre rocas (Sarasola et al. 2000), en el suelo debajo de arbustos (De Lucca et al. 2012), en la base de matas de paja y en ocasiones en cuevas (Woods 1988)”.
Se reproducen una vez al año. El inicio de la temporada reproductiva varía dependiendo de la latitud en que permanece. En el norte del área de distribución se inicia entre principios de marzo hasta junio
Las hembras suelen poner dos huevos (con diferencia de 1 día), aunque la puesta puede variar entre uno y tres huevos. Huevos ovoides, blanquecinos, blancos grisáceos o verdosos con manchas castañas oscuras y pintas grises, más concentradas en el polo mayor. Algunos con pocas pintas y manchas. (Coles, 1944:223); (De la Peña, 2013:87)
La incubación se inicia una vez que está completa la puesta. Ambos padres participan en la incubación, que dura entre 30-40 días (Coles 1944:227). Los periodos de incubación más cortos reportados son de 32 días (Gentry, 1882) y Audubon, 1835); 30 días (Burns, 1937), (Jackson, 1903) y (Kempton, 1927); (Coles, 1944:224).
Crías altriciales, nacen ciegos, desnudos e indefensos. Durante unas 10 u 11 semanas, cuidan de los polluelos y les dan de comer regurgitando. Cuando los adultos están amenazados mientras anidan, pueden regurgitar sobre el intruso, fingir la muerte, o huir del nido. Si los polluelos se ven amenazados en el nido, se defienden silbando y regurgitando. Los polluelos permanecen en el nido durante 9 a 10 semanas. Los grupos familiares permanecen juntos hasta el otoño.
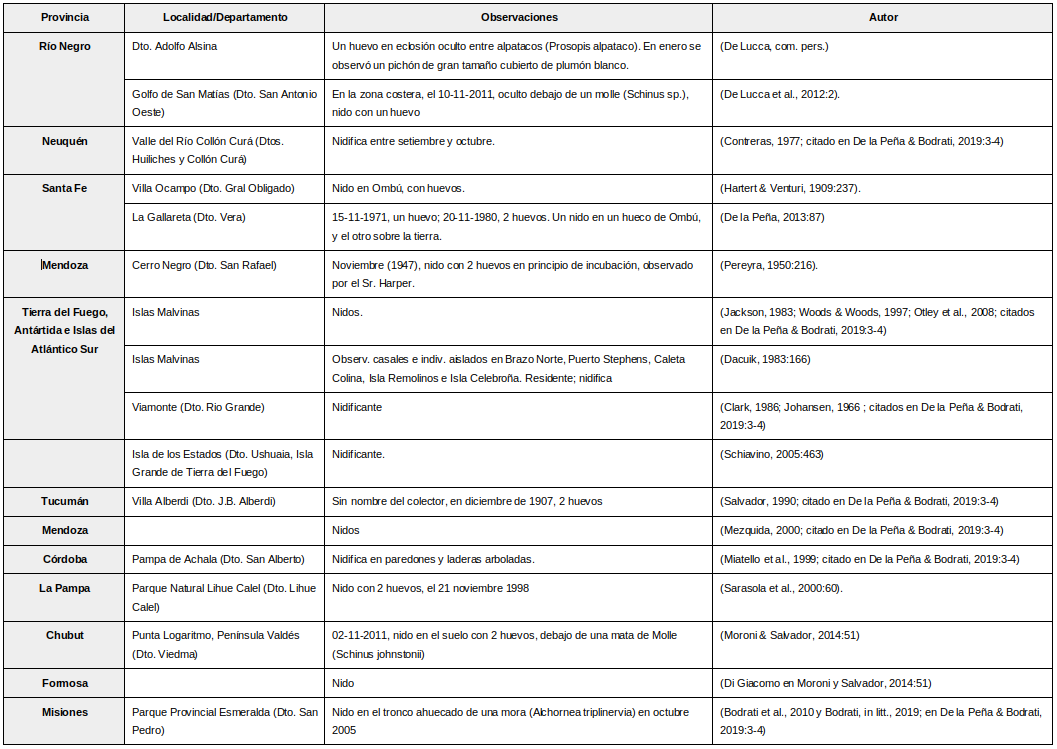
Argentina: Aunque es una especie ampliamente distribuida en el continente americano (Bendire, 1892:163), su rango de reproducción en Argentina no es bien conocido. Se localizaron nidos en Mendoza, Santa Fe, Tucumán, Formosa, Misiones, La Pampa, Córdoba, Neuquén, Río Negro, Chubut, Tierra del Fuego e Islas Malvinas, en los meses, octubre, noviembre y diciembre (De la Peña & Salvador, 2016:151); (De la Peña, 2013:87); (De la Peña & Bodrati, 2019:3-4)
Se citan los registros de nidificación conocidos:
-
Jote cabeza colorada | Descripción

© Hoffman, D.A. Turkey vultur (Cathartes aura). Sonoma County, California. Julio 2018. Algunos derechos reservados 
© Mike Baird. Turkey Vulture (Cathartes aura). Morro Bay, California. Marzo 2008. Algunos derechos reservados. Ambos sexos son idénticos en plumaje y coloración, aunque la hembra es ligeramente más grande (Snyder & Wiley, 1976:57); (Gaby, 1982)
Todas las plumas son marrón oscuro; manto, remeras terciarias y secundarias con los bordes más claros; las plumas oscuras especialmente sobre la nuca y zona superior del lomo con iridiscencias azules, púrpura o verdes. Remeras, timoneras y tapadas parecen plateadas por debajo porque los raquis ventralmente son blanquecinos. Carecen de plumón de talco (Rea, 1983). Las alas son largas. Planea en “V” sobre la horizontal.
La cola es larga, angosta, rectangular, sobresale con relación a las patas cuando vuela o está asentado y a su vez no es sobrepasada por las alas plegadas. (De la Peña & Salvador, 2016:152)
La cabeza es pequeña en proporción al cuerpo. El color de piel de la cabeza y el cuello puede variar de rosado a rojo brillante. Cabeza y cuarto distal del cuello desnudos, con cerdas negruzcas o rojizas brillantes sobre la cera. La piel de la nuca y corona es corrugada transversalmente, permitiendo la extensión del cuello y que el collar de plumas se retraiga durante la alimentación y acicalamiento. Papilas blancas, a menudo concentradas en frente del ojo y a través de la frente.
Las fosas nasales no están separadas por un tabique, sino que están perforadas. Carece de siringe (Miskimen, 1957:104).
El ojo tiene una sola fila incompleta de pestañas en el párpado superior y dos filas en el párpado inferior. Iris beige o marrón hasta marrón oscuro (mucha variación)
Pico relativamente corto, ganchudo, de color marfil.
Las patas son de color rosado, a menudo con manchas blancas por los excrementos. Los dedos delanteros de los pies son largos y tienen pequeñas membranas interdigitales en sus bases. Las garras son planas, relativamente débiles y poco adaptadas a agarrar ya que son relativamente romas (Kirk & Mossman, 2020)
Anualmente pasa por una muda gradual que se inicia a finales del invierno hasta inicios de la primavera y que dura hasta principios del otoño. En los adultos generalmente es completa, finalizando con las 3 primarias internas (Kirk & Mossman, 2020); (Clark & Schmitt, 2017:93)
Las remeras y timoneras mudan a lo largo del año, pero esto se reduce, aparentemente, o se suspende durante la migración (Kirk & Mossman, 2020)
No se sabe exactamente qué edad puede alcanzar. La esperanza de vida máxima registrada en C. auras es de 16 años (Clapp et al., 1982:103). En cautiverio es más elevada, en general 21 años, aunque existe un ejemplar en Minnesota con una edad confirmada de 34 años (Kirk & Mossman, 2020)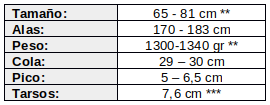
* (Wetmore, 1964:2); ** (de la Peña & Salvador, 2016:150); *** (Aráoz et al., 2016:346) -
Jote cabeza colorada | Taxonomía

* Los Jotes o Buitres americanos integrantes de esta familia son elevados a un orden separado: Cathartiformes. Propuesta aceptada por el SACC (South American Classification Committee) Subespecies y Distribución:
La diferenciación entre las taxonomías de las subespecies está mal definida por diferencias en el tamaño (largo de alas y cola) y la coloración, incluyendo plumaje y piel desnuda de cabeza y cuello. Se reconocen al menos (dependiendo de las diferentes autoridades) 6 subespecies: (Stresemann & Amadon, 1979:275); (Friedmann, 1950:34); (Wetmore, 1964:2); (Brown & Amadon, 1968:173);(Bildstein, 2017:5-6); (Clark, 2017:91)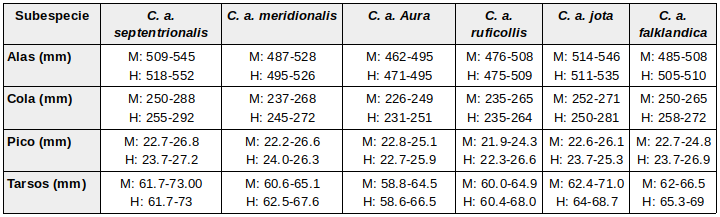
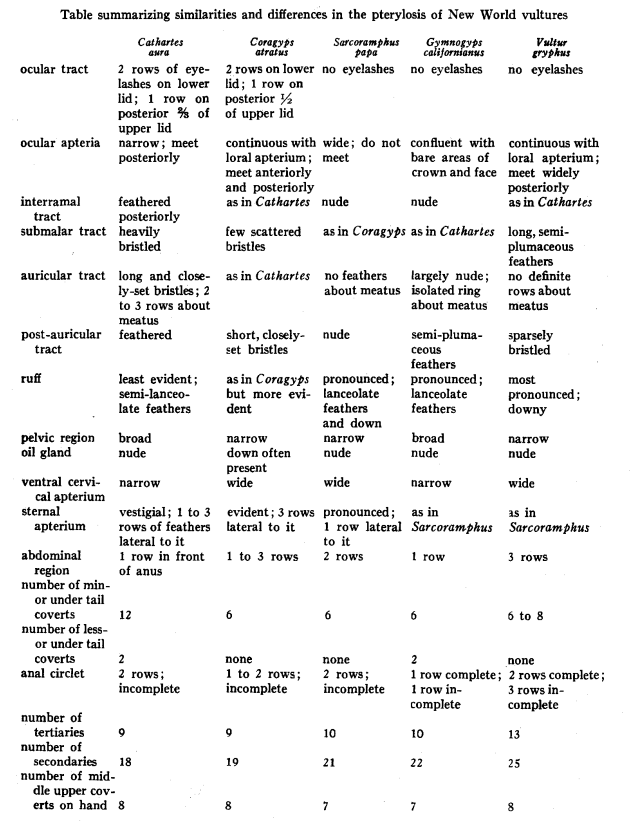
Dimensiones; adaptado de Wetmore (1964:1-18) Fisher (1943:72-73), estudió la “pterylosis” de los cathartidae (distribución de las plumas sobre el cuerpo del ave – Erritzoe et al., 2007:213), demostrando que la pterylosis de cada género tiene ciertas particularidades, que el autor resume en la siguiente tabla:

© Snowmanradio. Turkey Vulture (Cathartes aura aura). Jalpan de Serra, Querétaro, México. Agosto 2009. Algunos derechos reservados C. a. aura (Linnaeus, 1758); es la subespecie nominal. Su área de distribución se extiende desde México, América Central, América del Sur y Antillas Mayores y de vez en cuando se superpone al de otras subespecies. Se reproduce en sur de California, sur de Nevada, Arizona, Nuevo México y sur de Texas hasta Costa R y también Antillas Mayores. Durante el invierno hasta sur de México y Panamá. Más pequeño que el meridionalis, alas y cola más cortas aunque las medidas se solapan considerablemente; Rea (1983), midió los huesos de las alas en ejemplares de Arizona y concluye que el meridionalis reemplaza al aura en invierno; la distinción entre estos dos grupos es muchas veces arbitrario y algunos autores agrupan al meridionalis con el aura (Wetmore, 1964:6); (Hellmayr & Conover, 1949:8). Los especímenes identificados como aura por Burleigh, (1938:520) fueron refutados por Wetmore; las medidas de los migrantes del sur de Florida coinciden mejor con septentrionalis, mientras que los residentes son intermedios entre septentrionalis y aura (Gaby, 1982)

© Frank Schulenburg. Turkey vulture (Cathartes aura septentrionalis) at Las Gallinas Wildlife Pond, Marin County, California. Octubre 2017. Algunos derechos reservados. C. a. septentrionalis (Wied-Neuwied, 1839); se distribuye desde el sureste de Canadá hacia el sur por el este de Estados Unidos. Es menos migratoria que C. a. meridionalis y raramente migra más allá del sur de los Estados Unidos (las poblaciones del norte emigran hacia el sur en invierno). Se reproduce en oeste de Norte América a Minnesota, Kansas, Oklahoma, y este de Texas. De gran tamaño y bordes de cubiertas alares más pálidos, anchos y más prominentes que las otras subespecies; remeras secundarias distales también con bordes y puntas castaños más pálidos que las otras subespecies. Papila facial generalmente prominente.

© Frank Schulenburg. (Cathartes aura meridionalis). Tomales Bay, Marin County, California. Diciembre 2014. Algunos derechos reservados C. a. meridionalis (Swann, 1921); C. a. meridionalis, es un sinónimo de C. a. teter (Friedman, 1950:45). Es la subespecie que cubre más distancia durante su migración anual, hasta llegar a América del Sur (Brasil y Paraguay) donde se superpone al área de distribución de C. a. aura. Se reproduce al este de Norte América hacia el sur de Manitoba y sur y centro de Texas. De menor tamaño que el septentrionalis y cola similar; final de las cubiertas alares menores y final y puntas de las remeras secundarias de color marrón. Las cubiertas alares pueden desteñirse al final del verano en las regiones áridas. Papila facial presente en su distribución este y ausente en la porción oeste del rango. Se solapa con septentrionalis a lo largo de una franja desde Michigan hasta Minnesota en el norte hasta este de Texas en el sur. Las medidas y patrón facial de los residentes locales en el sur de Wisconsin son semejantes al septentrionalis, pero el patrón de migración semeja al meridionalis.
.

© Barloventomagico. Oripopo [Turkey Vulture] (Cathartes aura ruficollis)
Lugar: El Paraíso, centro-norte de Venezuela. Junio 2013. Algunos derechos reservadosC. a. ruficollis (Spix, 1824); se distribuye de Panamá hacia el sur hasta Uruguay y Argentina. También se encuentra en la isla de Trinidad. De plumaje más oscuro que las subespecies del norte; bordes marrón oscuro en las cubiertas alares, y a lo largo del vexilo externo de las remeras secundarias que es mucho más restrictivo y aún ausente en las subespecies del norte (Hellmayr & Conover, 1949:8). Líneas transversas verdosas-blanquecinas distintivas en corona posterior y nuca (en vuelo semejante a un collar blanco).

© Bernd Dietrich. Gallinazo Cabeza Roja Austral (Cathartes aura ssp. jota). Ica, Perú. Mayo 2017. Algunos derechos reservados C. a. jota (Molina, 1782); grande (similar el septentrionalis); plumaje negruzco, un poco más marrón y pálido que el ruficollis; bordes de remeras secundarias gris-pálido que a veces se extienden a las cubiertas alares; cabeza roja. Residente en las tierras bajas desde centro y sur de Colombia hasta sur de Argentina, solapándose con ruficollis en el sur de Colombia y noroeste de Paraguay. (Hellmayr & Conover, 1949:10); (Wetmore, 1964:9).

© GRID-Arendal. Turkey vulture (Cathartes aura falklandica). Islas Malvinas. Febrero 2017. Algunos derechos reservados C. a. falklandica (Sharpe, 1873); residente en la costa del Pacífico desde Ecuador y Perú hasta sur de Chile e Islas Malvinas (Blake, 1977); (Hellmayr & Conover, 1949:10); similar, aunque más pequeño que, C. a. jota, pero con los bordes grisáceos de las remeras más extendido. (Wetmore, 1964:10)
Las especies más parecidas son: el Cathartes burrovianus de México y Centro y Sudamérica (posado muestra puntas de las alas que sobrepasan la punta de la cola). En vuelo, tiene las alas proporcionalmente más largas y los adultos cabeza amarilla-azulada; con el C. melambrotus de Sudamérica, semejante al C. burrovianus en el color de la cabeza, aunque es más grande y robusto, cola más larga y ancha, plumaje negro brillante con vuelo más estable (Clark & Schmitt, 2017:93). El Coragyps atratus también es similar al C. Aura, pero ligeramente más pequeño, cabeza gris oscura-negra, cola y alas mucho más cortas con parches blancos en la base de las remeras primarias; vuelo con aleteo más rápido. (Kirk & Mossman, 2020)
-
Jote cabeza colorada (Cathartes aura)

Histoire naturelle des oiseaux de l’Amérique Septentrionale (Vieillot et al,1807) Vol 1: 25 (Vultur aura); Lámina 2bis Etimológicamente Cathartes deriva del griego kathartes “purificador.” El nombre de la especie, aura, posiblemente derive del latín aurum, “dorado,” tal vez por el color de la cabeza de los especimenes de museos (Clark & Schmitt, 2017:93)
NOMBRES COMUNES: Jote cabeza colorada (Argentina y Chile); Urubú de cabeza roja (Brasil); Guala cabecirroja (Colombia); Zopilote cabecirrojo (Costa Rica); Aura o Aura tiñosa (Cuba, República Dominicana y Puerto Rico); Zope (El Salvador); Cute (Honduras); Zopilote, Aura, Aura cabecirroja, Aura común (México); Zopilote cabecirrojo (Nicaragua); Noneca (Panamá); Cuervo cabeza roja (Paraguay, Uruguay); Gallinazo cabeza roja (Perú); Oripopo (Venezuela). El nombre común recomendado por la Sociedad Española de Ornitología es Aura gallipavo
Otros: Acabirai. Acabiray. Acá-piraí. Águila cabeza pelada. Águila de cabeza pelada. Aura. Buitre.Buitre de cabeza colorada. Choia. Choia acavirái. Choya. Come perros. Congo. Congo cabeza colorada. Congo come perros Cuervo. Cuervo cabeza y cuello rojos. Cuervo cuello rojo. Cuervo de cabeza colorada. Cuervo de cabeza roja. Cuervo de cabeza rosada. Cuervo de las Malvinas. Cuervo de cabeza y cuello colorados. Cuervo grande de cabeza rosada. Cuervo real. Faja paja.Gallinazo de cabeza colorada. Irivú. Irivú-ministro. Jote. Jote cabecirrojo. Jote chico. Jote cabeza colorada. Jote de cabeza roja. Jote menor. Jote menor de cabeza colorada. Jote negro. Kote. Lleku. Maru. Oripopo. Pajá-pajá. Pala-pala. Pavo cabeza roja. Sapiné. Tungo. Urubú-pitá. Viuda. Zamuro cabecirrojo. Zopilote (De la Peña & Salvador, 2016:150); (Chébez, 1996:122)EN OTROS IDIOMAS
NOTA ANTROPOLÓGICA
Según la Dra. Cebolla Badie (2000:85) en su trabajo de investigación “El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación”, Uruvu: Jote de cabeza colorada (Cathartes aura): “Es más poderoso que el de cabeza negra. Se usan sus lágrimas o las de cualquiera de las especies de jote, se dice uruvu rechâîkui, es para prevenir techâ rachy (dolor de vista) en recién nacidos, itu’i ramo’i va’e, se saca con un trapo las lágrimas del uruvu que previamente se ha atrapado en una trampa y se le pasa la bebé en los párpados. Si no se pueden obtener las lágrimas se utiliza la grasa del ave. También sirve para prevenir los futuros dolores de muela en los niños. Y se utilizan uruvu ipoâ penguêi, es decir las garras del uruvu, como amuleto para prevenir las enfermedades en los niños, porque el uruvu nunca tiene enfermedades (Rudy de Jejy)”BREVES APUNTES HISTÓRICOS
- Histoire naturelle de la Caroline, la Floride, & les Isles Bahama. Catesby, Mark, Royal Society (Great Britain). London: Printed at the expence of the author, and sold by W. Innys and R. Manby, at the West End of St. Paul’s, by Mr. Hauksbee, at the Royal Society House, and by the author, at Mr. Bacon’s in Hoxton,MDCCXXXI-MDCCXLIII [i.e. 1729-1747]. Vol 1 (1729-1732): 6 (The turkey Buzzard)
- Ornithologie, ou, Méthode contenant la division des oiseaux en ordres, sections, genres, especes & leurs variété. Brisson, Mathurin-Jacques, Martinet, François Nicolas. Parisiis: Ad Ripam Augustinorum, apud Cl. Joannem-Baptistam Bauche, bibliopolam, ad Insigne S. Genovesae, & S. Joannis in Deserto, 1760. Tomo 1 (1760): 468 (Le vautour du Brésil)
- A general synopsis of birds. Latham John, London: Printed for Benj. White, 1781-1785. Vol 1 (1781): 9 (Vultur aura)
- Histoire naturelle. Buffon, Georges Louis Leclerc, comte de, La Cépède, M. Paris: P. Didot l’ainé et Firmin Didot, an VII-XII, 1799-1804. Vol 39: 244 (ouroua). Lámina 187
- Histoire naturelle des oiseaux de l’Amérique Septentrionale : contenant un grand nombre d’espèces décrites ou figurées pour la première fois Vieillot, L. P. Langlois, Pierre Gabriel, printer, Prêtre, Jean Gabriel, ill. Paris: Chez Desray: 1807. Vol 1 (1807): 25 (Vultur aura); Lámina 2bis
- Systematic natural history. Shaw, George, Griffith, Mrs, engraver. Heath, Charles, engraver. Stephens, James Francis. London, Printed for G. Kearsley, 1800-1826. Vol 7, pt 1-2 (1809): 36 (American vulture)
- A general history of birds. Latham, John . Winchester [England]: Printed by Jacob and Johnson (1821-1828); Vol 1: 12-13
- American ornithology, or the natural history of the birds of the United States. Wilson, Alexander, Bonaparte, Charles Lucien, JJ, Constable, A. (Edinburgh), Hurst, Thomas (Londen). Edinburgh: pr. for Constable; 1831.. Vol 1: 3 (Cathartes aura)
- La galerie des oiseaux. Vieillot, L. P. (Louis Pierre); Paris: Carpentier-Méricourt, 1834. Tomo I: pág. 14
- Illustrations of the American ornithology of Alexander Wilson and Charles Lucian Bonaparte. Edimburgh: Frazer & Co.; 1835. Lámina II (Cathartes aura)
- Avium species novae, quas in itinere annis MDCCCXVII-MDCCCXX per Brasiliam. Spix, Johann Baptist von, Martius, Karl Friedrich Philipp von, Schmidt, Matthias, ill. Monachii: Impensis editores, 1838-1839. Pág. 2 (Cathartes aura)
- American ornithology. Wilson, Alexander, Baird, Spencer Fullerton, Bonaparte, Charles Lucian. Philadelphia: Porter & Coates, [1871]. Vol 1-2 (Atlas-c2)(1871): Lámina 75
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. London,1874-98. Vol 1 (1874): 25 (Œnops aura)
- Biologia Centrali-Americana: zoology, botany and archaeology. Godman, Frederick Du Cane. London: Published for the editors by R. H. Porter, 1879-1915. Aves v.3: 134 (Cathartes aura)