- Contenido restringido para suscriptores. Suscripción gratuita para acceso a la bibliografía completa y sus enlaces. Pinchar en "Ingresar" para crear su perfil de suscriptor
-
Atajacaminos oscuro | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR
Especie rara a través de su rango. Ambas poblaciones son sensibles a la pérdida del hábitat, con la amenaza constante del desarrollo humano sobre el Bosque Atlantico y cuenca del Amazonas, por lo que pueden declinar rápidamente.
Esta especie tiene un rango de distribución extremadamente grande y por lo tanto no se aproxima a los umbrales de Vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). A pesar que la población parece estar disminuyendo, esta declinación no se cree que sea lo suficientemente rápida como para alcanzar los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población no ha sido cuantificada, pero no se cree que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como “preocupación menor”
El tamaño de la población no se ha cuantificado, pero esta especie se describe como “rara y de distribución parcheada” (Stotz et al., 1996:174).Estado de conservación en Argentina
Vulnerable (VU): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
Vulnerable (VU): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
Vulnerable (VU): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Atajacaminos oscuro | Distribución
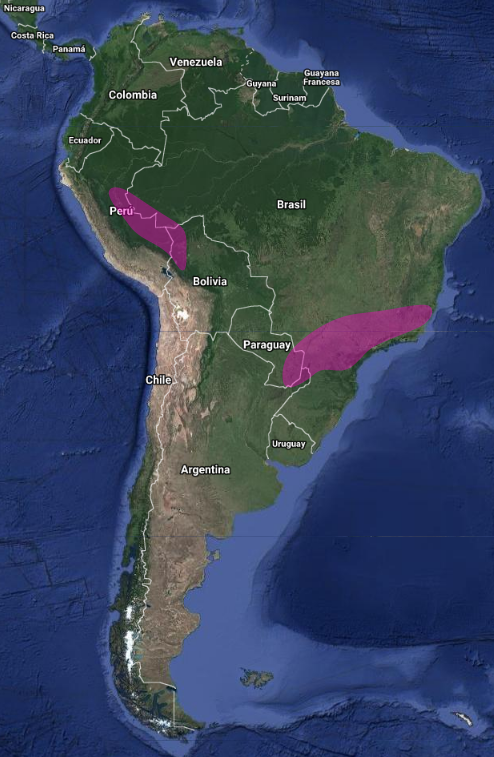
InfoNatura: Animals and Ecosystems of Latin America 2007 Se conocen dos subespecies con poblaciones disjuntas a través de Sudamérica (Stotz et al., 1996:316).
• A. s. mengeli en Amazonia en Perú (Griscom & Greenway, 1941:165; Traylor, 1958:104; Schauensee, 1941:316; Dickerman, 1975:19; Aleixo et al., 2000:139; Schulenberg et al., 2010:204), noroeste de Bolivia (Schulenberg & Remsen, 1982:53; Parker & Bailey, 1991:52; Davis et al., 1994:79; Aleixo et al., 2000:239) y norte de Brasil (Pará) (Griscom & Greenway, 1941:165; Aleixo et al., 2000:138).
• A. s. sericocaudatus restringido a la región de Selva Atlántica en el sureste de Brasil (Scherer-Neto & Costa Straube,1995:35), este de Paraguay en Centro y Alto Paraná (Bertoni, 1919:256; Partridge, 1956:169; Storer, 1989:8; Hayes, 1995:66; Madroño & Esquivel, 1997:171; Madroño et al., 1997:57) y noreste de Argentina.DISTRIBUCIÓN GEOGRÁFICA EN ARGENTINA (de la Peña, 2020:248-249)
Antrostomus sericocaudatus sericocaudatus (Cassin, 1849) en Misiones. (Ver citas, sitios y coordenadas en los enlaces)HÁBITAT
Asociado a interior de bosque maduro, siendo la especie claramente bosque-dependiente (Bodrati & Cockle, 2018:8).
En selva y selva en galería. Desde 0-600 msnm (Stotz et al., 1996:174; de la Peña, 2020:247). -
Atajacaminos oscuro | Comportamiento
Fundamentalmente crepuscular. Se alimenta después de oscurecer, haciendo incursiones rápidas de 2-3 min desde la misma percha que utilizó para cantar (Aleixo, 2000:139).
VOCALIZACIONESObservado cantar sobre ramas (aproximadamente 1, 5 – 5 m), volando bajo sobre el suelo durante el crepúsculo, pero nunca sobre el suelo (Aleixo, 2000:139). El canto del A. s. sericocaudatus se lo describe como “doh-diew-lewt” que emite en secuencias de unos 3 min o más con una breve pausa entre las notas (Cleere, 1998:203).
Robert Straneck (1980 y 1986) ha registrado en audio 2 tipos de vocalizaciones diferentes de audio, y Wilkinson 2020) después de examinar estas vocalizaciones, considera que una de ellas probablemente sea una llamada de comunicación entre el adulto y el nido.
Durante el periodo de reproducción tanto el macho como la hembra vocalizan con el mismo sonido generalmente durante el crepúsculo. En Argentina pueden cantar todo el año (Cleere, 1998:203; Bodrati & Cockle, 2018:5).A menudo la pareja, durante el periodo de reproducción, se comunica mediante “llamadas” o emitiendo una sola nota de tono alto (Wilkinson, 2009:502) antes de dejar el nido. Emite el llamado directamente desde el nido y espera hasta que la pareja responda.
Como la mayoría de la familia Caprimulgidae, cuando es molestado en su nido finge estar herido (Wilkinson, 2009:502).
Se ha registrado una hembra aleteando, mientras volaba bajo sobre el nido durante la incubación, produciendo unos chasquidos sordos (Wilkinson, 2009:502).ALIMENTACIÓNInsectívoros. Escarabajos, grillos, saltamontes y hormigas (Cleere, 1998:203).
REPRODUCCIÓNA. s. mengeli de agosto a diciembre coincidiendo con la 2º mitad de la estación seca y comienzo de la estación lluviosa (Wilkinson, 2009:503).
En Argentina A. s. sericocaudatus de mediados de agosto a mediados de noviembre (de la Peña, 2020:248).
No construyen nido. Depositan 2 huevos blancos directamente sobre el suelo. Parecen tener una alta fidelidad al sitio de nidificación (hasta 10 años) (Wilkinson, 2009:503) (Bodrati & Cockle, 2018:6) (de la Peña, 2015:331) (de la Peña, 2020:248).
La incubación la realizan ambos padres durante 19 días aproximadamente, generalmente la hembra durante el día y el macho por la noche (Bodrati & Cockle, 2018:5).
Las crías son capaces de movilizarse a las 24 hs de nacer, siendo capaces de volar cortas distancias a medida que crecen. Abandonan el nido aproximadamente a los 18 días, pero permanecen cerca del área hasta los 24 días. Cortejo, vocalizaciones, desarrollo de los pichones y fotos, ver Bodrati & Cockle (2018). -
Atajacaminos oscuro | Descripción

© Hector Bottai. Bacurau-rabo-de-seda; Floresta Nacional de Carajás, Pará, Brasil. Julio 2019. Algunos derechos reservados DESCRIPCIÓN (Cleere, 1998:203; de la Peña, 2020:247)
Antrostomus sericocaudatus sericocaudatus
(Cleere, 1998:203);
Ligero dimorfismo sexual.
Macho: Frente, corona y nuca marrones, profusamente salpicado de blanco-grisáceo, ocre y canela, y estriado de de marrón-negruzco.
Collar muy ancho sobre la nuca de color beige claro barrado en marrón. Manto, espalda, rabadilla y supracaudales marrones ligeramente barradas y salpicadas de canela. Cubiertas alares marrones punteadas de beige y canela. Escapulares marrones y beige, profusamente manchadas de marrón-grisáceo, con dos pequeños puntos canela sobre la punta de las plumas.
Primarias externas marrones salpicadas de ocre sobre los vexilos externos, barradas en ocre sobre los vexilos internos. Primarias internas y todas las secundarias marrones barradas de ocre. Terciarias marrones moteadas de grisáceo-blanquecino, beige y canela.
Cola marrón oscura ligeramente barrada de ocre. Timoneras (T5-T3) con puntas blancas, bordeadas de beige, que se vuelven blancas en los vexilos externos; T2 con pequeña punta beige; Par central (T1) densamente barrada y moteada de marrón-grisáceo.
Lores y cubiertas auriculares castaño-rojizas punteadas de marrón oscuro. Barba y garganta marrones barradas de beige. Gran parche beige a través de la parte inferior de la garganta.
Pecho marrón moteado de beige y blanco. Vientre y flancos beige, con barrado abigarrado y muy moteado de blanco.
Subcaudales beige, ligeramente barradas de marrón.
Iris marrón. Vibrisas marrones grisáceas. Pico marrón-negruzco más oscuro en la punta; patas y pies marrones negruzcos.
Hembra: similar al macho, tal vez ligeramente más marrón y paĺida.Antrostomus sericocaudatus mengeli
Sexos similares; al contrario que el A. s. sericocaudatus el macho tiene un prominente collar blanco. El collar de la hembra es todo beige de color pero con algunas de las puntas de las plumas más claras, a veces blancas.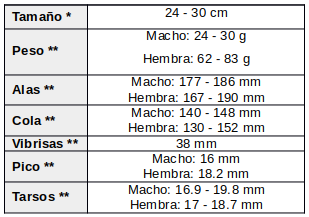
* (de la Peña, 2020:247); ** (Cleere, 1998:204) -
Atajacaminos oscuro | Taxonomía
Subespecies y distribución
- Antrostomus sericocaudatus mengeli (Dickerman, 1975) – Este de Perú, Noroeste de Bolivia y Norte y Centro de Brasil.
- Antrostomus sericocaudatus sericocaudatus (Cassin, 1849) – Sureste de Brasil, Este de Paraguay y extremo Noreste de Argentina.
Nota taxonómica
Han y colaboradores (2010:451-452) basándose en datos genéticos, han replanteado la clasificación de la familia Caprimulgidae, con los que demuestran que el género Caprimulgus es altamente polifilético por lo que han resucitado al género Antrostomus para A. rufus (Atajacaminos Colorado) y A. sericocaudatus (Atajacaminos Oscuro), quedando Caprimulgus limitado a especies del Viejo Mundo. Aceptado por el SACC (South American Classification Committee), Propuesta Nª 466.
Bodrati & Cockle (2018:10) comentan que no existen estudios genéticos centrados específicamnete sobre el A. sericocaudatus y que Sigurdsson & Cracraft (2014:528 y 538), basándose en el examen de un ejemplar de cada subespecie, sitúan al A. s. sericocaudatus próximo al A. s. mengeli, pero hacen notar que la relación con otros Antrostomus sigue sin resolverse. -
Atajacaminos oscuro | Antrostomus sericocaudatus
Oriundo de Sudamérica, con dos subespecies con poblaciones separadas en la cuenca del Amazonas y en el Bosque Atlántico; la mayoría en la selva tropical y bosque subtropical perenne.
NOMBRES COMUNES: Atajacaminos oscuro (Argentina); Chotacabras Cola de Seda (Perú); Atajacaminos ahumado (Paraguay); Bacurau-rabo-de-seda, curiango (Brasil); Otros: Dormilón rojizo de cola listada (de la Peña, 2015:331; de la Peña, 2020:247); En Guaraní: “tové-avá” (Chébez, 1996:134).
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS
- Proceedings of the Academy of Natural Sciences of Philadelphia. October 30th; Descriptions of New Species of Birds of the Family Caprimulgidæ, Specimens of Which Are in the Collection of the Academy of Natural Sciences of Philadelphia. Cassin. Vol 4 (1848): 238-239 (Antrostomus sericeocaudatus)
- Zur Ornithologie Brasiliens: Resultate von Johann Natterers Reisen in den Jahren 1817 bis 1835. Pelzeln, August von, Natterer J. Wien: A. Pichler’s Witwe & Sohn, 1871. pp 13 (Antrostomus sericeocaudatus)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London, 1874-98. Vol 16: 567-568 (Caprimulgus sericeocaudatus)
- Bulletin of the British Ornithologists’ Club (1975) Nº 95: 18-19. New subspecies of Caprimulgus sericocaudatus from the Amazon River Basin. Dickerman, Robert. W. (Caprimulgus sericocaudatus)
-
Atajacaminos colorado | Bibliografía
- Antelo, C. M., Brandán, Z. J., Navarro, C. I., & Marigliano, N. L. (2006). Avifauna de un sector de bosque en Las Tipas (Tucumán, Argentina). Acta Zoológica Lilloana, 50(1-2): 41-46.
- Antelo, C. M. & Brandán Fernández, Z. J. (2013). Las aves no passeriformes de Tucumán, Argentina. Miscelánea 132, Fundación Miguel Lillo, Argentina. (enlace)
- ArgentAvis (s.f.): Ficha especie: Atajacaminos colorado (Antrostomus rufus). Recuperado el 10 noviembre 2022 de http://argentavis.com.ar/2012/sitio/especie_co.php?id=679
- Babarskas, M., J. O. Veiga & F. C. Filiberto (1995). Inventario de Aves del Parque Nacional El Rey, Salta, Argentina. Monografía Especial L. O. L. A. No 6, 44 Págs. Buenos Aires.
- Belcher, C. & G. D. Smooker (1936). Birds of the colony of Trinidad and Tobago. Part III. Ibis 78: 1-35.
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178(4): 369–636. (enlace)
- BirdLife International (2022) Species factsheet: Antrostomus rufus. Downloaded from http://www.birdlife.org on 12/11/2022.
- Bodrati, A., & Areta, J. I. (2010). Dos nuevos dormilones para la avifauna argentina (Chordeiles acutipennis y Caprimulgus maculicaudus) y comentarios sobre hábitat, comportamiento y geonemia en Paraguay. El Hornero, 25(2): 67-73. (enlace)
- Bodrati, A., Cockle, K., Segovia, J. M., Roesler, I., Areta, J. I., & Jordan, E. (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32: 41-64. (enlace)
- Bodrati, A. & S. A. Salvador (2015). Termitas (Isoptera, Blattodea, Insecta) en la dieta de las aves argentinas. Historia Natural. Tercera Serie Volumen 5 (1): 77-89. (enlace)
- Bodrati, A., & Cockle, K. L. (2018). Reproductive biology and distribution of the Silky-tailed Nightjar (Antrostomus sericocaudatus) in Argentina. Ornitología Neotropical, 29: 1-11. (enlace)
- Borges, S. H. (2004). Species poor but distinct: bird assemblages in white sand vegetation in Jaú National Park, Brazilian Amazon. Ibis, 146: 114-124.
- Brandán, Z. J. & Navarro, C. I. (2009). Lista actualizada de las aves de la provincia de Tucumán. Bird Checklist. Publicación especial, Fundación Miguel Lillo, Tucumán, Argentina. (enlace)
- Burgos, F. G., Baldo, J. L. & Cornell, F. M. (2009). Lista de las Aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. SS de Jujuy. (enlace)
- Camperi, A. R. (1990). Notas sobre una colección de aves del Río Santa María, Salta, Argentina. El Hornero, 13: 147-153. (enlace)
- Chatellenaz, M. L. (2005). Aves del Valle del Río Paraná en la provincia del Chaco, Argentina: riqueza, historia natural y conservación. Miscelánea, 14, 528. (enlace)
- Chatellenaz, M. L., P. Cano, C. Saibene & H. A. Ball (2010). Inventario de las aves del Parque Nacional Mburucuyá (provincia de Corrientes, Argentina). Acta Zool. Lilloana 54: 139-160. (enlace)
- Chébez, J. C. (1996). Fauna Misionera. Catálogo Sistemático y Zoogeográfico de los Vertebrados de la Provincia de Misiones (Argentina). Ed. L.O.L.A. (Literature of Latin America) (1º Ed.), Monografía N.º 5. Buenos Aires, Argentina. 320 pp. I.S.B.N. 950-9725-20-X
- Chebez, J. C., N. R. Rey, M. Babarskas & A. G. Di Giacomo (1998). Las aves de los Parques Nacionales de la Argentina. Monografía Especial L.O.L.A. No 12, 126 págs. Bs.As.
- Cintra, R. & C. Yamashita (1990). Habitats, Abundancia e Ocorrência das Espécies de Aves do Pantanal de Poconé, Mato Grosso, Brasil. Pap. Avulsos Zool., 37 (1): 1-21. (enlace)
- Cleere, N. (1998). Nightjars. A guide to the nightjars, nighthawks, and their relatives. Yale University Press, New Haven, Connecticut. (enlace)
- Cobos, V., Miatello, R. & Baldo, J. (1999). Algunas especies de aves nuevas y otras con pocos registros para la provincia de Córdoba. Argentina. II. Nuestras Aves, 39, 7-11. (enlace)
- Coconier, E. G., López Lanús, B., Roesler, I., Moschione, F., Pearman, M., Blendinger, P., Bodrati, A., Monteleone, D., Casañas, H., Pugnali, G. & M. E. Alvarez (2007). Lista comentada de las aves silvestres de la unidad de gestión Acambuco. Pp: 32-103. En Coconier, E. G. (Ed.). Las aves silvestres de Acambuco, Provincia de Salta, Argentina. Temas de Nat. y Cons. No 6. Nuestras Aves A.O.P. (enlace)
- Contreras, J. R. (1987). Lista preliminar de la avifauna de la Provincia de Formosa, República Argentina. Historia Natural, 7(4): 33-52.
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti & E. E. Utges (1990). Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Volume 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1.
- Contreras Roqué, J. R., Agnolin, F., Davies, Y. E., Godoy, I., Giacchino, A. & Ríos, E. E. (2014). Atlas ornitogeográfico de la Provincia de Formosa, República Argentina. (1º Ed.) Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 p. (enlace)
- de la Peña, M. R. (1996). Nuevos registros o aves poco citadas para las provincias de Santa Fe y Entre Ríos, Argentina. El Hornero, 14(3): 87-89. (enlace)
- de la Peña, M. R. (1999). Aves Argentinas. Lista y distribución. Monografía N.º 18; Ed. L.O.L.A. (Literature of Latin America), Buenos Aires, Argentina.
- de la Peña, M. R. (2015). Aves argentinas. Incluye nidos y huevos. (1º Ed.) Ediciones UNL, Santa Fe; EUDEBA, CABA, Argentina; 496 pp.
- de la Peña, M. R. (2020). Aves argentinas. Descripción, Comportamiento, Reproducción y Distribución (ACTUALIZACIÓN). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Año 2020 | N° 6 | Pág. 1-348| ISSN 0325-3856
- Diamond, A. W. (1973). Habitats and feeding stations of St Lucia forest birds. Ibis 115: 313-329.
- Dickinson, E. C. (editor) (2003). The Howard and Moore complete checklist of the birds of the world. Third edition. Princeton University Press, New Jersey. 241 (enlace)
- Di Giacomo, A. G. & B. López Lanús (1998). Aportes sobre la nidificación de veinte especies de aves del noroeste argentino. El Hornero 15: 29-38. (enlace)
- Dubs, B. (1992). Birds of Southwestern Brazil: Catalogue and Guide to the Birds of the Pantanal of Mato Grosso and its Border Areas. Betrona Verlag, Kusnacht, Switzerland. (enlace)
- ffrench, R. P. (1991). A Guide to the Birds of Trinidad and Tobago. 2nd edition. Comstock Publishing Associates, Ithaca, NY, USA. (enlace)
- Fraga, R. M. (2001). The avifauna of Estancia San Juan Poriahú, Iberá Marshes, Argentina: checklist and some natural history notes. Cotinga, 16: 81-86. (enlace)
- Giannini, N. P. (1999). La interacción de aves-murciélagos-plantas en el sistema de frugivoría y dispersión de semillas en San Javier, Tucumán, Argentina. Tesis doctoral, Facultad de Ciencias Naturales e Instituto M. Lillo, Universidad. Nacional de Tucumán, Tucumán, Argentina. (enlace)
- Giraudo, A. R., Bortoluzzi, A. & Arzamendia, V. (2006). Vertebrados tetrápodos de la Reserva y Sitio Ramsar “Esteros del Iberá” (Corrientes, Argentina): Análisis de su composición y nuevos registros para especies amenazadas. Natura Neotropicalis, 37(1-2): 1-20. (enlace)
- Greenway, J. C., Jr. (1958) Extinct and vanishing birds of the world. Special Publication 13. American Committee for International Wild Life Protection, New York, New York, USA.
- Han, K., M. B. Robbins & M. J. Braun (2010). A multi-gene estimate of phylogeny in the nightjars and nighthawks (Caprimulgidae). Molecular Phylogenetics and Evolution 55: 443-453. (enlace)
- Hartert, E. & S. Venturi (1909). Notes sur les oiseaux de la République Argentine. Novit. Zool. 16: 159-267. (enlace)
- Hayes, F. E. (1995). Status, Distribution and Biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, CO, USA. (enlace)
- Hilty, S. L. (2003). Birds of Venezuela. Second edition. Princeton University Press, Princeton, New Jersey.
- Hilty, S. L. & W. L. Brown (1986). A guide to the birds of Colombia. Princeton University Press, Princeton, New Jersey.
- Holyoak, D. T. (2001). Nightjars and their allies: the Caprimulgiformes. Oxford University Press, Oxford, United Kingdom, and New York, New York.
- Kiff, L. F. (1975). Notes on southwestern Costa Rican birds. Condor. 77(1): 101–103. (enlace)
- Krauczuk, E. R. (2005). Aves do Inta-Campo Anexo ao Zaiman, e do Campus da Universidade Nacional de Misiones, Posadas, Misiones, Argentina. Atualidades Ornitológicas, 126: 17-39. (enlace)
- Krauczuk, E. R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Christi, San Ignacio, Misiones, Argentina. Lundiana: International Journal of Biodiversity, 9(1): 29-39. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Ficha Especie: Chotacabra castaña (Antrostomus rufus, Boddaert, 1783); Recuperado el 10 noviembre 2022 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=C6B09772
- López-Lanús, B., Grilli, P., Coconier, E., Di Giacomo, A. & Banchs, R. (2008). Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas/AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina, 64. (enlace)
- Lucero, M. M. (1983). Lista y distribución de aves y mamíferos de la provincia de Tucumán. Miscelánea No 75. Fund. M. Lillo. Tucumán. Págs. 61.
- Manassero, M., H. Luna & L. Acquaviva (2006). Nuevos registros de aves para Santa Fe, Argentina. Parte II. Nuestras Aves 51: 29-31. (enlace)
- Mazar Barnett, J. & M. Pearman (2001). Lista comentada de las aves Argentinas / Annotated checklist of the birds of Argentina. Lynx Edicions, Barcelona.
- Meyer de Schauensee, R. & W. H. Phelps (1978). A Guide to the Birds of Venezuela. Princeton University Press, Princeton, NJ, USA. (enlace)
- Militello, E. & Chébez, J. (2009). Notas sobre Aves del Parque Nacional Iguazú y Zona de Influencia, Misiones, Argentina. Nótulas Faunísticas (segunda serie), 32: 1-5. (enlace)
- Moschione, F. & L. Bishels (2004). Listado de las aves del Parque Provincial Loro Hablador, provincia del Chaco. Informe Técnico. Proyecto Elé/DFS. Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F. N. & Segovia, J. (2005). Listado de las aves de la Reserva Natural Las Lancitas, Santa Bárbara, Jujuy. Informe técnico Proyecto Elé/DFS, Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F., O. Spitznagel & M. González (2012). Lista de Aves de Salta (Birds Checklist). Ministerio de Cultura y Turismo. Salta. (versión octubre 2012) (enlace)
- Múnera-Roldán, C., M. L. Cody, R. H. Schiele-Zavala, B. J. Sigel, S. Woltmann & J. P. Kjeldsen (2007). New and noteworthy records of birds from south-eastern Nicaragua. Bulletin of the British Ornithologists Club 127: 152-161. (enlace)
- Narosky, T. & Chébez, J. C. (2002). Aves de Iguazú: Guía para la identificación. 1º Ed. Vázquez Mazzini Editores; Buenos Aires, Argentina; 128 pp.
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vázquez Mazzini Editores, Buenos Aires, Argentina. 432 pp.
- Navarro, C. I., Brandán, Z. J., Antelo, C. M. & Marigliano, N. L. (2000). Avifauna invernal en una localidad del Bosque Chaqueño Serrano (Las Tipas, Tucumán, Argentina). Acta Zoológica Lilloana, 45(2): 233-240.
- O’Connor, R. S. & G. Ritchison (2013). Notes on the incubation, brooding, and provisioning behavior of Chuck-will’s-widows. Wilson Journal of Ornithology 125:815-819.
- Olrog, C. Ch. (1959). Las Aves Argentinas. Una Guía de Campo. Universidad Nacional de Tucumán. Instituto “Miguel Lillo”. Argentina. 343 pp.
- Olrog, C. Ch. (1984). Las aves argentinas. Una guía de campo. Administración de Parques Nacionales. 352 pp. (enlace)
- Oren, D. C. & T. A. Parker (1997). Avifauna of the Tapajós National Park and vicinity, Amazonian Brazil. In Studies in Neotropical ornithology honoring Ted Parker (J. V. Remsen, Editor). Ornithological Monographs 48: 493–525. (enlace)
- Ortiz, D., Aráoz, R. & Alderete, C. (2011). Lista sistemática de las aves de la Reserva Experimental Horco Molle, provincia de Tucumán, Argentina. Nótulas Faunísticas, Segunda Serie, 62: 1-5. (enlace)
- Ortiz, D. & R. Aráoz (2014). Aves de la Sierra de San Javier. Universidad Nacional de Tucumán.
- Ortiz, D., Pastur, E. M., Juliá, J. & Quiroga, P. (2018). Lista de aves de la Reserva Privada San Pablo, provincia de Tucumán, Argentina. Nótulas Faunísticas (segunda serie), 246: 1-8. (enlace)
- Pagano, L. G. & S. A. Salvador (2017). Datos de pesos de aves Argentinas. Parte 4. Historia Natural 7:21–43. (enlace)
- Peters, J. L. (1940). Check-list of birds of the world. Volume IV. Harvard University Press, Cambridge, Massachusetts. (enlace)
- Planqué, R., Vellinga, W. P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Ficha especie: Antrostomus rufus (Boddaert, 1783); Recuperado el 14 noviembre de 2022 de https://xeno-canto.org/species/Antrostomus-rufus
- Raffaele, H. A., J. Wiley, O. Garrido, A. Keith & J. Raffaele (1998). A Guide to the Birds of the West Indies. Princeton University Press, Princeton, NJ, USA.
- Ridgely, R. S. & J. A. Gwynne (1989). A Guide to the Birds of Panama with Costa Rica, Nicaragua, and Honduras. Second edition. Princeton University Press, Princeton, NJ, USA.
- Ridgway, R. (1914). The birds of North and Middle America. Part VI. Bulletin of the United States National Museum 50, part 6. (enlace)
- Robbins, M. B. & Parker, T. A. (1997). Voice and taxonomy of Caprimulgus (rufus) otiosus (Caprimulgidae), with a reevaluation of Caprimulgus rufus subspecies. Pp. 601–607 in: Remsen, J.V. ed. (1997). Studies in Neotropical Ornithology Honoring Ted Parker. Ornithological Monographs 48. American Ornithologists’ Union, Washington, D.C. (enlace)
- Rohwer, S. A. (1971). Molt and the annual cycle of the Chuck-will’s-widow, Caprimulgus carolinensis. Auk 88: 485-519. (enlace)
- Rumelt, R. (2020). Rufous Nightjar (Antrostomus rufus), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.rufnig1.01
- SAAC. (2010). Proposal (466) to South American Classification Committee. Recuperado en noviembre 2022 de https://www.museum.lsu.edu/~Remsen/SACCprop466.htm
- Salvador, S. A., A. Bodrati & L. A. Salvador (2014). Aportes al conocimiento de la reproducción del Atajacaminos colorado (Antrostomus rufus) en Argentina. Nuestras Aves 59: 54-57. (enlace)
- Salvador, S. A. (2016). Distribución Reproductiva de las Aves de Argentina y sus Territorios. Recopilación Inédita. Edición del Autor, Córdoba. (enlace)
- Salvin, O. & E. Hartert (1892). Catalogue of the birds in the British Museum. Volume 16. British Museum (Natural History), London. (enlace)
- Schulenberg, T. S., D. F. Stotz, D. F. Lane, J. P. O’Neill & T. A. Parker III. (2010). Birds of Peru. Revised and updated edition. Princeton University Press, Princeton, New Jersey.
- Short, L. L. (1975). A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History 154(3):165–352. (enlace)
- Sibley, C. G. & Monroe, B. L. (1990). Distribution and taxonomy of birds of the world. Yale University Press, Connecticut. (enlace)
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brazil.
- Sigurdsson, S. & J. Cracraft (2014). Deciphering the diversity and history of New World nightjars (Aves: Caprimulgidae) using molecular phylogenetics. Zoological Journal of the Linnean Society 170: 506-545. (enlace)
- Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina (s.f.); Ficha especie: Atajacaminos colorado (Antrostonmus rufus); recuperado el 10 noviembre 2022 de https://sib.gob.ar/especies/antrostomus-rufus
- Slud, P. (1964). The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History 128:1–430. (enlace)
- Stiles, F. G. & A. F. Skutch (1989). A Guide to the Birds of Costa Rica. Christopher Helm, London, UK. (enlace)
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker & D. K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA, and London, UK.
- Wetmore, A. (1968). The Birds of the Republic of Panama. Part 2. Columbidae (Pigeons) to Picidae (Woodpeckers). Smithsonian Miscellaneous Collections 150. Smithsonian Institution, Washington, D.C. 605 pp. (enlace)
- Wetmore, A. & Phelps, W. H. (1953). Notes on Rufous Goatsuckers of Venezuela. Proceedings of the Biological Society of Washington, 60:15-20. (enlace)
- Zyskowski, K., M. B. Robbins, A. T. Peterson, K. S. Bostwick, R. P. Clay & L. A. Amarilla (2003). Avifauna of the northern Paraguayan Chaco. Ornitología Neotropical 14: 247-262. (enlace)
-
Atajacaminos colorado | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR
Esta especie tiene un rango de distribución extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). A pesar que la población parece estar disminuyendo, esta declinación no se cree que sea lo suficientemente rápida para alcanzar los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población no ha sido cuantificada, pero no se cree que alcance los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como bastante “común” y de “preocupación menor” (Stotz et al., 1996:174; del Hoyo, 2020:119; BirdLife International, 2022)
Se estima que la población es de 5-50 millones de individuos maduros y que la pequeña disminución de la población es causada por la destrucción del hábitat.ARGENTINA (S.I.B.)
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs (2008:47) Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Atajacaminos colorado | Distribución
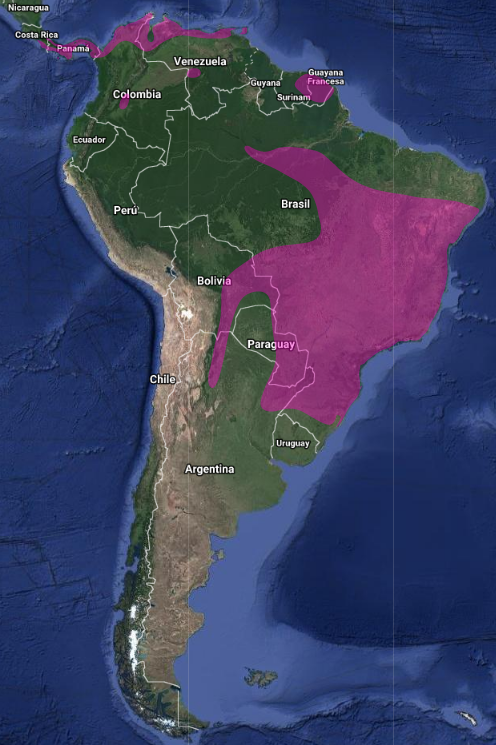
InfoNatura: Animals and Ecosystems of Latin America 2007 Endémico de América. La distribución se extiende desde el sur de América Central (Costa Rica – (Slud, 1964:138; Ridgely & Gwynne, 1989:195; Kiff, 1975:101; Stiles & Skutch, 1989:202) y recientemente registrado en el sureste de Nicaragua (Múnera-Roldán et al., 2007:155), noreste de Santa Lucía en las Antillas Menores (Raffaele et al., 1998:102), Trinidad y Tobago (ffrench, 1991:209) hasta Panamá y desde allí se distribuye en América del Sur tropical extraandina hasta Bolivia, Paraguay, sudeste de Brasil y norte de la Argentina (Stotz et al., 1996:316; de la Peña, 2020:250; de la Peña, 2015:330; Contreras et al., 2014:311)
En Venezuela es residente y bastante común localmente, aunque no se han comprobado movimientos estacionales. Probablemente el A. r. rutilus sea migrante austral durante el invierno desde Argentina y sur de Brasil (Hilty, 2003:376),
En Colombia (de la Peña, 2020:250); En Brasil registrado en centro de Amazonia (Oren & Parker, 1997:504), Belton, (1984: 561) para Rio Grande do Sul, Dubs, (1992:53) lo registra como común en cerrado y áreas cultivadas en los bordes del suroeste de Brasil; de abril a octubre registrado en región de Poconé (Pantanal-Mato Grosso) por Cintra & Yamashita (1990:12). El A. r. rutilus migra desde Mato Grosso y Río de Janeiro a Paraguay y norte de Argentina.
En Paraguay, según Contreras et al (2014:310), la información es insuficiente para establecer con claridad si es residente permanente, o si migra en los meses invernales en toda o en parte de su geonemia. Podría faltar en los meses más fríos. Anidaría localmente. Aunque Hayes (1995:66) lo considera residente, nidificante y poco común en campos cerrados, alto Paraná y Paraguay central y raro en Ñeembucú.
En Perú es raro y local; generalmente en valles secos (300-1650 m) aunque también en sitios húmedos (Schulenberg et al., 2010:204)
En Panamá se distribuye sobre colinas de la pendiente sobre el canal y al este de la provincia de Panamá; sobre la pendiente del Pacífico es menos numeroso aunque sobre la pendiente del Caribe solo se encuentra en el área del canal. Se reproduce entre finales de enero y principios de mayo (Ridgely & Gwynne, 1989:195).
Los movimientos del A. rufus no se conocen bien. Las especies de más al sur (A.r. rutilus), del norte de Argentina y sur de Brasil, migran hacia el norte durante el invierno austral y tal vez alcancen la costa del Caribe. También se sospecha que el A. r. saltarius, del noroeste de Argentina, puede ser migratorio. Las otras especies se considera que son sedentarias (ffrench, 1991:209).DISTRIBUCIÓN EN ARGENTINA (Contreras et al., 2014:311; de la Peña, 2020:250; de la Peña, 2015:330; Bodrati & Areta, 2010:68)
Según comentan Contreras et al. (2014:310), en Argentina es una especie que está mucho más extensamente distribuida en las zonas húmedas del este y apenas si llega, en forma muy dispersa y puntual a áreas chaqueñas secas, contando con algunos registros en el Chaco Boreal paraguayo y otros en el este de la Provincia de Chaco (Contreras et al., 1990:129) y en el norte de la de Santa Fe (Hartet & Venturi, 1909:224). Según Short (1975:236) la especie faltaría en la zona más seca del área chaqueña argentina.
Antrostomus rufus rutilus (Burmeister, 1856)
Según Short (1975: 236) la subespecie A. r. rutilus está bastante débilmente definida, con presencia en las Provincias de Misiones, norte de Corrientes, Chaco, Formosa, Tucumán, Jujuy, el noreste de Santa Fe, y noreste de Córdoba (de la Peña, 2020:250).
Antrostomus rufus saltarius (Olrog, 1979:135)
En Argentina: Jujuy, Salta, Tucumán, Santiago del Estero y Catamarca (Olrog, 1979:135; de la Peña, 2020:250; de la Peña, 2015:330; Salvador, 2016:98).HÁBITAT
A través de su amplio rango de distribución ocupa una gran variedad de bosques primarios como de segundo crecimiento (Meyer de Schauensee, 1978:123), desde hábitats secos en la región del Alto Chaco (Zyskowski et al., 2003:651) a húmedos en la cuenca del Amazonas (Borges 2004); también de distribuye a través de amplio gradiente de vegetación, desde bosques abiertos en la región del Chaco a bosques de matorrales densos en Costa Rica en la mitad sur de la vertiente del Pacífico (Kiff, 1975:101). En Santa Lucía la subespecie otiosus se encuentra predominantemente en zona de matorrales de tierras bajas secas (Robbins & Parker, 1997:603). También ha sido registrado en hábitats alterados por el hombre, como jardines suburbanos. Desde el nivel del mar hasta los 1.800 msnm (Cleere, 1998:198; de la Peña, 2020:249; de la Peña, 2015:330; Narosky e Yzurieta, 2010:192; Stotz et al., 1996:174).
Ecorregiones: Chaco húmedo; Chaco seco; Esteros del Iberá; Selva de Yungas; Selva Paranaense (Mazar Barnett & Pearman, 2001:48)