- Accordi, I. A. (2002). New records of the sickle-winged nightjar, Eleothreptus anomalus (Caprimulgidae), for a Rio Grande do Sul, Brazil wetland. Ararajuba 10: 227-230. (enlace)
- Accordi, I A. (2008). Ecología y conservación de aves en ambientes costeros de Rio Grande do Sul. Tesis doctoral, Univ. Federal de Rio Grande do Sul, Porto Alegre, Rio Grande do Sul, Brasil.
- ArgentAvis (s.f.): Ficha especie: Atajacaminos ala negra (Eleothreptus anomalus); recuperado el 21/11/2022 de http://argentavis.com.ar/2012/sitio/especie_co.php?id=687
- Athor, J. (Ed.). (2009). Parque Costero del Sur: Magdalena y Punta Indio, provincia de Buenos Aires: naturaleza, conservación y patrimonio cultural. (1º Ed.). Fundación de Historia Natural “Félix de Azara”, Buenos Aires; 528 pp. ISBN 978-987-25346-3-9 (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178 (4): 369–636. (enlace)
- BirdLife International (2021). Eleothreptus anomalus. The IUCN Red List of Threatened Species 2021: e.T22690056A196567064. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T22690056A196567064.en
- BirdLife International (2022). Species factsheet: Eleothreptus anomalus. Downloaded from http://www.birdlife.org on 21/11/2022.
- Bodrati, A. (2007). Barra Concepción. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 310-311. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Bodrati, A. & J. I. Areta (2010). Dos nuevos dormilones para la avifauna argentina (Chordeiles acutipennis y Caprimulgus maculicaudus) y comentarios sobre hábitat, comportamiento y geonemia en Paraguay. El Hornero 25 (2): 67-73 (enlace)
- Bodrati, A., Fariña, N., Villalba, O., Pagano, L. & Cockle, K. L. (2019). Notas sobre la biología reproductiva y el ciclo anual del atajacaminos ala negra (Eleothreptus anomalus) en Argentina. Ornitologia Neotropical 30: 157-162. (enlace)
- Bornschein, M. R., Reinert, B. L. & Bócon, R. (1996). A new record of the Sickle-winged Nightjar Eleothreptus anomalus for southern Brazil. Bull. Brit. Orn. Club. 116 (2): 125-126. (enlace)
- Chatellenaz, M. L. (2005). Aves del Valle del Río Paraná en la provincia del Chaco, Argentina: riqueza, historia natural y conservación. Miscelánea, 14: 528. (enlace)
- Chatellenaz, M. L., Cano, P. D., Saibene, C. & Ball, H. A. (2010). Inventario de las aves del Parque Nacional Mburucuyá (Provincia de Corrientes, Argentina). Acta zoológica lilloana: 139-160. (enlace)
- Chebez, J. C. (1993). Listado de los vertebrados argentinos en peligro de extinción. Compilación. Nuestras Aves. 28 (Suppl.1): 1-4.
- Chebez, J. C. (1994). Los Que se Van. Especies Argentinas en Peligro. Albatros, Buenos Aires.
- Chebez, J. C. (1996). Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5. (1º Ed.) Editorial L. O. L. A. (Literature of Latin America), Bs.Aires. ISBN 950-9725-20-X; 320 pp.
- Chebez, J. C. & N. S. Morandeira (2007).Parque Nacional El Palmar. En Di Giacomo, A. S., M. V. De Francesco & E. G. Coconier (editores). Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 168-170. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Chebez, J. C. (2009). Otros que se van. (1a Ed.) Albatros. Buenos Aires.
- Cleere, N. (1998). Nightjars: a guide to the nightjars, nighthawks, and their relatives. Yale University Press, New Haven, Connecticut. (enlace)
- Cleere, N. (2002). A review of the taxonomy and systematics of the Sickle-winged and White-winged Nightjars (Caprimulgidae). Bulletin British Ornithologists Club, 122 (3): 168-179. (enlace)
- Collar, N. J. & P. Andrew (1988). Birds to Watch: the ICBP World Checklist of Threatened Birds. ICBP Technical Publication 8. International Council for Bird Preservation, Cambridge, UK. (enlace)
- Collar, N. J., L. P. Gonzaga, N. Krabbe, A. Modroño Nieto, L. G. Naranjo, T. A. Parker III & D. D. Wedge (1992). Threatened Birds of the Americas. The ICBP/IUCN Red Data Book. Third Edition, Part 2. Int. Council Bird Preserv., Cambridge, U. K., pp. 1-1150. (enlace)
- Contreras, J. R. (1987). Lista preliminar de la avifauna de la provincia de Formosa, República Argentina. Historia Natural VII (4): 33-52.
- Contreras, J. R., L. M. Berry, A. O. Contreras, C. C. Bertonatti & E. E. Utges (1990). Atlas Ornito-geográfico de la Provincia del Chaco – República Argentina. Volume 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1.
- Contreras, J. R., F. Agnolin, Y. E. Davies, I. Godoy, A. Giacchino & E. Ríos (2014). Atlas ornito-geográfico de la provincia de Formosa, República Argentina. (1º Ed.) Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 p. (enlace)
- Cuello, J. P. & E. Gerzenstein (1962). Las Aves de Uruguay. Com. Zool. Mus. Hist. Nat. Montevideo, 4 (93):1-191.
- Cuello, J. P. (1985). Lista de Referencia y Bibliografía de las Aves Uruguyas. Ser. Divulg., No 1, Museo Dámso Larrañaga, Montevideo, pp. 1-116. (enlace)
- Darrieu, C. A. & M. M. Martínez (1984). Estudios sobre la avifauna de Corrientes. I. Nuevos registros de aves (no Passerines). Rev. Mus. La Plata (n.s.) Tomo XIII. Zool. 145: 257-260.
- de la Peña, M. R. (1999). Aves Argentinas. Lista y Distribución. Monografía N.º 18. Ed. L.O.L.A. (Literature of Latin America). Buenos Aires; 244 pp. ISSN 0328-1620
- de la Peña, M. R. (2006). Lista y Distribución de las Aves de Santa Fe y Entre Ríos. Monografía N.º 15. (1º Ed.). Ed. L.O.L.A. (Literature of Latin America). Buenos Aires, Argentina; 137 pp ISSN 0328-1620
- de la Peña, M. R. (2011). Atlas ornitogeográfico de la Provincia de Santa Fe, Argentina. Ediciones Biológica. Serie Naturaleza, Conservación y Sociedad, No 4; 500 pp.
- de la Peña, M. R. (2015). Aves Argentinas. Incluye nidos y huevos. (1º Ed.) Santa Fe: Ediciones UNL; CABA: EUDEBA; Vol 1; 496 pp. ISBN 978-987-657-986-5
- de la Peña, M. R. (2020). Aves Argentinas. Descripción, Comportamiento, Reproducción y Distribución. (Actualización). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Año 2020. N° 6: 1-348. Buenos Aires, Argentina. ISSN 0325-3856
- Dickinson, E. C. (editor) (2003). The Howard and Moore complete checklist of the birds of the world. Third edition. Princeton University Press, New Jersey. (enlace)
- Di Giacomo, A. G. (2005). Aves de la Reserva El Bagual. En Di Giacomo, A. G. y S. F. Krapovickas (Eds.). Historia natural y paisaje de la Reserva El Bagual, provincia de Formosa, Argentina. Inventario de la fauna de vertebrados y de la flora vascular de un área del Chaco Húmedo. Temas de Naturaleza y Conservación 4: 201-465. Aves Argentinas/AOP. Buenos Aires. (enlace)
- Di Giacomo, A. S. (2007). Estero Valenzuela. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 148-149. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Di Giacomo, A. G. & F. Moschione (2007). Valle Fluvial del Río Paraguay-Paraná. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 91-92. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Di Giacomo, A. S. (2007). Ñandubaysal-El Potrero. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 172-173. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Di Giacomo A. G., Gorleri, F. & F. Moschione (2007). Valle Fluvial del Río Paraguay. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 187-188 Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Di Giacomo, A. G. (2007). Reserva El Bagual. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 188-189. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Di Giacomo, A. G. (2007). Parque Nacional Río Pilcomayo. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 200-201. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Di Giacomo, A. G., A. S. Di Giacomo & A. Pautasso (2007). Dorso occidental subhúmedo de Santa Fe. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 436-437. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Durnford, H (1877). Notes on the birds of the province of Buenos Aires. Ibis, 1877: 166-203 (enlace)
- Fariña, N., Cardinale, L. & Villalba, O. E. (2014). Un caso de depredación sobre Atajacaminos Ala Negra (Eleothreptus anomalus) en Corrientes, Argentina. Nuestras Aves, 59: 45–46. (enlace)
- Fandiño, B. & A. R. Giraudo (2010). Revisión del inventario de aves de la provincia de Santa Fe, Argentina. Revista FABICIB, Vol 14: 116 a 137. (enlace)
- Fariña, N., Villalba, O., Pagano, L., Bodrati, A. & Cockle, K. L. (2018). Vocalizaciones, sonidos mecánicos y despliegues del Atajacaminos Ala Negra (Eleothreptus anomalus) en Argentina. Orn. Neotropical, 29: 117–127. (enlace)
- Fontana, L. J. (1881). El gran chaco. Ostwald y Martínez. (enlace)
- Fraga, R. M. (2001). The avifauna of Estancia San Juan Poriahú, Iberá marshes, Argentin : check-list and some natural history notes. Cotinga, 16: 81-86 (enlace)
- Fraga, R. (2007). Estancia San Juan Poriahú. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 146-147. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Fraga, R. (2007). Felipe Yofre. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 161-162. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Giai, A. G. (1950). Notas de viajes. El Hornero 009 (02): 121-164 (enlace)
- Gil, G. & D. Ciarmiello (2007). Parque Nacional Iguazú y alrededores. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 278-280. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Giraudo, A, R., S. A. Di Giacomo, M. A. Ordano, E. Krauczuk, M. L. Chatellenaz & C. Saibene (2003). Aves amenazadas de los esteros Iberá: un refugio que se desvanece. Pp. 273-301. En B. B. Alvarez (ed.). Fauna del Iberá. EUDENE. Talleres Gráficos Volpe/Fox, Buenos Aires. (enlace)
- Giraudo, A., M. Ordano & A. S. Di Giacomo (2007). Estancia Puerto Valle. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 145-146. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Gómez, D. A., A. Bosso, S. Heinonen, A. Giraudo, M. Babarskas, J. L. Baldo & G. Marino (1992). La Naturaleza de las Estancias Santa María y Santa Teresa, Mburucuyá, Provincia de Corrientes. Proyecto Parque Mburucuyá. Administración de Parques Nacionales, Informe Inédito, Buenos Aires, s/ foliar (Inédito).
- Gore, M. E. J. & A. R. M. Gepp (1978). Las Aves del Uruguay. Mosca Hnos., Montevideo; 283 pp.
- Guest K., Sarvary J., & Smith P. (2020). Miscellaneous ornithological observations from the Cerrado de Laguna Blanca IBA, San Pedro department, Paraguay, with behavioural notes on Eleothreptus nightjars. Bol. Mus. Nac. Hist. Nat. Parag. 24 (2): 75-83. (enlace)
- Han, K. L., M. B. Robbins & M. J. Braun (2010). A multi-gene estimate of phylogeny in the nightjars and nighthawks (Caprimulgidae). Molecular Phylogenetics and Evolution 55: 443–453. (enlace)
- Hartet, E. & S. Venturi (1909). Notes sur les Oiseux de la République Argentine. Novit. Zool., 16: 159-267. (enlace)
- Hayes, F. E. (1995). Status, Distribution and Biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, CO, USA. (enlace)
- Holmberg, E. L. (1939). Las aves argentinas. Reedición del capítulo Aves de la Fauna argentina publicado en el “Segundo censo de la República Argentina” (1895). Hornero 007 (02): 142-233 (enlace)
- Isacch, J. P., C. F. Pérez & O. O. Iribarne (2006). Bird species composition and diversity at middle argentinean coast of la Plata River. Ornitología Neotropical, 17: 419-432. (enlace)
- IUCN (2021). The IUCN Red List of Threatened Species. Version 2021-3. Available at: www.iucnredlist.org. (Accessed: 09 December 2021).
- Kirwan, G. M.; Martuscelli, P.; Silveira, L. F.; Williams, R. S. R. (1999). Recent records of the Sickle-winged Nightjar Eleopthreptus anomalus. Bulletin of the British Ornithologists’ Club, 119: 202-206. (enlace)
- Krauczuk, E. & A. S. Di Giacomo (2007). Reserva Natural Rincón de Santa María. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 147-148. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Larsen, C., M. Speed, N. Harvey & H. A. Noyes (2007). A molecular phylogeny of the nightjars (Aves: Caprimulgidae) suggests extensive conservation of primitive morphological traits across multiple lineages. Molecular Phylogenetics and Evolution, 42: 789-796. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Ficha Especie: Chotacabras pantanero (Eleothreptus anomalus). Recuperado el 26/11/2022 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=3B0F1017D0528526
- López Lanús, B. (1997). Inventario de Aves del Parque Nacional “Río Pilcomayo” Formosa, Argentina. Monografía Especial Nº 4. Ed. L.O.L.A. (Literature of Latin America). Buenos Aires, Argentina. ISSN 0328-1620
- López Lanús, B., Unterkofler, D., Ornstein, U., del Sastre, V., Moller Jensen, R., & Herrera, P. (2013). Diversidad y estado de conservación de las aves de los bajos submeridionales (AICA SF03). In: G. D. Marino, F. Miñarro, M. E. Zaccagnini & B. López Lanús (ed.), Pastizales y sabanas del Cono Sur de Sudamérica: Iniciativas para su conservación en la Argentina, pp. 375-417. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina, e Instituto Nacional de Tecnología Agropecuaria, Buenos Aires, Argentina. (enlace)
- Lowen, J. C., L. Bartrina, R. P. Clay & J. A. Tobias (1996). Biological Surveys and Conservation Priorities in Eastern Paraguay: the Final Reports of Projects Canopy ’92 and Yacutinga ’95. CSB Conservation Publications, Cambridge, UK. (enlace)
- Lowen, J. C., R. P. Clay, J. Mazar, A. Madroño, M. Pearman, B. López, J. A. Tobias, D. C. Liley, T. M. Brooks, E. Z. Esquivel & J. M. Reid (1997). New and noteworthy observations on the Paraguayan avifauna. Bulletin of the British Ornithologists’ Club, 117 (4): 275–293. (enlace)
- Lynch Arribálzaga, E. (1920). Las aves del Chaco. El Hornero 002 (02): 085-098. (enlace)
- Manassero, M. & H. Luna (2007). Parque Nacional Pre-Delta. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 175-176. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Marino, G. D., Miñarro, F., Zaccagnini, M. E., & López Lanús, B. (2013). Pastizales y sabanas del Cono Sur de Sudamérica: Iniciativas para su conservación en la Argentina. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina, e Instituto Nacional de Tecnología Agropecuaria, Buenos Aires, Argentina. (enlace)
- Mazar Barnett, J. & M. Pearman (2001). Lista comentada de las aves Argentinas / Annotated checklist of the birds of Argentina. Lynx Edicions, Barcelona.
- Miatello, R., V. Cobos & C. Rosacher (1991) 1994. (Reimpresión). Algunas especies de aves nuevas o poco conocidas para la provincia de Córdoba, República Argentina. Nótulas Faunísticas 69: 1-5.
- Moschione, F. & A. G. Di Giacomo (2007). Estero Tapenagá. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 96. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Moschione, F. (2007). Fortín Sargento Primero Leyes. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 191-192. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Moschione, F. (2007). Nacientes de los riachos Monte Lindo y Tatú Piré. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 192-193. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Moschione, F., Banchs R. & H. Povedano (2007). Bañado La Estrella Este. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad:195-197. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Moschione, F. & R. Banchs (2007). Riacho He He. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 201-202. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires (enlace)
- Moschione, F. (2007). Yuto y Vinalito. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 237-238. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Moschione, F., O. Spitznagel & M. González (2013). Lista de aves de Salta. Ministerio de Cultura y Turismo. Salta. (versión octubre 2012). (enlace)
- Narosky, T. & A. G. Di Giacomo (1993). Las Aves de la Provincia de Buenos Aires: Distribución y Estatus. Asociación Ornitológica del Plata, Vázquez Mazzini Editores & Literature of Latin America, Buenos Aires, Argentina.
- Narosky, T. & D. Yzurieta (2010). Birds of Argentina and Uruguay: a field guide. Vazquez Mazzini Editores, Buenos Aires, Argentina. 432 pp. ISBN 978-987-9132-27-2
- Nores, M. & D. Yzurieta (1981). Nuevas localidades para aves Argentinas. Historia Natural 2 (5): 33-42.
- Nores, M., D. Yzurieta & S. A. Salvador (1991). Lista y distribución de las aves de Santiago del Estero, Argentina. Bol. Acad. Nac. Cs.Córdoba, 59: 157-196. (enlace)
- Olrog, C. Ch. (1979). Nueva Lista de la Avifauna Argentina. Ópera Lilloana 27. Fundación Miguel Lillo. Ministerio de Cultura y Educación. ISSN 0078-5245
- Pacheco, J. F. & F. Olmos (2010). As Aves do Tocantins, Brasil -2: Jalapão. Revista Brasileira de Ornitologia, 18 (1): 1–18. (enlace)
- Pagano, L. G. & E. Mérida (2009). Aves del Parque costero del Sur. Pp. 200-244 en: Athor J (ed) Parque Costero del Sur. Naturaleza, conservación y patrimonio cultural. Fundación Félix de Azara, Buenos Aires, Argentina. (enlace)
- Parker, T. A., III, D. F. Stotz & J. W. Fitzpatrick (1996). Ecological and distributional databases. Pages 113-436 in D.F. Stotz, J.W. Fitzpatrick, T.A. Parker III, and D.K. Moskovits, Neotropical birds: ecology and conservation. University of Chicago Press, Chicago, Illinois. ISBN 0-226-77630-1
- Pearman, M. & E. I. Abadie (1995). Field identification, ecology and status of the Sickle-winged Nightjar Eleothreptes anomalus. Cotinga, 3: 12-14. (enlace)
- Pelzen, a von (1965). Vögel, en Reise der östereischen Fregate “Novara” um die Erde in den Jahren 1857, 1858, 1859, unter den Befehlen des Comodore B. Von Wüllestorf-Urbair. Zool. Teil. 1 (2): 1-177. Wien.
- Pereyra, J. A. (1938). Aves de la zona ribereña nordeste de la provincia de Buenos Aires. Memorias del Jardín Zoológico. La Plata. Tomo 9, parte 2: 1-304
- Pereyra, J. A. (1939). Miscelánea ornitológica. El Hornero, 007 (02): 234-243 (enlace)
- Pereyra, J. A. (1950). Avifauna argentina (contribución a la ornitología). El Hornero, 9 (2): 178–241. (enlace)
- Peters, J. L. (1940). Check-list of birds of the world. Volume IV. Harvard University Press, Cambridge, Massachusetts. (enlace)
- Pinto, O. M de O. (1938). Novo catálogo das aves do brasil; 1ª Parte aves não Passeriformes e Passeriformes não Oscines, com exclusão da família Tyrannidae. Sao Paulo, Brasil. (enlace)
- Planqué, R., Vellinga, W. P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Ficha especie: Chotacabras pantanero (Eleothreptus anomalus); Recuperado el 21/11/2022 de https://xeno-canto.org/species/Eleothreptus-anomalus
- Saibene, C. A., Castelino, M. A., Rey, N. R., Herrera, J. & Calo, J. (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina. (1º Ed.). Monografía Nº 9; Editorial L.O.L.A. (Literature of Latin America). Buenos Aires, Argentina. 70 pp. ISSN 0328-1620
- Saibene, C. (2007). Parque Nacional Mburucuyá. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 152-153. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Salvador, S. A., Salvador, L. A. & Ferrari, C. (2017). Aves de la Provincia de Córdoba. Distribución e Historia Natural. Buenos Aires, Argentina. 302 pp.
- Sclater, P. L. & W. H. Hudson (1889). Argentine ornithology. A descriptive catalogue of the birds of the Argentine Republic. Vol 2. R.H. Porter, London. (enlace)
- Short, L. L. (1975). A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History, 154 (3): 165–352. (enlace)
- Sistema de Información de Biodiversidad (S.I.B.). Administración de Parques Nacionales. Recuperado el 21/11/2022 de https://sib.gob.ar/especies/eleothreptus-anomalus
- Sick, H. (1997). Ornitologia Brasileira. Editora Nova Fronteira, Rio de Janeiro, Brasil. 912 pp. ISBN 85-209-0816-0
- Sigurdsson, S. & J. Cracraft (2014). Deciphering the diversity and history of New World nightjars (Aves: Caprimulgidae) using molecular phylogenetics. Zoological Journal of the Linnean Society, 170: 506-545. (enlace)
- Smith, P. (2013). “Weird Wings”: the enigmatic Eleothreptus nightjars of Paraguay. Neotropical Birding, 13: 43-46. (enlace)
- Stotz, D. F., J. W. Fitzpatrick, T. A. Parker & D. K. Moskovits (1996). Neotropical Birds: Ecology and Conservation. University of Chicago Press, Chicago, IL, USA, and London, UK; 478 pp. ISBN 0-226-77630-1
- Straneck, R. J. & M. J. Viñas (1994). Comentarios sobre costumbres y manifestaciones acusticas del atajacaminos de los pantanos, Eleothreptus anomalus (Gould 1838) (Aves, Caprimulgidae). Nótulas Faunísticas, 67: 1-4.
- Straube, F. C. (1990). Notas sobre a distribuição de Eleothreptus anomalus (Gould 1837) e Caprimulgus longirostris longirostris (Bonaparte 1825) no Brazil (Aves: Caprimulgidae). Acta. Biol. Leopoldensia 12(2): 301-312.
- Torres, R. & P. Michelutti (2007). Reserva de Uso Múltiple Bañados del Río Dulce y Laguna Mar Chiquita. En Di Giacomo, A. S., M. V. De Francesco y E. G. Coconier (editores). 2007. Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad: 134-137. Temas de Naturaleza y Conservación 5. Edición Revisada y Corregida. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Young, N. (2020). Sickle-winged Nightjar (Eleothreptus anomalus), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.siwnig1.01
-
-
Atajacaminos de ala negra | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: VULNERABLE
Nos remitimos al informe de BirdLife Internacional de 2021: El Atajacaminos de Ala Negra (Eleothreptus anomalus) recientemente ha sido evaluada por The IUCN Red List of Threatened Species en 2021. El Eleothreptus anomalus is considerado como Vulnerable bajo el criterio A3c+4c.
Se sospecha que esta especie está disminuyendo rápidamente debido a la pérdida y degradación del hábitat, en gran parte debido a la conversión a la agricultura y las plantaciones de árboles. Por lo tanto, se clasifica como Vulnerable.
Información de rango geográfico
Eleothreptus anomalus ha sido registrado en algunos sitios fragmentados en el este de Paraguay (Hayes, 1995, Lowen et al., 1996, Capper et al., 2001), norte de Argentina y centro y sureste de Brasil (Bornschein et al. 1996, Kirwan et al. 1999). En Paraguay, la única área de reproducción confiable conocida se encuentra en la Isla Yacyretá en el río Paraná (Smith, 2013). En 2010 se reportó el registro de un individuo en Tocantins, Brasil (Pacheco & Olmos, 2010), pero no ha habido más registros que confirmen la presencia de la especie en el estado. En Argentina, el bastión restante de la especie está en Corrientes, aunque solo se encuentra regularmente en unos pocos sitios (eBird 2021, A. Bodrati, N. Fariña & K. Cockle in litt. 2021). Hay pocas localidades confirmadas en Misiones, y queda poco hábitat de pastizales bien conservados en la provincia (A. Bodrati, N. Fariña & K. Cockle in litt. 2021).
La especie anteriormente tenía un rango mucho más grande. Es casi seguro que ha sido extirpado de Buenos Aires, y casi todo el hábitat de Entre Ríos ha sido destruido, aunque puede persistir un pequeño número de individuos (A. Bodrati, N. Fariña & K. Cockle in litt. 2021). En Santiago del Estero y norte de Córdoba existe una pequeña área de hábitat remanente donde podría persistir una población, pero no existen registros recientes (A. Bodrati, N. Fariña & K. Cockle in litt. 2021). Aves solitarias registradas en Santiago del Estero (M. Rumboll in litt. 1986), Parque Nacional El Palmar, Entre Ríos, en 1985 (M. Nores & D. Yzurieta in litt. 1986), y Colón, Entre Ríos en 1979 (M. Nores y D. Yzurieta in litt.1986), y en la década de 1990, se realizaron cuatro registros en tres sitios en el estado de Sao Paulo, Brasil (Kirwan et al., 1999). A pesar de los estudios ornitológicos (López Lanús et al., 2013), no ha habido registros recientes de estas áreas, por lo que ahora se presume que la especie está localmente extinta.Información de población
Según Pearman & Abadie, (1995:13) escaso y localizado. Aunque la mayoría de los registros son de un solo individuo, Accordi (2002:227) registró 6 individuos en un humedal en Río Grande do Sul, la especie es observada a diario en Reserva Natural Rincón de Santa María, en Corrientes (Fariña et al., 2018:118; Bodrati et al., 2019:158), y se tienen referencias de poblaciones en Campo San Juan, Misiones y posiblemente en la Reserva Natural Provincial Iberá en Corrientes (A. Bodrati, N. Fariña & K. Cockle in litt. 2021). Sin embargo, esta especie aparentemente escasa pueden ser el resultado, al menos parcialmente, del el hecho de ser especies crípticas y nocturnas lo que a menudo dificulta su estudio. Los estudios desde 1999-2006 en la llanura costera de Rio Grande do Sul estimaban una población de 12 parejas reproductoras en Capao Novo (218 ha), y 20 parejas reproductoras en Banhado dos Pachecos (2.544 ha) (Accordi, 2008).
Sobre la base de las estimaciones de densidad mínima y del primer cuartil de otras especies de de atajacaminos (0.3 y 0.9 individuos/km2, respectivamente), el área de extensión asignado, y asumiendo un 3% de ocupación, el tamaño de la población se estima en un rango de 5.000 – 52.000 individuos. Sin embargo, dado el pequeño número de registros, se sospecha que el tamaño verdadero de la población es menor (K. Cockle in litt. 2020), así que estaría entre 2.500 – 52.000 individuos.
Se desconoce la estructura de las subpoblaciones, pero basado en el rango de distribución discontinuo, se asume que existen al menos 3 subpoblaciones.Justificación de la tendencia
El área de distribución de la especie parece haberse reducido considerablemente en las últimas décadas, por lo que se infiere que el tamaño de la población de la especie está disminuyendo. Se sospecha que la especie ha perdido alrededor de la mitad de su área de distribución en Argentina durante 25 años desde la década de 1990 (A. Bodrati, N. Fariña & K. Cockle in litt. 2021). Es casi seguro que está extinguido en Buenos Aires, y la mayoría del hábitat de Entre Ríos ha sido destruido (A. Bodrati, N. Fariña & K. Cockle in litt. 2021). La especie fue registrada en Santiago del Estero (M. Rumboll in litt. 1986), Parque Nacional El Palmar, Entre Ríos, en 1985 (M. Nores e D. Yzurieta in litt. 1986), y Colón, Entre Ríos en 1979 ( M. Nores e D. Yzurieta in litt.1986). En la década de 1990, se realizaron cuatro registros en tres sitios del estado de Sao Paulo, Brasil (Kirwan et al. 1999). En ausencia de registros recientes, ahora se presume que la especie está localmente extinta en todas estas regiones. Se sabía que la especie se encontraba en Puerta Boca, Entre Ríos, hasta alrededor del año 2000, pero desde entonces el hábitat de los humedales ha sido destruido (A. Bodrati, N. Fariña y K. Cockle in litt. 2021).
Basándose en la reducción del área registrada de la actual distribución , se estima que la especie ha perdido aproximadamente el 60 % de su área de distribución desde la década de 1980. Suponiendo una tasa constante de pérdida de hábitat, se sospecha que la especie ha sufrido una reducción del 10 al 19 % durante la última década. Suponiendo que se siga perdiendo la misma área de distribución cada año, hasta el 46 % del área de distribución restante de la especie puede perderse en los próximos diez años, por lo que se sospecha una reducción de la población equivalente
Tendencia actual de la población: DecrecienteInformación sobre hábitat y ecología
La ecología de la especie es poco conocida y se ha registrado en una amplia gama de hábitats, incluidos bosques de galería, montes ( bosques tipo chaco) y bosques de transición (Pearman y Abadie 1995), sabanas y pastizales, pantanos, pantanos, campo cerrado , bordes de lagunas con matorral espinoso, y a lo largo de arroyos, estanques y palmerales inundados (Straneck y Viñas 1994, Cleere y Nurney 1998, Kirwan et al. 1999, Accordi 2002). Anteriormente se pensaba que estaba más fuertemente asociado con hábitats boscosos (Pearman y Abadie 1995), pero las observaciones en sitios clave de reproducción en Argentina y Paraguay sugieren que es un especialista en pastizales y puede estar asociado con pastizales inundados en partes de su distribución (Fariña et al. , 2018, Bodrati et al. 2019). Se ha sugerido que puede ser un migrante en la parte sur de su área de distribución, con individuos que se reproducen en Argentina y migran al norte en invierno (Pearman y Abadie 1995), pero al menos algunos individuos residen todo el año en Corrientes (Argentina; Bodrati et al. 2019), y la evidencia más reciente sugiere que los individuos pueden dispersarse largas distancias fuera de la temporada de reproducción (Guest et al. 2020). Es un insectívoro aéreo nocturno. Parece tener un sistema de apareamiento tipo lek o lek, y los machos se reúnen para exhibirse en los ruedos de agosto a diciembre (Smith 2013, Fariña et al. 2018).Información sobre amenazas
Los pastizales y los hábitats del chaco en toda su distribución están siendo rápidamente destruidos por la ganadería extensiva, la agricultura de labranza, los incendios forestales y las quemas estacionales, el drenaje de humedales, el uso excesivo de pesticidas y la forestación con Pinus y Eucalyptus spp.(Pearman y Abadie 1995, Dinerstein et al. 1995, Lowen et al. 1996). En las últimas décadas, la expansión agrícola ha empujado la ganadería hacia tierras marginales (Marino et al. 2013) donde el sobrepastoreo probablemente degrada el hábitat, haciendo que muchos pastos sean inadecuados (A. Bodrati in litt. 2020). En el centro de Argentina, donde no se ha registrado la especie en décadas, el hábitat de los pastizales ha sido destruido en gran parte debido a las plantaciones de árboles (K. Cockle in litt. 2020). El hábitat de los humedales a lo largo del río Uruguay ha sido ampliamente drenado y convertido en tierras de cultivo y áreas urbanas (A. Bodrati, N. Fariña y K. Cockle in litt. 2021).
En el este de Paraguay, los pastizales restantes están fragmentados dentro de una matriz de agricultura industrial (K. Cockle in litt. 2020).Estado de conservación en Argentina (S.I.B.):
En Peligro (EN): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable). López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo & R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
En Peligro (EN): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
En Peligro de Extinción (PE): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable). Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Casi amenazado (NT): según UICN, 2004 (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN. 2004
Casi Amenazado (NT): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Atajacaminos de ala negra | Distribución
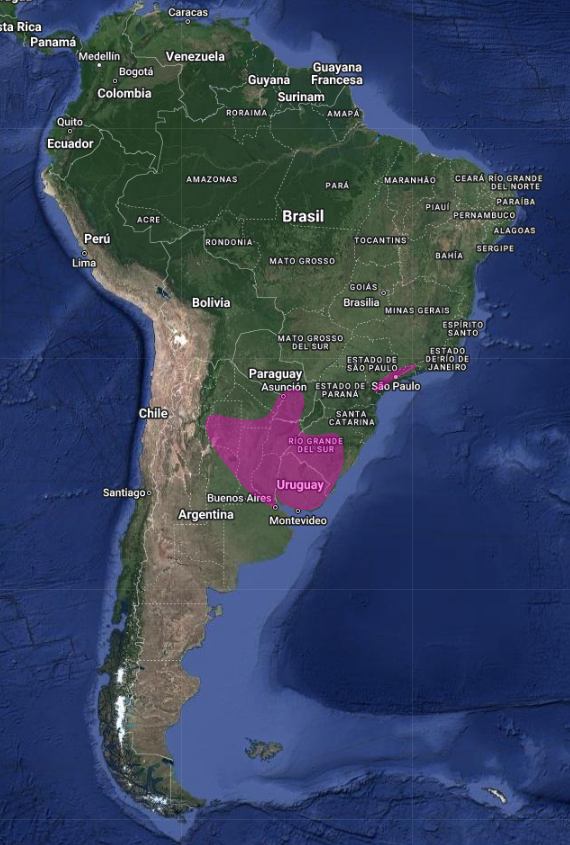
InfoNatura: Animals and Ecosystems of Latin America 2007 Su distribución es disyunta, en el este y sudeste de Brasil (Distrito Federal y en los Estados de Sao Paulo, Minas Gerais, Paraná y Río Grande do Sul) (Straube, 1991: 308), este de Paraguay y norte de Argentina, siendo rara su presencia y poco conocida su biología, en los tres países (Holmberg, 1939:175; Short, 1975:237; Olrog, 1979:137; Collar et al., 1992:462; Pearman & Abadie, 1995:12; Cleere, 2002:171; Accordi, 2002:227; Bornschein et al., 1996:125; Stotz et al., 1996:317; Lowen et al., 1997:17; Kirwan et al., 1999:202; Mazar Barnett & Pearman, 2001:48; Bodrati et al., 2019:157; de la Peña, 2020:231).
La inclusión repetida de Uruguay dentro de su distribución (Pinto, 1938:180; Olrog, 1979:137; Sick, 1997:421; Collar & Andrew, 1988:85) constituye probablemente un error en vista de que no existen registros documentados de su presencia en el país y permanece sin ser listado en las publicaciones recientes de avifauna nacional (Cuello & Gerzenstein, 1962; Gore & Gepp, 1979; Cuello, 1985:13); no obstante, el registro proveniente de Colón, que se ubica inmediatamente al otro lado del río Uruguay, en Argentina, indica la probabilidad de que la especie se halle presente en el país (Birdlife International, 1992:569)
En general se lo considera residente, pero Pearman & Abadie (1995:14) y Mazar Barnett & Pearman (2001:48) sugieren que en gran parte, sino enteramente, es migrante austral en Argentina, partiendo luego del periodo reproductivo, ya que todos los registros confirmados de Argentina eran del verano austral (octubre a febrero), mientras que los de Brasil eran a lo largo del año.
Contreras et al. (2014:318) concluyen en que es posible que la especie sea migrante, pero, en ese caso corresponde formular la pregunta: ¿Hacia dónde se dirige para realizar su residencia invernal? La cuestión queda abierta para futuras investigaciones al respecto.
Habita desde tierras bajas hasta los 1.100 msnm (Stotz et al. 1996:174).
Poco se conoce sobre la densidad de sus poblaciones y biología en general, y ha sido considerado como amenazado tanto a nivel nacional como internacional (Collar et al. 1992:463; BirdLife International 2022; MAyDS y AA 2017)Distribución geográfica en Argentina
En Argentina el Eleothreptus anomalus (Gould, 1838) en Jujuy, Salta, Santiago del Estero, Formosa, Chaco, Córdoba, Santa Fe, norte de Buenos Aires, Entre Ríos, Corrientes y Misiones (Short, 1975:237; Olrog, 1979:137; de la Peña, 1999:92; Contreras et al., 2014:318; de la Peña, 2015:335; de la Peña, 2020:231-232).
Un registro proveniente de Catamarca parece constituir un probable error y la inclusión de Salta en el mapa en Narosky e Yzurieta (2010:193) podría también tratarse de una equivocación (Collar, 1992:462; Cleere, 1998:296; Birdlife International, Categorías de amenaza, 1992:568). (Ver localidades, coordenadas y referencias en los enlaces)HÁBITAT
Se ha considerado al E. anomalus habitante de marismas o áreas cercanas al agua (Bornschein et al. 1996:125; Lowen et al. 1997:14; Accordi, 2001:227; Contreras et al., 2014:316; Straneck & Viñas, 1994; Cleere, 1998:295; de la Peña, 2020:231; Stotz et al., 1996:174).
Pero otros autores, lo han observado en hábitats tales como mesetas áridas, bosque en galería, bosque de transición, monte y pajonales, y baśandose en una revisión de datos publicados y otros registros aún sin publicar de Argentina y Brasil, concluyen que éste hábitat sería el más representativo, siendo falsa la asociación de la especie solo con las marismas (Pearman & Abadie, 1995:13; Kirwan et al. 1999:205; Young, 2015)
Accordi (2002:229) junto con Cleere (1998:295) y Kirwan (1999:205), coinciden en que el E. anomalus es dúctil en la selección de su hábitat
Desde los 0-1.100 msnm (Stotz et al., 1996:174).
Ecorregiones: Chaco húmedo, Delta e islas del Paraná, Espinal, Esteros del Iberá, Selva Paranaense. -
Atajacaminos de ala negra | Comportamiento
De hábitos crepusculares y nocturnos (Cleere, 2002:171). Captura los insectos despegando desde el suelo (Kirwan et al. 1999:203), o tal vez, volando bajo de forma continua sobre áreas abiertas. Probablemente solitario (Cleere, 1998:295).
A menudo se lo encuentra por la noche posado sobre caminos y senderos, o sobre ramas bajas, matorrales, o alambrados. Descansa sobre el suelo o pequeñas depresiones del terreno o entre las matas (Cleere, 1998:295; Cleere, 2002:171).
Toma vuelo con aleteos rápidos, pero rápidamente lo revierte a aleteo lento, que a menudo impresiona cómo de ave herida, o aleteos y deslizamientos suaves cerca del suelo (Cleere, 1998:295; Pereyra, 1939:235-236; Pearman & Abadie, 1995:12; Kirwan et al. 1999:203; Accordi, 2002:227; Straneck & Viñas, 1994). Pareciera que las arenas de despliegue de E. anomalus son utilizadas tradicionalmente año tras año (Fariña et al., 2018:126).
El vuelo del macho durante el cortejo de ha descrito como vuelo lento, planeando a corta distancia del suelo (0.8-1.2 m), y ocasionalmente acompañado de sonidos sordos «tuk tuk tuk» (Cleere, 1998:295)
Sedentario y parcialmente migratorio, las poblaciones del sur se mueven hacia el norte para evitar los inviernos australes (Abril-Agosto) (Cleere, 1998:295). En general se lo considera residente, pero Pearman & Abadie (1995:14) y Mazar Barnett & Pearman (2001:48) sugieren que en gran parte, sino enteramente, en Argentina es migrante austral, partiendo luego del periodo reproductivo, ya que todos los registros confirmados de Argentina eran del verano austral (octubre a febrero), mientras que los de Brasil eran a lo largo del año.
Contreras et al. (2014:318) concluyen en que es posible que la especie sea migrante, pero en ese caso, corresponde formular la pregunta: ¿Hacia dónde se dirige para realizar su residencia invernal? La cuestión queda abierta para futuras investigaciones al respecto.
Habita desde tierras bajas hasta los 1.100 msnm (Stotz et al., 1996:174).
Poco se conoce sobre la densidad de sus poblaciones y biología en general, y ha sido considerado como amenazado tanto a nivel nacional como internacional (Collar et al. 1992:463; BirdLife International 2022; MAyDS y AA 2017)VOCALIZACIONESPearman & Abadie, (1995:13) comentan que la canción del E. anomalus sigue siendo desconocida. Por otra parte, Straneck & Viñas (1994) describen su canto (llamada?) como una serie de suaves “chip, tchup, or tchut” repetidos a una velocidad de 8 notas /seg, durante unos 2-3 minutos.
Sin embargo otros autores no han registrado esta vocalización. Kirwan et al. (1999:203) lo describen como “el chirrido de un grillo”, que Accordi (2002:27) interpretó como el canto.
Cleere (1998:295) lo describe como un suave y único “tick” y Fariña et al. (2018:120) describen las llamadas de contacto como series repetidas de «tik» o «tzk» que se oyen solo a corta distancia. Esta vocalización es emitida comúnmente por individuos posados en el suelo, sobre vegetación baja y eventualmente en vuelo.
Las llamadas en vuelo incluyen un duro y nasal “gzee gzee” (Straneck & Viñas), que tampoco han sido registrados por otros autores. Solo se ha notificado un “tik” emitido por una hembra en vuelo (Kirwan et al., 1999:203).
Al crepúsculo, los machos hacen los primeros vuelos, realizando una vocalización fuerte que estaría ligada a vuelos de exhibición aérea sobre las arenas de despliegue. Straneck & Viñas (1994) interpretaron esta voz como un sonido mecánico emitido por el aleteo del macho y la llamaron “vuelo de proclamación territorial.” Por otro lado, Accordi (2002:229) se refiere a una vocalización emitida tanto en vuelo como posado. Fariña et al. (2018:120-121) no percibieron movimientos de alas que pudieran generarlo, ya que en ocasiones el sonido es emitido mientras el ave planea, por lo cual concuerdan con Accordi (2002:227) en interpretar este sonido como una vocalización. Durante su trabajo no registraron el sonido descrito como series de «chip chip chip chip» que Straneck & Viñas (1994) consideraron como posibles voces de la especie.Sonidos mecánicos: Los sonidos mecánicos emitidos son elaborados por el golpeteo y el vibrar de alas del macho adulto. Los autores Fariña et al., (2018:121) grabaron cuatro sonidos mecánicos: el primero y el segundo son hechos por un movimiento de las alas que al cerrarlas contra el cuerpo produce un golpe seco poco audible que suena como un «tuk» o «trk». Estos sonidos son emitidos al aterrizar un macho sobre el suelo luego de realizar un despliegue aéreo o al saltar y aterrizar sobre el mismo sitio. En noches silenciosas y con condiciones ambientales favorables (por ej. sin viento) pueden oírse hasta los 60 m. El tercer y cuarto de los sonidos mecánicos son de menor frecuencia (1 o 2 kHz) y son poco audibles, generados por el batir vibrante de las alas al posarse, y descriptibles como «brrrt» o «rrrrtk» (Fariña et al., 2018:121)
Accordi (2002:229) concluye que en ningún momento oyó el suave “chip, tchup” o “tchut” repetido a 8 notas/seg durante 3 minutos descrito por Straneck & Viñas (1994) y por Cleere (1998:295); tampoco los sonidos mecánicos originados por el movimiento de las alas, ni la vocalización nasal “gzeee gzeee” emitida por las hembras descritas por Straneck & Viñas (1994).ALIMENTACIÓNInsectívoro. Su dieta no se conoce en detalle. Pereyra (1939:236) informa la presencia de pequeños coleópteros, lepidópteros y hormigas en el análisis del contenido gástrico. Se alimenta en bordes de áreas abiertas y pastizales (Cleere, 1998:295).
REPRODUCCIÓNExiste muy poca información sobre la biología reproductiva del E. anomalus (Young, 2015).
Existen registros de huevos y polluelos jóvenes, en noviembre en Brasil, y juveniles recién emplumados a partir de diciembre; especímenes con gónadas aumentadas de tamaño desde agosto-octubre (Collar et al. 1992:465).
Cleere (1998:295) reporta para el sureste de Brasil los meses de agosto en Paraná, octubre en Minas Gerais, noviembre a principios de enero en el estado de Sao Paulo y septiembre-diciembre? en Argentina.
No construye nido y deposita los huevos directamente sobre el suelo.
Puesta de 2 huevos, elípticos de color acanelado-rosado o canela pálido, cubierto con pintas y manchas pardo-rojizas y grises en toda la superficie (Cleere, 1998:295; de la Peña, 2015:335 ; de la Peña, 2020:231).
Bodrati et al. (2019:159) comentan que Accordi (2008) presenta la única descripción de un sitio de nidificación de E. anomalus, en Capão Novo en Rio Grande do Sul, Brasil. Era un área arenosa recubierta irregularmente por matas de vegetación herbácea. La nidada consistía en dos huevos puestos sin ninguna preparación sobre la arena junto a una mata de 40 cm de altura. En derredor aparecía un área desprovista de vegetación, formando un círculo de 30 cm de diámetro en torno a los huevos.
Los pichones de E. anomalus no han sido descritos hasta la actualidad (Cleere,1998:295).
Krauczuk (2013) presenta, sin detalles, una fotografía de L. Krause (in litt. 2019) de un pichón, aparentemente no volador, que ofrece dudas.
En Argentina se localizaron nidos en Santa Fe (Hartert & Venturi, 1909:225), Santiago del Estero (Pereyra, 1950:228) y Corrientes (Bodrati et al, 2019:158; de la Peña, 2020:231). -
Atajacaminos de ala negra | Descripción
Descripción según: Cleere, (1998:295); Cleere, (2002:170-171); Pereyra, (1939:235); de la Peña, (2015:335); de la Peña, (2020:230).
Relativamente pequeño, con patrón de plumaje críptico dominado por los grises y marrones. Dimorfismo sexual.
Macho: Cabeza relativamente grande, con frente, corona y nuca gris parduzco; las plumas centrales abiertamente moteadas de negruzco amarronado con bordes ocráceos.
Pico corto pardo oscuro o negruzco y boca amplia
Raya superciliar blanquecina barrada de marrón. Iris marrón oscuro.
Línea debajo del bigote grisácea, teñida de canela, barrada de marrón y veteado beige. Barba beige-blanquecina, barrada de marrón. Garganta marrón, teñida de canela y veteada con beige.
Parte inferior de la garganta y superior del pecho marrón, moteado de canela y veteado de beige.
Ocasionalmente collar ocre en la nuca.
Dorso grisáceo-castaño claro moteado, apenas moteadas de marrón oscuro.
Escapulares gris parduzco pálido, con centros gris parduzco, con amplias bases y puntas finas.
Las remeras primarias curvadas ligeramente hacia arriba. La remera primaria más interna (R1) es la más corta, pero las adyacentes (R2-R4) son más largas.
Las primarias son basalmente beige y la mitad externa marrón. Las primarias más externas (R10-R6) con puntas amplias de color blanco; el blanco es más extenso sobre los vexilos externos.
Secundarias canela, manchadas de marrón claro y con puntas blanquecinas.
Terciarias gris parduzco claro, moteadas de gris oscuro amarronado.
Rabadilla y cubiertas supracaudales gris parduzco pálido, ligeramente moteadas de marrón oscuro y finamente barradas de marrón.
Vientre y flancos beige claro, barrados de marrón.
Cola corta, parda ocrácea barrada de negruzco. Timoneras marrones, con barras canela; el par central (T1) gris parduzco pálido, manchadas y finamente barradas de marrón. Las timoneras externas (T2-T4) con relativamente anchas puntas blanquecinas o blancas. Subcaudales beige pálido.
Tarsos cortos. Patas y dedos parduzcos.ç
Hembra: Más marrón que el macho, no posee la forma modificada de las remeras primarias. Primarias barradas de marrón y ocre-rojizo claro y con puntas beige blanquecinas. La primaria más larga es la próxima a la más externa (R9). Las remeras secundarias son de largo normal con puntas blanquecinas estrechas.
Zona ventral marrón.
Timoneras con puntas estrechas beige, manchadas de marrón.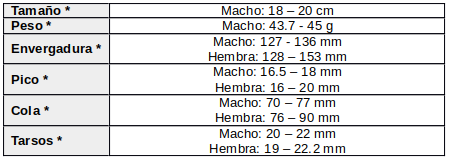
-
Atajacaminos de ala negra | Taxonomía

Descrito por Gould en 1837 como Amblypterus anomalus menciona que, la única información que puede aportar sobre este especimen (que describe como “realmente anómalo”) es que es el único que forma parte de la colección del Museo Británico y que “Mr Grey adquirió el ejemplar de una colección de pieles en Liverpool, y que le habían dicho que era de la localidad de Demerara”. Pinto (1978:180) comunica que la localidad es errónea y propone “al este de Sao Paulo, Brasil».
Más tarde Gray (1840:48) propone cambiar al género Eleothreptus. Hasta hace poco tiempo se consideró como monotípico (Peters, 1940:220; Dickinson, 2003:245) hasta que, los recientes resultados de los análisis filogenéticos de las secuencias de ADN (de genes mitocondriales y del núcleo), revelaron que el “Caprimulgus candidus” es hermano del “E. anomalus” (Larsen et al., 2007:793-794; Han et al., 2010:448; Sigurdsson & Cracraft, 2014:527) y que ahora se ha clasificado en el género Eleothreptus (Dickinson y Remsen, 2013). (Young, 2015). -
Atajacaminos de ala negra (Eleothreptus anomalus)

© Gould J. Icones avium, or, Figures and descriptions of new and interesting species of birds from various parts of the globe(1837-1838). Ilustración XI (Amblypterus anomalus) NOMBRES COMUNES: Atajacaminos Ala Negra, Atajacaminos alas negras, Atajacaminos de los pantanos (Argentina); Atajacaminos de pantano (Paraguay); Curiango, curiango-asa-de-foice, Curiango-do-banhado, curiangu (Brasil); Otros: Atajacaminos pantanero, Dormilón de los pantanos, Dormiloncito, Tapita, Zoncito (Pereyra, 1939:235; Chebez, 1996:135; de la Peña, 2015:335; de la Peña, 2020:230); en guaraní: Ybyya’u tuju
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS
- Zur Ornithologie Brasiliens : Resultate von Johann Natterers Reisen in den Jahren 1817 bis 1835. Pelzeln, August von, Natterer, Johann. Wien: A. Pichler’s Witwe & Sohn, 1871: 12 (Eleothreptus anomalus)
- Icones avium, or, Figures and descriptions of new and interesting species of birds from various parts of the globe. Gould, John, Gould, Elizabeth, Hullmandel, Charles Joseph. [London], Published by the author, 20, Broad Street, Golden Square, August, 1837-August, 1838. Lámina 11 (Amblypterus anomalus)
- The genera of birds : comprising their generic characters, a notice of the habits of each genus, and an extensive list of species referred to their several genera. Gray, George Robert, Hullmandel, Charles Joseph, impresor de las láminas. Mitchell, D. W. (David W.), ilustrador Hullmandel & Walton. London: Longman, Brown, Green, and Longmans, 1849. Vol 1: 48-49 (Eleothreptus anomalus); Ilustración 17 (Fig. 1)
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. [Birds]. London, 1874-98. Vol 16: 593 (Heleothreptus anomalus)
- Birds. Evans, A. H. Harmer, S. F. London: Macmillan,1899 (1909 printing): 418 (Heleothreptus anomalus)
- Argentine ornithology. A descriptive catalogue of the birds of the Argentine Republic. Sclater, P. L., Hudson, W. H. London: R. H. Porter, 1888-89. Vol 2: 16 (Heleothreptus anomalus)