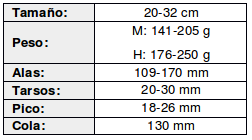
Es una especie que tiende a vivir en solitario o en parejas, presumiblemente sedentaria. Su hábito de alimentarse en campos de cultivo puede provocar que ocasionalmente se convierta en una plaga en áreas agrícolas. Es una especie terrestre, altamente caminadora. Cuando se siente expuesta, comienza a caminar o correr con la cabeza erguida, emitiendo un silbido característico. Sin embargo, si se siente amenazada, puede volar rápidamente y con destreza. Su vuelo es bajo y directo, generalmente a una altura de 2-4 metros sobre el suelo, con vuelos cortos de solo 15-20 metros antes de volver a posarse en el suelo (Belton, 1984:405; Bump & Bump, 1969:49-51; de la Peña, 2001:25; de la Peña, 2020:62).
Para descansar, suelen buscar huecos poco profundos en el suelo, generalmente debajo de arbustos o matas de hierba (Bump & Bump, 1969:51-52).
VOCALIZACIONES
Cantan de manera persistente durante el día, aunque en Argentina muestran una actividad vocal más prominente entre las 04:00 y las 08:00, y luego nuevamente desde las 16:00 hasta casi el atardecer, con repeticiones del canto en intervalos que oscilan entre 20 y 120 segundos (Bump & Bump, 1969:66). Este patrón vocal se mantiene a lo largo del año, aunque se intensifica durante la primavera y principios del verano (Bump & Bump, 1969:67).
La llamada más comúnmente escuchada, y que persiste a lo largo del año, consiste en una secuencia de cortos y agudos silbidos seguidos de una rápida serie de notas con una leve modulación de frecuencia descendente, descrita como «Pip, Pip, Pip, Pip, Pip, Pip, Pip, Pip, Pip, pipfüfüfififihh» (Straneck en De la Peña, 2016a; de la Peña, 2020:63).
Además, emiten otra vocalización, posiblemente de alarma, que consiste en una serie de notas agudas del tipo «quit, quit, quit«, repetidas a intervalos de ½ a 1 segundo durante 10 a 30 segundos, o hasta que el intruso cesa la persecución (Bump & Bump, 1969:65). También se ha observado una serie de notas afinadas, agudas y afiladas, que aceleran su ritmo, descienden en tono y disminuyen en intensidad hacia el final, finalizando con algunas notas cortas y bruscas, descritas como «ti ti, ti, ti, ti … tirrr«, con una duración de 8 segundos. El timbre de estas vocalizaciones es comparable al del grillo (Sick, 1997:166).
Se han registrado sonidos no vocales producidos por las alas al ser asustada, generando un sonido semejante a un zumbido (Bump & Bump, 1969:50; Gomes, 2020).
ALIMENTACIÓN
Se alimenta de semillas, brotes y pequeños invertebrados que recolecta en el suelo. Forrajea en el suelo, a menudo en cultivos, especialmente después de la cosecha, tomando avena, arroz, sorgo, trigo, maíz y soja; a veces, usa el pico para desenterrar los tubérculos. En Brasil sigue el pastoreo del ganado capturando insectos, especialmente saltamontes, que son perturbados por el movimiento de los mamíferos. También toma garrapatas del ganado (Ixodida)
Los siguientes autores, (de la Peña et al., 2009:25; de la Peña, 2015:30; Serié, 1921:231; Aravena, 1927; Fiora, 1933:176; Bonetto et al., 1961;(Bump & Bump, 1969:45; (Grigera, 1973; Evangelista et al., 1974; Di Giacomo, 2005; Salvador & Salvador en de la Peña y Salvador, 2010:62; Salvador et al., 2017:14; de la Peña, 2020:62-63; Silva & Sander, 1981:67), citan las siguientes familias de vegetales en su dieta:
Amaranthaceae: Amaranthus sp. (Aroma), Chenopodium sp. (Cenizo), Kochia sp. (Morenita, alfalfa criolla, alfalfa de los pobres, yuyo volador)
Apiaceae: Ammi majus (Falsa biznagra, apio cimarrón)
Apocynaceae: Asclepias mellodora (Yerba de víbora), Morrenia odorata (Doca, Tasi)
Asteraceae: Ambrosia tenuifolia (Altamisa), Baccharis sp. (Carqueja), Bidens sp. (Amor seco), Carduus sp. (Cardo), Carduus acanthoides (Cardo), Carduus thoermeri (Cardo pendiente, Cardo de caballo), Carthamus lanatus (Azotacristos), Centaurea calcitrapa (Abrepuño), Centaurea melitensis (Abrepuño amarillo – Abrepuño, Cizaña), Cirsium vulgare (Cardo negro), Cynara cardunculus (Cardo de Castilla, cardo, cardo de comer), Helianthus annuus (Girasol, Mirasol), Silybum marianum (Cardo asnal), Verbesina encelioides (Mirasolcito), Xanthium sp. (abrojo), Xanthium spinosum (Abrojo, Cepa caballo, Clonqui)
Brassicaceae: Brassica campestris (Nabo silvestre, Yuyo), Raphanus sativus (Rábano, Nabón), Sisymbrium irio (Mostacilla),
Caryophyllaceae: Silene sp. (Colleja), Stellaria media (Caapiquí, Yerba pajarera)
Chenopodiaceae: Salsola kali (Cardo ruso), Suaeda divaricata (Vidriera)
Convolvulaceae: Convolvulus arvensis (Correhuela, Campanilla), Ipomea sp. (Campanilla)
Cucurbitaceae: Cucurbita andreana (Zapallito amargo, Cháncara)
Cyperaceae: Carex sp. (Zacate de suampo?)
Dipsacaceae: Dipsacus fullonum (Cardo, carda)
Fabaceae: Aeschynomene montevidensis (Algodonillo), Cassia sp. (Coralillo), Glycine max (Soja), Medicago arabica (Trébol manchado), Medicago sativa (Alfa, Alfalfa, Lucerna), Melilotus indicus (Trébol de olor, Meliloto, Trébol amarillo), Trifolium sp. (Trébol), Vicia sativa (Arvejilla común, Arvejilla de verano), Vicia setifolia (Arvejilla)
Geraniaceae: Erodium cicutarium (Geranio silvestre, peludilla), Geranium dissectum (Alfilerillo)
Linaceae: Linum usitatissimum (Lino)
Malvaceae: Sida rhombifolia (Afata, Escoba dura)
Onagraceae: Oenothera sp. (Onagra)
Oxalidaceae: Oxalis sp. (Cuyén, Vinagrillo)
Papaveraceae: Fumaria sp. (Palomilla, Fumaria)
Poaceae: Avena barbata (Avena salvaje), Avena sativa (avena bandera-avena chilena-avena desnuda-avena blanca), Brachiaria sp. (Pasto brachiaria), Bromus catharticus (Cebadilla criolla), Cenchrus spinifex (Roseta), Cynodon dactylon (Gramillón, Gramilla brava), Dichantium aristatum (Pasto Angleton), Digitaria sanguinalis (Pata de gallina), Echinochloa sp. (Capín arroz, pasto colorado, pata de gallo, gramilla de rastrojo, pasto manchado, arrocillo), Eleusine indica ( Pata de gallina, pasto amargo, grama), Hordeum vulgare (Cebada forrajera), Lolium multiflorum (Cola de zorro, Raigrás criollo), Lolium perenne (Raygrass inglés o perenne), Panicum bergii (Paja voladora), Echinochloa colona (Arrocillo), Panicum miliaceum (Mijo común), Paspalum dilatatum (Cañota, Pasto miel, Pasto meloso), Piptochaetium montevidense (Pasto pelo de chancho, Flechilla fina), Secale cereale (Centeno), Setaria gracilis o parviflora (Cepillo de botellas, Paitén), Setaria italica (Mijo menor, Moha), Sorghum caffrorum (Sorgo, Maicillo), Sorghum halepense (Sorgo de Alepo), Sorghum saccharatum (Sorgo dulce), Sorghum technicum (Sorgo de escoba), Stipa sp. (Flechilla, Pasto puna), Triticum aestivum (Trigo), Zea mays (Maíz)
Poligonaceae: Polygonum sp. (Poligonum), Polygonum aviculare (Poligonum, Cien nudos, Sanguinaria siete sangrías), Polygonum convolvulus (Poligonum, Enredadera, Porotillo), Rumex crispus (Lengua de vaca, Romasa)
Solanaceae: Cestrum parqui (Coquerí, Coquerí Ybirá, Duraznillo silvestre), Solanum pseudocapsicum (Revienta Caballo), Solanum sisymbriifolium (Revientacaballos, Espina colorada)
Urticaceae: Urtica urens (Ortiga chica, Pyno)
Los animales de su dieta incluyen, según los siguientes autores: (Serié, 1921:231; Zotta, 1934; Lieberman, 1935; Fiora, 1933:176; Bonetto et al., 1961; Bump & Bump, 1961; Bump & Bump, 1969:45; Grigera, 1973; Evangelista et al., 1974; Salvador & Salvador en de la Peña y Salvador, 2010:62; Bodrati & Salvador, 2015a; Silva & Sander, 1981:67; Gomes, 2020)
Lepidoptera: Crisálidas de Mariposas diurnas, Mariposas nocturnas (Noctuidae): Orugas cortadoras (Peridroma saucia), oruga militar (Pseudaletia adultera)
Orthoptera: Grillo topo (Gryllus talpa), Grillo negro común (Gryllus assimilis), langostas, saltamontes, grillo subterráneo (Anurogryllus muticus), Tucura de los alfalfares (Dichroplus elongatus)
Hemiptera: Chinches, cochinillas, cigarras, pulgones, chicharras (Delphacidae), Ceresa.
Coleoptera: Escarabajos (Carabidae), Mariquitas, Vaquita del Áncora (Coccinellidae), escarabajo de las hojas, Vaquita de San Antonio, pulguillas (Chrysomelidae), gorgojos, gorgojo de la alfalfa (Curculionidae), cascarudos (Elateridae), escarabajos vagabundos (Staphylinidae), escarabajo pelotero (Scarabaeidae), escarabajo oscuro (Tenebrionidae), Merilido Rayado o Gorgojo Rayado (Melyridae)
Hymenoptera: Avejas, avispas, abejorros, hormigas (Formicidae): hormigas cortadoras de hojas, hormigas carpinteras, hormiga de fuego y hormigas coloradas.
Arachnida: Arañas
Myriapoda: Milpiés, Julida (Diplopoda),
Diptera: Moscas, mosquitos, tábanos, mosca rayada de las flores
Isoptera: Termitas
OTROS
Insectos blatodeos (cucarachas) de la familia Blaberidae
Annelida (lombrices de tierra, sanguijuelas)
Arena, piedritas
REPRODUCCIÓN
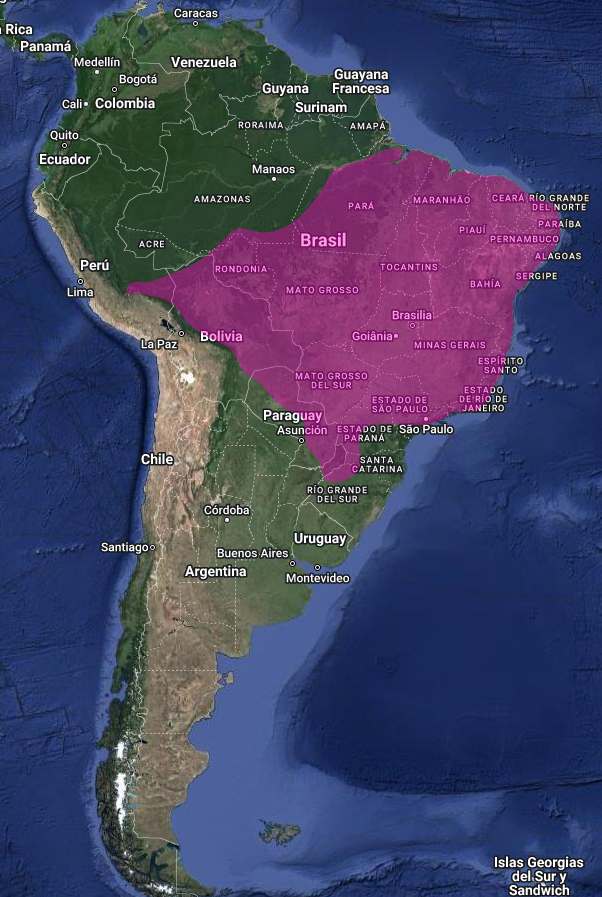
En Argentina, la temporada abarca desde septiembre hasta abril, con tres a cuatro nidadas al año (Bump & Bump, 1969:52-53). Se han localizado nidos y/o pichones en varias provincias argentinas, como Formosa, Chaco, Misiones, Corrientes, Entre Ríos, Córdoba, Mendoza, Santa Fe, Buenos Aires, y La Pampa (de la Peña, 2013b:20; de la Peña, 2015:30).
Los nidos consisten en depresiones o concavidades en la tierra (de 10 a 12 cm de diámetro), que pueden o no estar revestidos con pastos y/o plumas, a veces con un reborde de estos elementos. Suelen estar ocultos entre matas de pasto o en la base de arbustos grandes. Ocasionalmente, los nidos pueden encontrarse cercanos entre sí, a tan solo 12 metros de distancia (Bump & Bump, 1969:57; de la Peña, 2015:30; Gomes, 2020). La postura consta de 3-9 huevos, de forma elíptica u ovoide, con un color brillante que va desde el chocolate hasta el marrón vinoso (Sick, 1997:166). Video (de la Peña, M.R.)
Es el macho quien incuba los huevos durante 16-17 días y se encarga del cuidado de los jóvenes después de la eclosión, hasta que estos se independizan después de tres o cuatro semanas. Los pichones abandonan el nido pocas horas después de nacer. La destrucción de nidos puede ocurrir por diversas razones, como inundaciones, depredación por animales, cortadoras de pasto, entre otros (de la Peña, 2015:30).
En Brasil (Rio Grande do Sul), se ha observado que la reproducción de esta especie es marcadamente estacional, comenzando en septiembre y terminando a fines de febrero o marzo (Burger, 1991:169).