- Administración de Parques Nacionales. Sistema de Información de Biodiversidad. Argentina. (s.f.) Ficha: Celeus Galeatus. Recuperado de https://sib.gob.ar/especies/celeus-galeatus el 19/9/2020.
- Aleixo, A., & Galetti, M. (1997). The conservation of the avifauna in a lowland Atlantic forest in south-east Brazil. Bird Conservation International, 7(3), 235-261. (enlace)
- Antunes, A.Z., de Eston, M.R., dos Santos, A.M.R., & Menezes, G.V. (2006). Avaliação das informações disponíveis sobre a avifauna do Parque Estadual Carlos Botelho. Evaluation of available information on birds of Carlos Botelho State Park. Revista do Instituto Florestal. Rev. Inst. Flor., São Paulo, v. 18, n. único, p. 103-120 (enlace)
- Aves Argentinas, & SAyDS. (2008). Categorización de las aves de la Argentina según su estado de conservación. Aves Argentinas/Asociación Ornitológica del Plata y Secretaría de Ambiente y Desarrollo Sustentable, Buenos Aires, Argentina. (enlace)
- Barnett, J.M. & Pearman, M. (2001). Lista Comentada de las Aves Argentinas (1º Ed.). Lynx Edicions. Barcelona.
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178(4):369–636. (enlace)
- Benz B.W., Robbins M.B., Peterson A.T. (2006). Evolutionary history of woodpeckers and allies (Aves: Picidae): placing key taxa on the phylogenetic tree. Molecular Phylogenetics and Evolution 40: 389 – 399. (enlace)
- Benz, B.W., Robbins, M.B., & Zimmer, K.J. (2015). Phylogenetic relationships of the Helmeted Woodpecker (Dryocopus galeatus): A case of interspecific mimicry? The Auk: Ornithological Advances, 132(4), 938-950. (enlace)
- Birdlife International (1992) Aves Amenazadas de las Americas, Libro Rojo de BirdLife International (enlace)
- BirdLife International (2020) Species factsheet: Celeus galeatus. Downloaded from http://www.birdlife.org on 15/10/2020.
- Blendinger, P.G. (1998). Registros de aves poco frecuentes en la Argentina y sector antártico argentino. Nuestras Aves. 38: 5–8. (enlace)
- Bodrati, A. (2005). Barra Concepción. En A. S. Di Giacomo (editor). Áreas importantes para la conservación de las aves de Argentina. Sitios prioritarios para la conservación de la biodiversidad: 310-311. Temas de Naturaleza y Conservación 5. AA/Asociación Ornitológica del Plata, Buenos Aires. (enlace)
- Bodrati, A. & Cockle, K. (2006). Habitat, distribution, and conservation of Atlantic Forest birds in Argentina: notes on nine rare or threatened species. Ornitología Neotropical 17: 243-258. (enlace)
- Bodrati, A., Cockle, K., Segovia, J.M., Roesler, I., Areta, J. I. & Jordan, E. (2010). La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga 32: 41–64. (enlace)
- Bodrati, A., J.I. Areta & E. White. (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves 57: 63-80. (enlace)
- Brooks, T.M., Barnes, R., Bartrina, L., Butchart, S.H.M., Clay, R.P., Esquivel, E.Z., Etcheverry, N.I., Lowen, J.C. & Vincent, J. (1993). Bird Surveys and Conservation in the Paraguayan Atlantic Forest: Project CANOPY ’92 Final Report. BirdLife Study Report 57. BirdLife International, Cambridge. (enlace)
- Brooks, T., Tobias, J., & Balmford, A. (1999). Deforestation and bird extinctions in the Atlantic forest. Animal Conservation 2: 211-222. (enlace)
- Cebolla Badie, M. (2000). El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación. Suplemento Antropológico, XXXV(2), 9-188. (enlace)
- Chebez, J.C. (1995). Nuevos datos sobre Dryocopus galeatus (Piciformes: Picidae) en la Argentina. Hornero. 14(01 y02): 054-057. (enlace)
- Chébez, J.C. (1996). Fauna Misionera, Catálogo Sistemático y Zoogeográfico de los vertebrados de la Provincia de Misiones (Argentina) (1º Ed.). Editorial L.O.L.A. (Literature of Latin American): 139
- Chebez, J.C. (2008). Los Que se Van: aves (Fauna argentina amenazada). Editorial Albatros, Buenos Aires. 416 pp
- Chebez, J.C., & Casañas, H. (2000). Áreas claves para la conservación de la biodiversidad de la provincia de Misiones, Argentina.(Fauna Vertebrada). FVSA (Fundación Vida Silvestre Argentina) e WWF (World Wildlife Fund). Memorias del Taller Visión Biológica de la Selva Atlántica. Puerto Iguazú, FVSA e WWF, 1-79. (enlace)
- Cockle, K.L. (2010). Interspecific cavity-sharing between a Helmeted Woodpecker (Dryocopus galeatus) and two White-eyed Parakeets (Aratinga leucophthalma). Wilson Journal of Ornithology 122: 803–806. (enlace)
- Collar, N.J. & P. Andrew (1988) Birds to watch: the ICBP world checklist of threatened birds. ICBP Technical Publication 8. International Council for Bird Preservation, Cambridge, United Kingdom. (enlace)
- Collar, N.J., Gonzaga, L.P., Krabbe, N., Madroño, A., Naranjo, L.G., Parker, T.A. & Wege, D.C. (1992). Threatened Birds of the Americas. The ICBP/IUCN Red Data Book. Part 2. 3rd edition. ICBP, Cambridge (enlace)
- Coconier, E.G. & Di Giácomo, A.S. (2009) Argentina. Pág. 59 – 70 en C. Devenish, D. F. Díaz Fernández, R. P. Clay, I. Davidson & I. Yépez Zabala Eds. Important Bird Areas Americas – Priority sites for biodiversity conservation. Quito, Ecuador: BirdLife International (BirdLife Conservation Series Nº. 16).
- Dabbene, R. (1910). Ornitología Argentina. An. Mus. Nac. Bs. As. 18:1-512.
- Da Fonseca, S. (1942). Conferencia del Prof. Secundino da Fonseca. – Algunas observaciones obtenidas en el viaje a Misiones. Reuniones Ornitológicas de la S.O.P. El Hornero, 008 (02): 271. (enlace)
- de Andrade Figueiredo, L.Z. (Editor) (1998). Projeto: “Aves ameaçadas de extinção do estado de São Paulo”. Centro de Estudios Ornitologicos. Bol. Soc. Antioqueña Orn.. 13: 28-32. (enlace)
- De la Peña, M.R. (1999). Aves Argentinas. Lista y Distribución (1º Ed.). L.O.L.A. (Literature of Latin America): 109 (514)
- De la Peña, M.R. (2015). Aves Argentinas. EUDEBA, UNL; Vol. 1: 391
- De la Peña M.R., & Salvador S. (2016). Aves Argentinas: Descripción, comportamiento, Reproducción y Distribución. Trogonidae a Furnariidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), 20(2): 99-101. (enlace)
- Del Hoyo, J. Ed. (2020) All the Birds of the World. Lynx Edicions. Barcelona. 967 pp
- EcoRegistros. (2020). Carpintero Cara Canela (Celeus galeatus, Temminck, 1822); Recuperado de http://www.ecoregistros.org/ficha/Celeus-galeatus el 29/10/2020.
- Fernández, J. M., Areta, J. I., & Lammertink, M. (2020). Does foraging competition drive plumage convergence in three look-alike Atlantic Forest woodpecker species? Journal of Ornithology, 161(4), 1105-1116. (abstract)
- Fuchs J., Ohlson J.I., Ericson P.G.P. & Pasquet E. (2007). Synchronous intercontinental splits between assemblages of woodpeckers suggested by molecular data. Zool. Scripta 36: 11 – 25.
- Fundación Moisés Bertoni /USAID. (2006). Reserva Natural Privada Tapyta. Plan de Manejo 2006 – 2010. Asunción, Paraguay: Fundación Moisés Bertoni para la Conservación de la Naturaleza (FMB), Agencia de los Estados Unidos para el Desarrollo Internacional (USAID).
- Galindo-Leal, C. & de Gusmão Câmera, I. (2003). The Atlantic Forest of South America: biodiversity status, threats, and outlook. State of the Hotspots series, Center for Applied Biodiversity Science at Conservation International. Island Press, Washington, D.C. (enlace)
- Giraudo, A.R., Baldo, J.L., & Abramson, R.R. (1993). Aves observadas en el sudoeste, centro, y este de Misiones (República Argentina), con la mención de especies nuevas o poco conocidas para la provincia. Not. Faun, 49, 1-13. (enlace)
- Gliesch, R. (1930). Lista das aves colligidas e observadas no estado do Rio Grande do Sul. Egatea 15: 276-292.
- Hayes, F.E. (1995). Status, distribution and biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, USA. (enlace)
- ICMBio, Instituto Chico Mendes de Conservação da Biodiversidade. (2015). Plano de Ação Nacional para a Conservação das Aves da Mata Atlântica. (enlace)
- Knox, A.G. & Walters, M.P. (1994). Extinct and Endangered Birds in the Collections of the Natural History Museum. British Ornithologists’ Club Occasional Publications Nº1: 181 (enlace)
- Kohler, G.U., Legal, E., & Testoni, C. (2009). Registros de aves raras ou ameaçadas em novas localidades no Estado de Santa Catarina, sul do Brasil. Cotinga, 31, 104-107. (enlace)
- Krauczuk, E.R. & Baldo, J.D. (2004). Contribuição para o conhecimento da avifauna de um fragmento de floresta com araucária em Misiones, Argentina. Atualidades Ornitológicas 119: 6 (enlace)
- Krauczuk, E.R. (2008). Riqueza específica, abundancia y ambientes de las aves de Corpus Christi, San Ignacio, Misiones, Argentina. Lundiana 9: 29-39. (enlace)
- Lammertink, M. & Klavins, J. (2012). Nest and fledgling of the Helmeted Woodpecker (Dryocopus galeatus). Ornitología Neotropical. 23: 455–460. (enlace)
- Lammertink, M., Cockle, K.L., Bodrati, A., & Santos, R.E.F. (2012). Helmeted Woodpecker (Dryocopus galeatus). Neotropical Birds. 10.2173/nb.helwoo1.01. (enlace)
- Lammertink, M. (2014). Trends in threat status and priorities in conservation of the woodpeckers of the world. Acta Ornithologica. 49(2): 207-219. (enlace)
- Lammertink, M., Kopuchian, C., Brandl, H. B., Tubaro, P. L., & Winkler, H. (2016). A striking case of deceptive woodpecker colouration: the threatened Helmeted Woodpecker Dryocopus galeatus belongs in the genus Celeus. Journal of Ornithology, 157(1), 109-116. (enlace)
- Lammertink, M., Fernández, J.M., & Cockle, K.L. (2019). Helmeted Woodpeckers roost in decay-formed cavities in large living trees: A clue to an old-growth forest association. The Condor: Ornithological Applications, 121(1) (enlace)
- Lammertink, M., K. L. Cockle, A. Bodrati, & R. E. F. Santos (2020). Helmeted Woodpecker (Celeus galeatus), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.helwoo1.01
- Lammertink, M., Fernández, J.M. & Cockle, K.L. (2020a) Comparison of nesting ecology of three co-existing Atlantic Forest woodpeckers reveals narrow specialization in the Helmeted Woodpecker Celeus galeatus. Acta Ornithologica 55: 101–110. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Picamaderos Caricanelo (Dryocopus galeatus, Temminck, 1822). Recuperado de https://avibase.bsc-eoc.org/species.jsp?avibaseid=469C98FCFC768A40 el 29/10/2020.
- Lowen, J.C., Clay, R.P., Brooks, T.M., Esquivel, E.Z., Bartrina, L., Barnes, R., Butchart, S.H.M. & Etcheverry, N.I. (1995). Bird conservation in the Paraguayan Atlantic forest. Cotinga. 4: 58–64. (enlace)
- Lowen, J.C., Bartrina, L., Clay, R.P. & Tobias, J.A. (1996). Biological Surveys and Conservation Priorities in Eastern Paraguay: the Final Reports of Projects Canopy ’92 and Yacutinga ’95. CSB Conservation Publications, Cambridge, UK.
- Lucero, M.M. & Alabarce, E.A. (1980). Frecuencia de especies e individuos en una parcela de la selva misionera (Aves). Rev. Mus. Arg. Cienc. Nat. Bernardino Rivadavia Ecol. 2(7): 117-127.
- Luego. (1995). Noticias Neotropicales. Esperanza para el pájaro carpintero con casco en Misiones, Argentina. Cotinga. 3: 9.
- Madroño, A. & Esquivel, E.Z. (1995). Reserva Natural del Bosque de Mbaracayú: su importancia en la conservación de aves amenazadas, cuasi-amenazadas y endémicas del Bosque Atlántico. Cotinga. 4: 52–57. (enlace)
- Madroño, A., Clay, R.P., Robbins, M.B., Rice, N.H., Faucett, R.C. & Lowen, J.C. (1997). An avifaunal survey of the vanishing interior Atlantic forest of San Rafael National Park, Departments Itapúa/Caazapá, Paraguay. Cotinga: 45-53. (enlace)
- Mähler, Jr., J. (1995) Histórico avifaunístico del (sic) Parque Nacional do Iguaçu, Paraná, Brasil. Resum. V Congr. Ornitol. Neotrop., R.177. (enlace)
- MAyDS y AA (Ministerio de Ambiente y Desarrollo Sustentable y Aves Argentina) (2017). Categorización de las Aves de la Argentina (2015). Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas, edición electrónica. C. A. Buenos Aires, Argentina. XX pp (enlace)
- Naka, L.N., Mazar Barnett, J., Kirwan, G.M., Tobias, J.A. & de Azevedo, M.A.G. (2000). New and noteworthy bird records from Santa Catarina state, Brazil. Bull. Brit. Orn. Club. 120(4): 237–250. (enlace)
- Narosky, T. & Chébez, J.C. (2002). Guía para la Identificación de las Aves de Iguazú. (1º Ed.). Vazquez Mazzini Editores:71 (118)
- Narosky, T., & Yzurieta, D. (2010). Aves de Argentina y Uruguay. Guía de identificación (16.a Ed.). Vázquez Mazzini Editores: 224 (500)
- Navas, J.R. & Bo, N.A. (1993). Aves nuevas o poco conocidas de Misiones, Argentina. V (addenda). Rev. Mus. Arg. Cienc. Nat. Bernardino Rivadavia. 16(4): 37–50.
- Ordano, M.A. & Bosisio, A.C. (2001). Catálogo de aves del Museo Provincial de Ciencias Naturales «Florentino Ameghino», Santa Fe, Argentina. Serie Catálogos, 7: 1-85. (enlace)
- Parker, T.A. & Goerck, J.M. (1997). The importance of national parks and biological reserves to bird conservation in the Atlantic Forest region of Brazil. Pp. 527–541 in: Remsen (1997). (enlace)
- Paynter, R.A. (1995). Ornithological Gazetteer of Argentina. (2º Ed.) Museum of Comparative Zoology, Cambridge, Massachusetts. (enlace)
- Paynter, R.A. (1989). Ornithological Gazetteer of Paraguay. 2nd edition. Museum of Comparative Zoology, Cambridge, Massachusetts. (enlace)
- Paynter, R.A. & Traylor, M.A. (1991). Ornithological Gazetteer of Brazil. Museum of Comparative Zoology, Cambridge, Massachusetts. (enlace)
- Pergolani de Costa, M.J. (1962). Los pícidos argentinos. VI. Los géneros Celeus boie, Dryocopus boie y Phloeoceastes Cabanis. Acta Zool. Lilloana 18: 183-210.
- Pinto, O.M. de Oliveira & Camargo, E.A. (1955). Lista anotada de aves colecionadas nos límites occidentais do estado do Paraná. Pap. Avuls. Dept. Zool. São Paulo. 12: 215-234.
- Pinto, O.M.O. (1938). Catalogo das Aves do Brasil e Lista dos Exemplares que as Representam no Museu Paulista. 1a parte. Aves não Passeriformes e Passeriformes não Oscines excluída a Fam. Tyrannidae e seguintes. Revista do Museu Paulista 22: 1–566.
- Pinto Marques, F., Barbalho de Lima Silva, S. & Custódio Leal, D. (2018). En Livro Vermelho da Fauna Brasileira Ameaçada de Extinçao; Vol III: Aves (1º Ed.) Brasília, DF: ICMBio/MMA. 712 pp (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Picamaderos caricanelo · Celeus galeatus · (Temminck, 1822); Recuperado de https://www.xeno-canto.org/species/Celeus-galeatus?pg=1 el 26/10/2020.
- Rangel Olivera, L. (2015) Reflejos en las aguas del Moconá: Naturaleza e Historia del Parque Provincial Moconá, su entorno y su gente (1º Ed.) CABA: Fundación de Historia Natural Félix de Azara; 184 pp
- Rupp, A.E., G. Thom-e-Silva & C.E. Zimmermann. (2007). Registros documentados de aves raras em Santa Catarina, Brasil. p. 94 In: Resumos do XV Congresso Brasileiro de Ornitologia, Porto Alegre, PUCRS (enlace)
- Rupp. A.E. (2010). Avaliação Ecológica Rápida da Avifauna do Parque Nacional das Araucárias. Associação de Preservação do Meio Ambiente e da Vida. Resumos Congresso Brasileiro de Ornitologia XV: 2007: Porto Alegre, RS): PAINEL FA34 (enlace)
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J., & Calo, J. (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina (1º Ed.). L.O.L.A. (Literature of Latin America): 38
- Santos, R.E.F. (2008). Dryocopus galeatus (Temminck,1822): registro documentado e novas informações para o Vale do Rio Itajaí, Santa Catarina, Brasil. Atualidades Ornitológicas 143: 20–23.
- Santos, R.E.F. (2009). Pica-pau-de-cara-canela (Dryocopus galeatus). Pages 69-80 in: Instituto Ambiental do Paraná. Planos de conservação para especies de aves ameaçadas no Paraná. IAP/Projeto Paraná Biodiversidade; 69-81 (enlace)
- Scherer-Neto, P. & Costa Straube, F. (1995) Aves do Paraná: (história, lista anotada e bibliografia) Curitiba: Ed. dos autores. 79 pp (enlace)
- Short, L.L. (1982). Woodpeckers of the world. Greenville: Delaware Museum of Natural History. 409-410
- Sick, H. (1997). Ornitologia brasileira. (3º Ed.). Editora Nova Fronteira, Rio de Janeiro; 515
- Silva, C.P., Mähler J.K.F. Jr., Marcuzzo, S.B. & Ferreira, S. (2005). Plano de manejo do Parque Estadual do Turvo. Porto Alegre, Secretaria Estadual de Meio Ambiente, 355p. (enlace)
- Storer, R.W. (1989). Notes on Paraguayan birds. Occas. Pap. Mus. Zool. Univ. Mich. 719: 1–21. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A. & Moskovits, D.K. (1996). Neotropical Birds, Ecology and Conservation. University of Chicago Press, Chicago & London: 198
- Straube, F.C., Bornschein, M.R., & Scherer-Neto, P. (1996). Coletânea da avifauna da região noroeste do Estado do Paraná e áreas limítrofes (Brasil). Arquivos de Biologia e Tecnologia, 39(1), 193-214. (enlace)
- Straube, F.C. & Scherer-Neto, P. (2001) História da ornitologia no Paraná. p. 43-116. In: Straube, F. C. (ed.) Ornitologia sem fronteiras e Resumos do IX Congresso Brasileiro de Ornitologia. Curitiba: Fund. O Boticário de Proteção à Natureza. (enlace)
- Willis, E.O. & Oniki, Y. (1993). New and reconfirmed birds from the state of São Paulo, Brazil, with notes on disappearing species. Bull. Brit. Orn. Club. 113(1): 23–34. (enlace)
- Winkler, H., DA Christie, A. Bonan, E. de Juana & CJ Sharpe (2015). Helmeted Woodpecker (Hylatomus galeatus). En Handbook of the Birds of the World Alive (J. del Hoyo, A. Elliott, J. Sargatal, DA Christie y E. de Juana, Editores). Lynx Edicions, Barcelona.
-
-
Carpintero Cara Canela | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: : VULNERABLE.Fuente: (Clements checklist 2012) (Collar, 1998:202)(Birdlife International, 2020)
Se cree que la población de esta especie tiene menos de 10,000 individuos maduros (Bodrati, et al., 2010:46) (Kohler, et al.,2009:105) (Lammertink, et al., 2011:50) (Rupp et al., 2010:94)(Lammertink et al., 2014:210) y por lo tanto se coloca en la banda de 2.500-9.999 individuos maduros (Birdlife International, 2020)
Vulnerable (VU): según UICN, 2004 (Unión Internacional para la Conservación de la Naturaleza ). Lista Roja de la UICN. 2004
En Argentina:
Amenazada (AM): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas ). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
Este carpintero fue indudablemente subobservado durante varias décadas, considerado una de las especies de pícido más raras del mundo (Short, 1982:409) y llegando a figurar incluso en listas internacionales de especies extinguidas (Chebez, 1995:54). Afortunadamente cuenta con gran cantidad de avistajes recientes coincidentes en gran parte con el Corredor Verde, haciéndose presente en numerosas áreas protegidas
(Chebez, 1995:55). Su presencia en localidades australes con montes fragmentados como Campo San Juan, Arroyo Anselmo, Ruinas de Sta. María, etc., demuestran que la especie resulta bastante tolerante a algunas modificaciones (Chébez y Casaño, 2000:25) (Chébez, 2008:294)
Es posible que parte de la rareza de esta especie sea natural y podría deberse a que parece requerir largos trechos de bosque, por lo que sería víctima de su constante disminución y fragmentación; sin embargo, en contraposición, existen observaciones recientes en Misiones, Argentina, de aves que se encontraban en áreas bastante pequeñas, y en ocasiones en áreas forestadas que han sufrido mucha alteración, lo que sugiere que la pérdida del hábitat podría no constituir una amenaza tan seria como podría esperarse.
La población mundial disminuyó drásticamente y continúa disminuyendo como resultado de la pérdida y degradación de los bosques. El rango histórico del pájaro Carpintero Cara Canela se extendía sobre un área de aproximadamente 900 km por 900 km y medía 661,330 km 2 . El rango reciente, según lo definido por los registros posteriores a 1985, es ca. 20% del rango original (datos no publicados de Lammertink). Las áreas sin registros recientes coinciden con áreas con deforestación severa ubicadas en el norte y sur del área de distribución original de la especie, en el estado de São Paulo, el estado de Paraná norte, el estado de Santa Catarina sur y los estados de Rio Grande do Sul en Brasil (de Andrade Figueiredo, L.Z. , 1998:24); (Belton, 1984:594), así como en gran parte de los departamentos de Caaguazú y Alto Paraná en Paraguay. (Fundación Moisés Bertoni para la Conservación de la Naturaleza (FMB), Agencia de los Estados Unidos para el Desarrollo Internacional (USAID):114)
Dentro del área de distribución reciente de la especie, al menos otro 70% del hábitat es un hábitat deforestado e inhóspito. Del bosque restante, menos del 1% es bosque antiguo en el que el Celeus galeatus alcanza sus mejores densidades (Brooks et al. 1993:41). En el sur de Misiones, E. Krauczuk informó tasas de observación en el bosque primario y el bosque perturbado adyacente en una proporción de 1:0,18 entre los hábitats (enLammertink et al. 2012:47). La estimación de la población global está entre 400 y 8,900 individuos. BirdLife International (2011), sitúa a la población mundial en el grupo de 2.500-9.999 individuos y clasificado como globalmente Vulnerable. Si en el futuro, las estimaciones de población más precisas mostraran que la población mundial está por debajo de los 2500 individuos maduros (es decir, en el extremo inferior de nuestro rango estimado actual de 400 a 8,900 individuos), se reclasificaría como En peligro.
Listada como En Peligro en Argentina (Aves Argentinas y SAyDS 2008), se estima que un 50% del hábitat apropiado para este carpintero se encuentra adecuadamente protegido (M. Lammertink com. pers.). Aunque existe caza furtiva ilegal en las reservas, casi no existe la tala ilegal dentro de las áreas protegidas de Misiones. En las selvas que todavía están afuera de áreas protegidas según leyes nacionales y provinciales no está permitida la conversión a campos o plantaciones de árboles exóticos, solo la extracción selectiva de madera nativa.
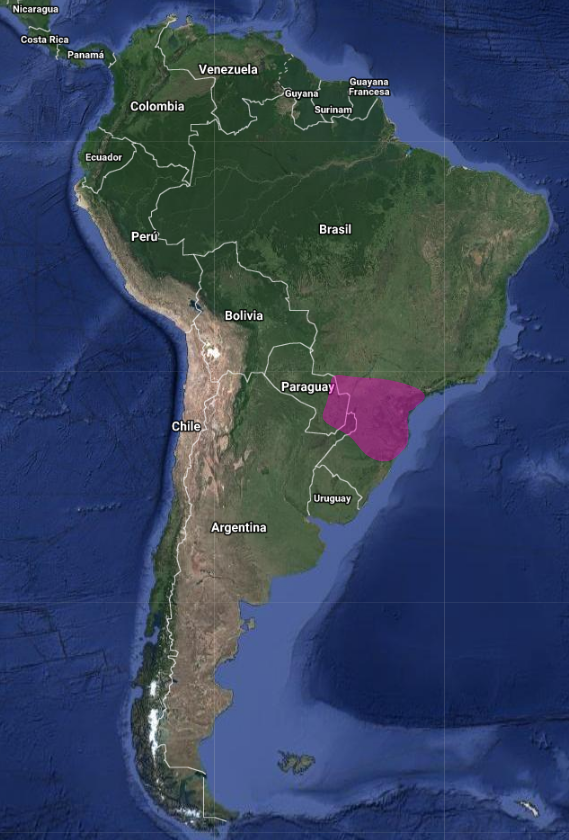
En Argentina sólo ocurre en los remanentes de selva paranaense continua de Misiones, particularmente en el PN Iguazú y los parques provinciales Urugua-í, Cruce Caballero y el adyacente Valle de la Alegría, y la Reserva de la Biósfera Yabotí. En el suroeste de Misiones se encuentran poblaciones pequeñas en fragmentos de selvas aisladas en las cercanías de la localidad de Posadas y Oberá. Se estima que un 50% del hábitat apropiado para este carpintero se encuentra adecuadamente protegido (M. Lammertink com. pers.). Existe caza furtiva ilegal en las reservas pero casi no existe la tala ilegal dentro de las áreas protegidas de Misiones. En las selvas que todavía están afuera de áreas protegidas según leyes nacionales y provinciales no está permitida la conversión a campos o plantaciones de árboles exóticos, solo la extracción selectiva de madera nativa.
La extracción selectiva de madera nativa impacta sobre las poblaciones del Celeus galeatus porque prefiere selva de edad madura pero mantiene poblaciones reducidas en áreas con extracción. Por tanto se estima que reduce la población en las áreas con explotación de
madera nativa (que ocurre en quizás 30% de las selvas remanentes) pero no desaparece en estas áreas (M. Lammertink com. pers.). También hay áreas con deforestación de selva nativa por causa de la urbanización, construcción de caminos y la intrusión de chacras y en estas áreas desaparece este carpintero (Lammertink et al. 2011). Se estima que en Misiones la población rondaría entre unos 1.100 a 4.500 individuos maduros en un área que abarca entre 25.000 -40.000 km2 (Lammertink et al. 2012). Por tanto, aplica al criterio C1 para Vulnerable según UICN (menos de 10.000 individuos disminuyendo entre 10% y 20% en tres generaciones). La población contigua en Paraguay está considerada también como “amenazada de extinción” (SEAM 2006). En Brasil, está considerado como Vulnerable (Silveira y Straube 2008). Anteriormente fue categorizada como En Peligro (AA/AOP y DFS/SAyDS 2008) sin embargo, aplica como Amenazada. Categorización 2015: AM. Evaluador: DR MARTJAN LAMMERTINK, CICyTTP -CONICET (:127, En Peligro en Paraguay (SEAM 2010) y como Vulnerable en Brasil (MMA 2003) (Pinto Marques et al., 2018:247-248) -
Carpintero Cara Canela | Distribución
InfoNatura: Animals and Ecosystems of Latin America 2007 Endémico de la región del Bosque Atlántico (Paranaense) (Barnett & Pearman, 2001:52) con un área de distribución reducida a, sureste de Brasil (Sao Pablo, Paraná y Santa Catarina), este de Paraguay (Departamentos de Amambay, San Pedro, Canindeyú, Caaguazú, Alto Paraná, Guairá, Cazaapá, Itapuá y Paraguarí) y extremo noreste de Argentina (Misiones). La crónica y la opinión común coinciden en que el Celeus galeatus es una especie rara o muy rara (Short 1982:409, Sick, 1997:515, Stotz, 1996, Hayes, 1995). Sin embargo, la especulación de que el ave podría hallarse incluso extinta (Short 1982:409) ha dado paso a la expectativa (apoyada por el gran número de registros previos que no habían sido publicados) de que podría comprobarse que no era tan rara como se temía. La población que se halla presente en los Parques Nacionales aledaños, Iguaçu en Brasil e Iguazú en Argentina, parece ser la más grande y a salvo; sin embargo, el fracaso general obtenido en la primera localidad en cuanto a recibir respuesta de las aves a sus vocalizaciones pre-grabadas, a través de un trecho de muchos kilómetros, sugiere que su rareza es genuina aún en este lugar; no obstante, podría demostrar no ser tan rara en la Serra de Paranapiacaba (Sur del Estado de Sao Paulo), en el Parque Estadual Carlos Botelho, (Antunes et al, 2006:106) y en el Parque Estadual Intervales (Willis & Oniki, 2003:29, Aleixo & Galetti, 1997:245).
BRASIL:
Se conoce a la especie en São Paulo, Paraná, Santa Catarina y, aunque se considera como “probablemente extinguido “ en Rio Grande do Sul, en los últimos años se ha visto con regularidad en el Parque Forestal Estadual do Turvo, que linda con la provincia de Misiones, Argentina (Mähler 1995:177, Silva et al., 2005:109) Especie constatada en el pasado en: APA Federal das Ilhas e Várzeas do Rio Paraná, en municipios de Altônia, São Jorge do Patrocínio, Vila Alta, Icaraíma, Querência do Norte, Porto Rico, São Pedro do Paraná, Marilena, Nova Londrina, Diamante do Norte (Straube & Scherer-Neto, 2001: R-192) Parque Estadual Rio Guarani, municipios de Três Barras do Paraná (Pichorim, et al. 2000, en Santos, 2009:74) Parque Nacional do Iguaçu, 25º 04′-25º 41’S, 53º 38′-54º 28’W, Foz do Iguaçu, Santa Terezinha de Itaipu, São Miguel do Iguaçu, Matelândia, Santa Tereza do Oeste, Lindoeste, Santa Lucia, Capitão Leônidas Marques, Céu Azul, Serranópolis do Iguaçu (Collar et al. 1992: 692, Straube et al.,1996:203, Mähler, 1995:177, Parker & Goerck, 1997:529) Floresta Nacional de Irati, Irati e Fernandes Pinheiro (com. pess. G. Volpato) (BirdLife International, 2020)
Sao Paulo, registrado en Rio Feio, (21°26’S 50°59’O), 1901 (Pinto, 1938); Ribeirão Caingang (“Ribeirão dos Bugres”), (21° 40’S 51° 32’O), abril de 1901 (Pinto 1938); Vitoriana (“Victoria”), abril de 1902; montaña “Aracuahy”, cerca de Ipanema, abril, mayo, junio y diciembre en los años 1819-1822 (von Pelzeln 1868-1871); en la vía que conduce a Rio Carmo, Fazenda Intervales, 850 m, a 24°17’S 48°25’O, cerca de Capão Bonito, febrero de 1987 (Willis & Oniki, 1993:29); Iguapé, octubre de 1901 (Pinto, 1938), se presume que esta localidad corresponde a la especificada como Baurú por von Ihering y von Ihering (1907); Parque Estadual Carlos Botelho, 24º 06’ 55” – 24º 14’ 41” S 47º 47’ 18” – 48º 07’ 17” W, observado en el área del Núcleo São Miguel por el biólogo Carlos Yamashita, en noviembre de 1988 (Antunes et al, 2006:106) y en el Parque Estadual Intervales (Willis & Oniki, 2003:29, Aleixo & Galetti, 1997:245). El número de aves en Ilha do Cardoso, 25° 03’S 48° 53’W, parece ser muy pequeño pero estable (BirdLife International, 2020)
Paraná, los escasos registros existentes en el estado, sugieren que la actual densidad poblacional es bastante baja y que la especie es más vulnerable a los procesos de extinción dada la reducción continua de los ambientes naturales (Santos, 2009:69) Los registros provienen de: Jacarezinho, marzo y abril de 1901 (Pinto, 1938; espécimenes en MZUSP), que en la actualidad se denomina Ourinho; Porto Camargo, (Straube et al.,1996:203, Sick, 1997:515); Cândido de Abreu, noviembre de 1929 (espécimen en FMNH); Castro, junio de 1914 (Pinto, 1938); Parque Nacional Iguaçu en el sendero de Poço Preto, octubre de 1988, noviembre de 1988, mayo de 1989, y agosto y noviembre de 1990 (BirdLife International, 2020). Iguazú National Park, raro (Parker & Goerck, 1997:535). Scherer-Neto & Costa-Straube (1995), no lo registraron para el estado de Paraná, y solo consta en su Lista Anotada, como referencia bibliográfica y registro de museos. Pichorim et al., (2001), acumularon algunos registros de la región del Valle del Rio Guaraní, entre el Parque Estadual Rio Guarani e y el lago de la Usina Hidroeléctrica de Salto Caxias.
Santa Catarina, los registros provienen de: Canoinhas (“Ouro Verde”), a 26°10’S 50°24’O, Serra do Lucindo, 750 m, mayo de 1929 (espécimen en AMNH); Poço Preto, 750 m, abril de 1929 (espécimen en AMNH); Joinville, espécimen (en BMNH) recibido en enero de 1890; Trombudo Alto (posiblemente cerca de Trombudo Central); el río Trombudo es un afluente del Itajaí d’Oeste: (Kohler et al, 2009:105), (Sick, 1997:515). 2 espécimenes observados en Volta Velha (15 octubre 1998) (Naka et al., 2000:243); registrado un individuo en abril de 2006 en la Reserva Biológica Estadual do Sassafrás en Doutor Pedrinho, 26° 42′ 50″ S, 49° 28′ 58″ W (Rupp et al., 2007:94). En el Parque Nacional das Araucárias, 26°45′53″S 51°58′03″O, el autor solo registró 1 individuo (Rupp, 2010:113). Un macho fue fotografiado en agosto de 2007 en el municipio de Abelardo Luz, 26º35’S 52º24’O, en el oeste catarinense (Kohler et al, 2009:105) (BirdLife International, 2020)
Rio Grande do Sul, los registros provienen de: São Pedro (de Alcântara), en las lagunas costeras, octubre de 1928 (espécimen en AMNH); Poço das Antas (Gliesch 1930), presuntamente alrededor de 1920 (Belton, 1984:594); Taquara, agosto de 1883 (von Berlepsch y von Ihering, 1885). Se presume que la especie se halla extinta en el estado, pero un registro proveniente de dentro de Argentina (véase más adelante), (inmediatamente al norte, cruzando la frontera de la Reserva Bosque Turvo – sobre la cual véase Albuquerque, 1977-, y cerca de la frontera con Santa Catarina), indica que el ave podría posiblemente sobrevivir en el área (Belton, 1984:594) (BirdLife International, 2020)
PARAGUAY: Se ha registrado a la especie en un amplia área ubicada en el sector oriental del país.
Amambay, los espécímenes provienen de Cerro Amambay, cerca de Capitán Bado, agosto de 1938, y de 40 km al OSO de Cerro Amambay, octubre de 1938 (Storer, 1989:10).
Canindeyú, los registros provienen del norte de Curuguaty: 13,3 km, un espécimen en julio de 1979 (Storer, 1989:10); 10 km, observación realizada el 15 de septiembre de 1989. Existe otra probable observación que proviene de Estancia «La Fortuna», cerca de Mbaracayú (Maracaju), junio de 1991. Madroño & Esquível (1995:54) obtuvieron 22 registros a 2 km al este de Jejui’mi, en la Reserva Natural del Bosque de Mbaracayú (24°04′S 55°17′O) en el Dto. de Canindeyú. (BirdLife International, 2020)
Caaguazú, se recolectó a un espécimen en “Piccada de Aios” (= actualmente la localidad moderna Coronel Oviedo: Paynter, 1989) entre fines de junio y mediados de agosto de 1893 (Chébez, 2008:296, BirdLife International, 2020)
Alto Paraná, la especie ha sido registrada recientemente en el área de Itaipú, cerca de la represa, cerca de la Reserva Forestal de Itabo en junio de 1991. Se presume que el registro, sin fecha, de Puerto Bertoni, a 25°38’S 54°40’O (Bertoni, 1939), es aquel que Bertoni (1901) menciona haber tenido lugar a 25°43’S 54°40’O (BirdLife International, 2020).
Paraguarí, tres aves fueron colectadas en Sapucaí, a 25°40’S 56°55’O, en julio y agosto de 1904 (Chubb 1910; -especímenes en BMNH, MACN-, y Bertoni, 1901:191, en Storer, 1989:10); (BirdLife International, 2020). Observado en la Estancia Itabó, 25’27’S, 54’38’W, (Dto. Canindeyú) donde los autores lo consideran poco común en invierno y raro en verano (Lowen et al., 1995:61).
Itapúa, se colectó a un espécimen (en MNHN) en julio de 1948 en Puerto Edelira, que está situado en el río Paraná, al norte de Capitán Meza, ubicándose Capitán Meza, a 27°01’S 55°34’O (Paynter, 1989:7).
Parque Nacional San Rafael, 26°27′30″S 55°41′51″W, (Dtos Itapúa/Caazapá), donde se lo considera amenazado y endémico de la selva atlántica (Madroño et al., 1997:53, Chébez, 2008:296). Parque Nacional Cerro Corá, Reserva Natural Forestal Mbaracayú (Chébez, 2008:296)ARGENTINA: Todos los registros provienen de la provincia de Misiones. Existe un registro en bosque de galería en el extremo sur de Misiones, a solo 8 km de la frontera con la provincia de Corrientes (Bodrati, 2005:310), y la especie también puede encontrarse en el extremo noreste de Corrientes. Cabe destacar su presencia actual en zonas bastante modificadas e incluso en el límite sur de su distribución conocida donde subsiste a escasos kilómetros de importantes centros poblados, como Posadas o incluso en zonas periurbanos como en el caso de Puerto Rico, San Vicente y Arroyo Anselmo. No obstante parece requerir siempre de la proximidad de selva en buen estado de conservación que mantenga su estructura, aunque toleraría selvas que han sido sometidas a explotación selectiva, a juzgar por varias localidades donde se la encontró. Los registros cubren casi todas las porciones boscosas de Misiones con al menos 51 registros efectuados desde 1900 hasta 1995: 18 corresponden al Parque Nacional Iguazú, donde parece ampliamente distribuido y donde se ha documentado su nidificación, dos a Parques Provinciales (Cruce Caballero y Urugua-í), uno a una Reserva Natural Privada y 6 en áreas proyectadas por su interés bioecológico como futuras Reservas Naturales (Puerto Península, Puerto San Juan, Sierra Morena, Cuenca del Yabotí y Arroyo Piray- Miní) (Chébez, 1995:55)
Arroyo Yabotí-miní, 30 km al norte de su estuario, a 26°57’S 53°51’O, (Dto. San Pedro), cerca de la Reserva Turvo en Brasil, febrero de 1991 (Chebez, 1995:54); (Baldo, Giraudo & Abramson, 1991, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63); (Giraudo et al., 1993:3)
San Vicente, a 27°02’S, 54°33’W, (Dto de Guaraní) (Chebez, 1995:55 y Chébez, 2008:295); (Garello, 1988, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63)
Lanusse, (Colonia Gobernador Lanusse), 25 km al este, (Dto. Gral Belgrano), a 26°00’S 54°17’O, 1979 registro que probablemente es el mismo que mencionan Lucero & Alabarce (1980), en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63); (Olrog & Lemos, 1974, en Chébez, 1995: 55-56)
Puerto Rico, a 26°48’S-55°01’W, (Dto. Libertador General San Martín), 1988 (Chebez, 1995:55); (Castelino & Gutiérrez 1988, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63)
Colonia Victoria, cerca de Eldorado a , 26°24’S 54°38’O, agosto de 1969 (espécimen en LSUMZ); (Kovacs, 1969, en Chébez, 1995:55-56)
Arroyo Piray-miní, a 26°19’S-54°20’W, (Dto Eldorado), cerca de la confluencia del arroyo Coral (Chebez, 1995:56; (Krauczuk & Serret, 1991; en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63)
Tobunas, a 26°28’S 53°54’O, (Dto. San Pedro) octubre de 1953 y julio de 1959 (siete especímenes en FMNH, LACM, MACN); (Kovacs, en Chébez, 1995:55-56); (Partridge, en Chébez, 1995:55-56) y (Pergolani de Costa, 1962)
Dos de Mayo, a 27°02’S 54°39’O (Dto. Cainguás), 1979 Olrog, en los límites de Dtos Guaraní y San Pedro (Olrog, 1979, en Chébez, 1995:55-56); Otro ejemplar obtenido en 1968 por Maletti (MCNFA) (Maletti, 1968, en Ordano & Bosisio, 1997:51).
San Ignacio, a 27°15’S-55°20’W (Dto. San Ignacio) enero de 1942 (da Fonseca, 1942:273); Ejemplar capturado (MACN)
Arroyo Anselmo, 27º 27′ 15,26»S 55º 43′ 26,47»O (Dto. Candelaria), al sur de San Ignacio, 1988 (Moschione, 1988; en Chébez, 1995:55-56); (Chébez & Casañas, 2000:63)
Puerto San Juan, a 27°25’S-55°43’W, (Dto. Candelaria), 1991 (Chebez, 1995:56); (Chébez, 2008:295); (Contreras, 1991:34); (Krauczuk, 1992, en Chébez, 1995:55-56); (Chébez & Casañas, 2000:63); (Giraudo et al., 1993:3)
Campo San Juan, a 27°24’S-55°37’W, (Dto. Candelaria), cerca de San Ignacio, enero de 1992 (BirdLife International, 1992)
Bonpland, (= Bonplano), a 27°29’S 55°29’O, (Dto. Candelaria), 1915 (Chébez, 1995:55). Este último registro, corresponde a aquel observado por Olrog (Obs. Pers. De Olrog, 1970, en Belton, 1984:594) como proveniente del norte de la Reserva Forestal Turvo de Rio Grande do Sul, parece provenir de Dos de Mayo, habiendo Chebez indicado que el área en cuestión se situaba en el sitio donde se juntan los departamentos de Guaraní y San Pedro; pero, como se indica anteriormente, el registro reciente proveniente del arroyo Yabotí-miní se encontraba igualmente muy cerca de Turvo (BirdLife Iternational, 1992)
Parque Provincial Cruce Caballero, a 26º 31’S 54º 00’O, (Dto. San Pedro); (Bodrati et al, 2010:46), donde es frecuente a escaso de ver (en diferentes tipos de bosques -en buen estado y degradado), residente y posible nidificante; En bosque secundario de plantaciones de araucaria y primario de laurel y guatambú (Bodrati & Cockle, 2006:249); (Cockle, 2010, Lammertink & Klavins, 2012, Castelino, 1989, todos en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63).
Parque Provincial Moconá, a 27°09’S, 53°54’W, (Dto. San Pedro); En bosque secundario de plantaciones de araucaria, primario de laurel y guatambú (Bodrati & Cockle, 2006:249); (Krauczuk, 1998 & Pearman, in litt., en Chébez & Casañas, 2000:63); (Bodrati et al, 2010:46); (Olivera, 2015:169)
Barra Concepción, a 28º 05’S 55º 32’O, (Dto. Concepción), a lo largo del Rio Uruguay, en selva ribereña (Bodrati y Cockle 2006:249); (Bodrati, 2005:310)
Iguazú, a 26°01′14″S 54°36′55″O, (Dto. Iguazú), 1900 donde Dabbene captura un ejemplar, por primera vez para Argentina (MACN) (Dabbene, 1910, Finch, 1990, en Chébez, 1995:55-56)
Cruce acceso Cataratas-Aeropuerto, a 25º42’43.75»S 54º27’40.40»O , (Dto Iguazú), julio de 1920, (Giraudo et al., 1993:3)
Puerto Aguirre (actual Pto Iguazú), a 25°36′39″S 54°34′49″O, (Dto. Iguazú), julio de 1920 espécimen depositado en MCZ, (Peters, 1920, en Chébez, 1995:55-56); (BirdLife International, 1992)
Posada y Reserva Puerto Bemberg, a 25 º55’S, 54º37’O (Dto. Iguazú), en selva nativa de la costa del Rio Paraná (Bodrati et al., 2012:68)
Arroyo Urugua-í, a 25°54’S 54°36’O, (Dto Iguazú), 1958, en km 10 un ejemplar, depositado en AMNH (Partridge, 1958, en Chébez, 1995:55-56), (Chébez, 2008:295) y (Chébez & Casañas, 2000:63). En km 30. 1954 y 1957 (AMNH y MACN) (BirdLife International, 1992)
Sierra Morena, a 26°03′26″S 54°14′11″O, (Dtos: Sur de Iguazú, Oeste de Gral M. Belgrano y extremo nororiental de Eldorado) (Chébez, Heinonen, Krauczuk & Maletti, 1988, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63); (BirdLife International, 1992)
Parque Nacional Iguazú, a 25°41’S- 54°26’W, (Dto. Iguazú), en 1989 registrado en dos ocasiones en el mes de febrero (Blendinger, 1998:6); “Iguazú”, octubre de 1900 (espécimen en MACN); Posiblemente en los alrededores del Parque, se observó a inmaduros en el sendero a Bernabé Méndez, en mayo de 1989 (Pearman, 1989, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63); a una hembra, a 500 m del sitio destinado al guardabosques, denominado “El Timbó”, también cerca del sendero a Bernabé Méndez, julio de 1991 (Pearman, 1991, en Chébez, 1995:55-56), (Chébez & Casañas, 2000:63), (Finch, 1990, Giorgis, 1991, en Chébez, 1995:55-56). Recopilados 14 registros adicionales que provienen de 1900, 1985, 1988, 1990, y 1991 (Chebez, 1995:54); Citado para el Parque, en general, por: (Chébez, 2008:295);(Cano, 1988, en Chébez, 1995:55-56); (Castelino, J. Herrera obs, pers, en Chébez & Casañas, 2000:63); (BirdLife International, 1992); (Narosky & Chébez, 2002:71); (Saibene et al, 1996:38);
Observado y fotografiado anidando en antiguo camping “Arroyo Ñandú” (Johnson, Casañas & Adamovsky, 1985, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63);(Saibene & Castelino 1985, en Chébez, 1995:55-56); A 8 km de las cataratas (Laesse, 1988, en Chébez, 1995:55-56); en los Senderos Yacaratiá (Saibene, 1988, Castelino, 1990, Piacci, 1991, Mazar Barnett, 1994, en Chébez, 1995:55-56) y Macuco (Giorgis, 1991, en Chébez, 1995:55-56); Apepú, a 25°38’S-54°21’W (J. Herrera y Bolgheroni com. Pers., en Chébez & Casañas, 2000:63); Palmital (ruta 101) (Saibene, 1991, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63); y en el Parque frente a las instalaciones del ejército (Castelino, 1991, en Chébez, 1995:55-56)Parque Provincial Puerto Península, a 25°40’S-54°38’W, (Dto Iguazú) (Barnett, L.Lanús & Rodriguez Goñi, 1994, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63)
Parque Provincial Uruguá-í, a 25°52’S-54°11’W / 26°00’S-54°04’W, (Dto Iguazú) (López-Lanús, 1995, Rolón & Chébez, 1998, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63); (De la Peña & Salvador, 2016:100-101)
Eldorado, a 26°24’S-54°38’W, (Dto. Eldorado), 1925, ejemplar capturado por Mogensen. (Mogensen, 1930, en Chébez, 1995:55-56); (BirdLifeInternational, 1992)
Alrededores de Almirante Brown, (actual Comandante Andresito), 25°40′13″S 54°02′34″O, (Dto. Gral Belgrano) (Bruera & Chávez, 1989, en Chébez, 1995:55-56), (Chébez & Casañas, 2000:63) y (Chébez, 2008:295); (BirdLife International, 1992)
Arroyo El Niño, 26° 28′ 0.12»O 54° 22′ 0.12», (Dto. Eldorado), en Santiago de Liniers, Propiedad «El Lapacho SA»; (Krauczuk, 1993, en Chébez & Casañas, 2000:63)
Ruinas de Santa María, 27°56′04″S 55°24′25″O, (Dto Concepción); (Giraudo et al., 1993:3)
Reserva Natural Forestal Guaraní (UNAM), 27°00′S 54°13′O, (Dto. Guaraní) (Krauczuk & Balatorre, 1993, en Chébez, 1995:55-56); (Chébez & Casañas, 2000:63); (Chébez, 2008:296)
Refugio Natural Privado Caá-Porá, 25º52′ S 54º03′ O, (Dto. Gral Belgrano), en el límite del Parque Provincial Urugua-í y 2 km SO Deseado; (López Lanús, 1995, en Chébez, 1995:55-56) y (Chébez & Casañas, 2000:63)
Parque Provincial Salto Encantado del Valle de Cuñá Pirú, a 27°28’S-54°40’W, (Dto. Cainguás); (Barnett in litt. y Rolón & Chébez, 1998, en Chébez & Casañas, 2000:63)
Departamentos de: Iguazú, Gral Belgrano, Eldorado, Cainguás, San Pedro, Libert. Gral San Martín, San Ignacio, Candelaria, Guaraní y Concepción (Chébez, 1996:139); (Chébez, 2008:294)
Iguazú, a 26°01′14″S 54°36′55″O, (Dto. Iguazú), 1900 donde Dabbene captura un ejemplar, por primera vez para Argentina (MACN) (Dabbene, 1910, Finch, 1990, en Chébez, 1995:55-56)
Municipios de: Corpus Christi, parte SO del municipio de Santo Pipó y parte NO del municipio de Gobernador Roca, 27º 07’ 56.15” -55º 28’1.97”O, (Dto. San Ignacio), en selva mixta de laurel y guatambú (Krauczuk, 2008:33)
Parque Provincial de la Araucaria, a 26°37′40″S 54°06′01″O, (Dto. San Pedro); (Birdlife International, 1992); (Chebez, 1995:54 y Chébez, 2008:295); (Krauczuk & Baldo, 2004:6)
Reserva Natural Estricta San Antonio, a 26°08′00″S 53°43′00″O, (Dto Gral Belgrano);(Chébez, 2008:296)
Parque Provincial Esmeralda, a 26°50′00″S 54°02′00″O, (Dto. San Pedro); (Chébez, 2008:296)
Parque Provincial Guardaparque Horacio Foerster, a 25°51′44″S 53°54′11″O, (Dto. Gral Belgrano); (Chébez, 2008:296)
Parque Provincial Puerto Península “Luis H. Rolón”, 25°43′00″S 54°35′00″O, (Dto. Iguazú); (Chébez, 2008:296)
Parque Provincial Uruzú, a 25°50′00″S 54°08′00″O, (Dto. Iguazú); (Chébez, 2008:296)
Parque Provincial El Piñalito, a 26°23’S-53°49’W, (Dto. San Pedro); (Chébez, 2008:296)
Reserva Privada Yaguarondí, a 26°41′16″S 54°15′54″O, (Dto. Guaraní); (Chébez, 2008:296)
Reserva Biosfera Yabotí, a 26°59’36″S 53°59’4″W, (Dto. Guaraní); (Chébez, 2008:296)
HABITAT
Desde el nivel del mar hasta los 1.000 msnm; en bosque maduro, selva degradada, bosque secundario, plantaciones no-nativas (Pinus sp.) y nativas (Pinos Paraná- Araucaria angustifolia-) (Bodrati & Cockle, 2006:249); (Lammertink et al. 2011:47); (Krauczuk y Baldo 2004:6); en valles y zonas montañosas (Sick, 1997:515)
Muchos de los registros recientes provenientes de Argentina corresponden a áreas muy modificadas, tres de ellas aledañas a poblados, pero la especie parece necesitar todavía parches de bosque primario o, por lo menos, bosque talado que todavía retenga algunas de las características de éste (Chebez, 1995:55, BirdLife International, 1992)
Estrato medio, prefiriendo remanentes en buen estado de conservación; también en parches muy pequeños de bosques y zonas antroponizadas (Chébez, 2008:294)
El uso que hace del dosel medio parece separar a la especie del Dryocopus lineatus y del Campephilus robustus, especies que tienden a frecuentar sitios más altos (Chebez, 1995:55).
En el sur de la provincia de Misiones, Argentina, así como en las partes sur y oeste de su área de distribución en Paraguay, el pájaro Carpintero Cara Canela se encuentra en corredores ribereños estrechos y en paisajes de mosaicos naturales donde pequeños bosques o corredores de la Mata Atlántica se fusionan con sabanas de pastos o Cerrado. En el noreste de Paraguay se encuentra en corredores naturales y dedos de bosque atlántico alto que bordea el cerrado. La presencia en estos fragmentos de bosque natural puede preadaptar al pájaro Carpintero Cara Canela, hasta cierto punto, para hacer frente a la fragmentación antropogénica del bosque. Sin embargo, los avistamientos en tales sitios son eventos raros o infrecuentes, y generalmente ocurren en las cercanías de grandes extensiones de bosque nativo (Lammertink et al. 2011:47)
Ecorregiones: Selva Paranaense -
Carpintero Cara Canela | Comportamiento
Es uno de los carpinteros neotropicales más raros y difíciles de visualizar. Generalmente solo o en pareja. Aparentemente viven en territorios establecidos, ya que regresan a los mismos refugios, llaman y tamborilean en los mismos lugares en días diferentes y, a veces, responden agresivamente a la reproducción buscando la hembra a corta distancia con la cresta ensanchada y mediante llamadas. En los bosques primarios, los territorios parecen ocupados continuamente durante muchos años, pero en los bosques jóvenes o fragmentados la ocupación es menos constante (Lammertink et al, 2020)
VOCALIZACIONESEs más silencioso que otras especies de pájaros carpinteros del Bosque Atlántico y emite su llamada y tamborileo, durante unos pocos minutos al amanecer, permaneciendo en silencio durante gran parte o todo el día. Se lo escucha con relativa frecuencia en otoño, invierno y principios de la primavera, pero a menudo no se escucha durante semanas a finales de primavera y verano. Su llamada territorial puede oírse hasta unos 500 m a lo lejos, pero en general permanece en silencio la mayoría del tiempo (Lammertink et al, 2020)
Su llamada territorial consiste en una serie de sonidos estridentes, y bastante prolongado, de 3 á 12 notas, “quiir” (Brooks et al. 1993:38).
Canto: un triste, descendente “tu-u-u-u-u”, con una variante “qui-du-du-du” probablemente para contactar con su pareja
Sonidos no vocales: Los picotazos de forrajeo y los martillazos son suaves y rara vez se escuchan. De patrón uniforme y cortos de duración.
En vuelo, los aleteos de las alas del pájaro Carpintero Cara Canela son notablemente audibles, quizás más durante los conflictos territoriales o al responder a la reproducción (Brooks et al. 1993:38).
ALIMENTACIÓNPoco conocida; generalmente se alimenta solo o en pareja.
Busca larvas en los árboles a 14-15 m de altura. Existen evidencias de que se alimentan también del néctar de las flores y, como varios otros Celeus, ocasionalmente come frutos pequeños.
Aparentemente localiza la presa (presumiblemente utilizando las diferencias en la resonancia detectadas por estimulación táctil) y se lo observa escalando, picoteando en las fisuras de la corteza, los agujeros naturales y debajo de las escamas de la corteza. Hace algo de martilleo y descamación de la corteza, pero raras veces persiste, y no excava grandes agujeros de alimentación (Brooks et al. 1993:41)
Generalmente busca alimento en el estrato medio, aunque puede trabajar desde tan solo 1 m como en las ramas más altas de los árboles altos. En el estudio más detallado de su ecología de alimentación, con una muestra de 24 observaciones, su altura promedio de alimentación fue de 9 m. El Dryocopus lineatus, en la misma área, se alimentaba al nivel de la copa de los árboles a una altura media de 17 m (48 observaciones), y el Campephilus robustus lo hacía a una altura media de 10 m (37 observaciones) (Brooks et al. 1993: 39). Aunque el Campephilus robustus se superpone en la altura de forrajeo con el pájaro Carpintero Cara Canela, al tener un pico mucho más grande y con su postura de patas abiertas en los árboles, es capaz de escalar y excavar la corteza de manera más potente.REPRODUCCIÓNLos Carpintero cara canela excavan sus nidos en ramas o troncos recientemente muertos, sin embargo, es la única especie conocida que para pernoctar no usa huecos excavados, sino que utiliza exclusivamente huecos naturales creados por largos procesos de degradación en árboles viejos, que ya han alcanzado un diámetro importante.
Cada individuo adulto posee una cavidad-dormidero individual, es decir, las parejas no pernoctan en la misma cavidad como ocurre en otras especies. Durante la anidación es el macho el que se queda en el nido durante la noche mientras que la hembra va a descansar a su cavidad natural.
Otra característica distintiva de esta especie sucede después de anidar. Generalmente una pareja de cría dos pichones, luego, cada progenitor lleva a una cría a su cavidad dormidero individual, donde pernoctarán juntos por hasta 67 noches. Es decir, no solo necesitan cavidades dormidero formadas por descomposición en árboles maduros, sino que además, las cavidades deben tener suficiente espacio interior sobre la entrada para el padre y su pichón (Lammertink et al., 2019:7)
La suma de estas características hace que encontrar una cavidad natural adecuada posiblemente sea mucho más complicado que encontrar una rama muerta donde poder excavar un nido.
Los sitios de descanso rara vez se han considerado un recurso crítico para la conservación de los pájaros carpinteros porque casi todas las especies de pájaros carpinteros pernoctan durante todo el año en cavidades excavadas similares a sus sitios de anidación.
Así, una posible excepción es el “cara canela” de la Selva Atlántica de América del Sur.
Las cavidades que los pájaros carpinteros usan también tienen una gran demanda por parte de otros animales de la selva, y los investigadores encontraron otras ocho especies de aves y al menos dos especies de insectos sociales que usan estas cavidades. Muchas veces los pájaros carpinteros lucharon para defender sus cavidades y a veces las perdieron ante otras especies.
Para los autores del trabajo, estas cavidades de descanso son un recurso limitado de alta calidad, y un recurso crítico no solo para esta especie sino también para un amplio conjunto de especies que habitan la selva (Lammertink et al, 2019:8)
En el estudio constataron que los carpinteros “cara canela” viajaron por distancias superiores a un kilómetro entre nidos y dormideros, lo que supone una distancia importante para esta especie, y reutilizaron cavidades de dormidero durante varios años (a veces cambiando de propietario). Las largas distancias recorridas entre nidos y dormideros, el uso continuo de una cavidad dormidero durante varios años (y a veces por diferentes individuos), la alta ocupación de estas cavidades por otros animales y las interacciones agresivas para defender estas las cavidades constituyen evidencia de que las cavidades adecuadas son un recurso escaso en la selva.
Se han encontrado nidos desde septiembre hasta finales de noviembre. En árboles muertos o partes muertas de árboles. Las especies utilizadas Nectandra lanceolata (Laurel amarillo) y Nectandra angustifolia (Laurel del rio) (Lammertink & Klavins, 2012:459) (Lammertink et al., 2019:4)
Short (1982:409) comenta que la muda es entre abril y julio, (no se describen detalles), pero deduce que la temporada de reproducción tendría lugar entre noviembre y febrero. De hecho, el único registro confirmado sobre la reproducción del ave se deriva de fines de septiembre a principios de octubre de 1985, cuando se encontró un nido a una altura de 2,3 m (presuntamente; “2.30 cm” en el original), en un árbol no identificado situado en el sitio para acampar ubicado en el arroyo Ñandú en el Parque Nacional Iguazú (Chebez, 1986) y en el Parque Provincial Cruce Caballero en noviembre 2011 (Lammertink & Klavins, 2012) (Lammertink et al, 2019:6)
Las cavidades que los pájaros carpinteros usan también tienen una gran demanda por parte de otros animales de la selva, y los investigadores encontraron otras ocho especies de aves y al menos dos especies de insectos sociales que usan estas cavidades. Muchas veces los pájaros carpinteros lucharon para defender sus cavidades y a veces las perdieron ante otras especies (Lammertink et al., 2019:6-7)
Se desconoce la duración del ciclo reproductivo. No existen descripciones de los huevos.
No se conocen otros detalles. -
Carpintero Cara Canela | Descripción
Presentan dimorfismo sexual
Es más grande que la mayoría del género Celeus (Lammertink et al. 2020).
Copete rojo, largo y redondeado. Las plumas de la corona tienen la base color beige-canela y raquis negro.
Frente, loral y cubiertas auriculares canela con barras negras muy finas.
Los machos tienen área malar roja con la base las plumas canela con finas barras negras, que se extiende hasta debajo de los ojos, lateral de la garganta y alrededor y detrás de las cubiertas auriculares conectando con el copete a lo largo de los lados del cuello.
Las hembras no tienen banda malar roja siendo los laterales de la cabeza y la región malar de color canela con finas barras negras. Tienen el pico ligeramente más pequeño y alas y cola más largas.
Las fosas nasales no están cubiertas por el emplumado de los mechones nasales.
Ojos marrones con zona periocular moderadamente ancha, desnuda color gris-azulada.
Pico moderadamente largo (parece corto en relación con la gran cresta), curvado a lo largo del culmen y relativamente angosto en la base. Es principalmente de color marfil con una base gris a gris azulada.
Tienen el cuello negro con una banda blanca o teñida de canela que va desde la parte de atrás de las cubiertas auriculares hacia los lados del pecho. La parte inferior de la garganta, negra.
La parte superior de la espalda es negra o marrón-negruzca tornándose más claras a medida que descienden hacia la zona inferior de la espalda. Algunas veces tienen unas pocas plumas barradas canela y negras a mitad de la espalda.
En zona superior del pecho plumas negras con puntos canela
Las cubiertas de la cola son color beige, muy largas y contrastan con las plumas totalmente negras del resto de la cola.
Las alas son negras amarronadas con bases canela en el interior de las remeras primarias. Zona ventral beige, barrada en negro.
Piernas y pies grises oscuros.
(Narosky & Chébez, 2002:224)
© Nick Athanas. Helmeted Woodpecker (Celeus galeatus) Macho. Intervales State Park, São Paulo, Brazil. Octubre 2016. Algunos derechos reservados 
© Hector Bottai. Carpintero cara canela . Hembra. Parque Estadual Intervales – SP – Brasil. Septiembre 2013. Algunos derechos reservados -
Carpintero Cara Canela | Taxonomía
Monotípico
Nota taxonómica:
Basándose en los patrones de plumaje, la forma del pico (curvado) y las fosas nasales expuestas, Short, (1982:410) consideró, que el Carpintero cara canela era un intermedio entre los géneros Celeus y Dryocopus. Collar et al, (1992) también comentan que la manera de alimentarse y pattern de tamborileo es similar al Celeus. (en BirdLife, 1992:696)
Recientes estudios filogenéticos (Benz et al, 2015:949), demuestran que los géneros Celeus y Dryocopus pertenecen al mismo clado o tribu dentro de los Picidae, pero estas filogenias también muestran que Celeus y Dryocopus no son grupos hermanos sino que, Celeus es hermano de clado de Colaptes/Piculus (Webb y Moore 2005, Benz et al. 2006, Fuchs et al. 2007). El análisis filogenético de los datos de la secuencia de ADN reveló además que C. galeatus está incrustado dentro de Celeus (Benz et al. 2015, Lammertink et al. 2016); de ahí las similitudes entre C. galeatus y Dryocopus probablemente resulten de la convergencia más que de la afinidad filogenética.
Teniendo en cuenta, tanto estos hallazgos como las diferencias morfológicas citadas por Short, (1982:410) y las vocalizaciones diferentes (C. galeatus tiene vocalizaciones y tamborileo similares al C. torquatus y C. flavus, los autores concluyen, inequívocamente, que el D. galeatus se debe reclasificar como Celeus galeatus (Benz et al, 2015:949)
La propuesta # 689 elevada al SACC (South American Classification Committee) fué aceptada para transferir al Carpintero Cara Canela de Dryocopus a Celeus en noviembre de 2015. -
Carpintero Cara Canela (Celeus galeatus)

Monographie des picidées. Malherbe, A. -1861- Ilustración XI (Dryocopus galeatus) Especie muy rara, clasificada como “vulnerable” (BirdLife International, 2020), confinada a una pequeña zona en el sur de Brasil, este de Paraguay y el extremo noreste de Argentina (Chébez, 2008:295)
NOMBRES COMUNES: Carpintero cara canela (Argentina y Paraguay); Carpintero listado de cara canela (Argentina); Ypekû akâ mirâ (Guaraní); Picamaderos Caricanelo, Pito negro de cara canela;Pica-Pau de Crista Vermelha, pica-pau-de-cara-amarela, Pica-pau-de-cara-canela(Brasil)
EN OTROS IDIOMAS
BREVES APUNTES HISTÓRICOS
- Nouveau recueil de planches coloriées d’oiseaux: pour servir de suite et de complément aux planches enluminées de Buffon, édition in-folio et in-4⁰ de l’Imprimerie royale, 1770. Temminck, C.J., Buffon, G.L.L., Huet, N.A. Strasbourgh; Chez Legras Imbert et Comp.,1838. Vol IV: 27-28 (Pic casqué – Picus galeatus); Lámina
- Die vollständigste Naturgeschichte der Vögel. Reichenbach, H.G. Dresden :Expedition der Vollständigsten Naturgeschichte,1836-[1862]; Abt.3: Bd.6 (Atlas 6 pt.5-1836); Lámina DCL: 4337
- The Genera of Birds: comprising their generic characters, a notice of the habits of each genus, and an extensive list of species referred to their several genera. Gray, G.R., Mitchel, D.W. London: Longman, Brown, Green, and Longmans,1844-1849. Vol II: 436 (Dryocopus galeatus)
- Monographie des picidées, ou Histoire naturelle des picidés, picumninés, yuncinés ou torcols; comprenant dans la première partie, l’origine mythologique, les mœurs, les migrations, l’anatomie, la physiologie, la répartition géographique, les divers systèmes de classification de ces oiseaux grimpeurs zygodactyles, ainsi qu’un dictionnaire alphabétique des auteurs et des ouvrages cités par abréviation; dans la deuxième partie, la synonymie, la description en latin et en français, l’histoire de chaque espèce, ainsi qu’un dictionnaire alphabétique et synonymique latin de toutes les espèces. Malherbe, Alfred. Metz,Typ. de J. Verronnais,1861-62. Tomo 1: 38; Tomo 3: Ilustración: XI (Fig.1,2,3 y 4) (Dryocopus galeatus)
- Catalogue of the birds in the British Museum. British Museum (Natural History). Department of Zoology. London, 1874-98. Vol 18 : 513-514
-
Carpintero Copete Amarillo | Bibliografía
- Administración de Parques Nacionales. Sistema de Información de Biodiversidad. Argentina. (s.f.) Ficha: Celeus flavescens. Recuperado de https://sib.gob.ar/especies/celeus-flavescens? El 12/10/2020.
- Aleixo, A. & Galetti, M. (1997). The conservation of the avifauna in a lowland Atlantic forest in south-east Brazil. Bird Conservation International. 7(3): 235–261. (enlace)
- Anjos, L. & Schuchmann, K.L. (1997). Afinidades biogeográficas de la avifauna de la cuenca del río Tibagi, sistema de drenaje de Paraná, sur de Brasil. Ecotropica 3 (1): 43–65. (enlace)
- Anjos, L., Schuchmann, K.L. & Berndt, R. (1997). Avifaunal composition, species richness, and status in the Tibagi River Basin, Paraná state, southern Brazil. Orn. Neotropical. 8(2): 145–173. (enlace)
- Anjos, L. (2001). Bird communities in five Atlantic forest fragments in southern Brazil. Orn. Neotropical. 12(1): 11–27. (enlace)
- Barnett, J.M. & Pearman, M. (2001). Lista Comentada de las Aves Argentinas (1º Ed.). Lynx Edicions: 52
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178(4):369–636. (enlace)
- Bencke, GA & Kindel, A. (1999). Conteo de aves a lo largo de un gradiente altitudinal del bosque atlántico en el noreste de Rio Grande do Sul, Brasil. Ararajuba. 7 (2): 91-107. (enlace)
- Benz, B.W. & Robbins, M.B. (2011). Molecular phylogenetics, vocalizations, and species limits in Celeus woodpeckers (Aves: Picidae). Mol. Phyl. & Evol.. 61(1): 29–44.
- BirdLife International (2020) Species factsheet: Celeus flavescens. Downloaded from http://www.birdlife.org on 12/10/2020. Recommended citation for factsheets for more than one species: BirdLife International (2020) IUCN Red List for birds. Downloaded from http://www.birdlife.org on 12/10/2020.
- Bodrati, A., J. I. Areta y E. White. (2012). La avifauna de la Posada y Reserva Puerto Bemberg, Misiones, Argentina. Nuestras Aves 57: 63-80. (enlace)
- Brooks, T.M., Barnes, R., Bartrina, L., Butchart, S.H.M., Clay, R.P., Esquivel, E.Z., Etcheverry, N.I., Lowen, J.C. & Vincent, J. (1993). Levantamientos y Conservación de Aves en el Bosque Atlántico paraguayo: Informe Final del Proyecto CANOPY ’92. Informe del estudio BirdLife 57. BirdLife International, Cambridge. (enlace)
- Buzzetti, D.R.C. (2000). Distribução altitudinal de aves em Angra dos Reis e Parati, sul do Estado do Rio de Janeiro, Brasil. Pp. 131–148 in: Alves et al. (2000).
- de la Peña, M.R. (1994). Guía de Aves Argentinas. Vol. 3. (2º Ed.). Columbiformes a Piciformes. L.O.L.A. Literature of Latin America, Buenos Aires.
- Cebolla Badie, M. (2000). El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación. Suplemento Antropológico, XXXV(2), 9-188. (enlace)
- Chébez, J.C. (1996). Fauna Misionera, Catálogo Sistemático y Zoogeográfico de los vertebrados de la Provincia de Misiones (Argentina) (1º Ed.). Editorial L.O.L.A. (Literature of Latin American):139
- De la Peña, M.R. (1999). Aves Argentinas. Lista y Distribución (1º Ed.). L.O.L.A. (Literature of Latin America); 109 (510)
- De la Peña M.R. (2015). Aves Argentinas. EUDEBA, UNL; Vol 1: 390
- De la Peña M.R., & Salvador S. (2016). Aves Argentinas: Descripción, comportamiento, Reproducción y Distribución. Trogonidae a Furnariidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), 20(2), 99. (enlace)
- del Hoyo, J. (2020) All the Birds of the World. Lynx Edicions, Barcelona; 342
- EcoRegistros (2020). Carpintero Copete Amarillo (Celus flavescens, Gmelin 1788); Recuperado de http://www.ecoregistros.org/ficha/Celeus-flavescens el 12/10/2020.
- Enciclopedia Británica (1998). Vol 15; Macropedia: Birds: 1-108
- Figueiredo, L.F.A. & Lo, V.K. (2000). Lista das aves do município de São Paulo. Bol. CEO. 14: 15–35. (enlace)
- Goerck, J.M. (1999). Distribution of birds along an elevational gradient in the Atlantic forest of Brazil: implications for the conservation of endemic and endangered species. Bird Conservation International. 9(3): 235–253. (enlace)
- Hayes, F.E. (1995) Status, distribution and biogeography of the birds of Paraguay. Monographs in Field Ornithology 1. American Birding Association, Colorado Springs, Colorado. (enlace)
- Leite, G.A. & D.G. Marcelino (2010) Dados sobre a nidificação de Celeus flavescens (Piciformes: Picidae) no município de Pium, Tocantins. Atualidades Ornitológicas, 153: 18-19. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Ficha: Carpintero Amarillento (Celeus flavescens, Gmelin 1788); Recuperado de https://avibase.bsc-eoc.org/species.jsp?avibaseid=CF5A6539C0F86006 el 12/10/2020.
- MAyDS y AA (Ministerio de Ambiente y Desarrollo Sustentable y Aves Argentina) (2017). Categorización de las Aves de la Argentina (2015). Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas, edición electrónica. C. A. Buenos Aires, Argentina. (enlace)
- Madroño, A., Clay, R.P., Robbins, M.B., Rice, N.H., Faucett, R.C. & Lowen, J.C. (1997). An avifaunal survey of the vanishing interior Atlantic forest of San Rafael National Park, Departments Itapúa/Caazapá, Paraguay. Cotinga. 7: 45–53. (enlace)
- Madroño, A., Robbins, M.B. and Zyskowski, K. (1997a). Contribución al conocimiento ornitológico del Bosque Atlántico Interior del Paraguay: Parque Nacional Caaguazú, Caazapá. Cotinga. 7: 54–60. (enlace)
- Mickich, S.B. (2002). Consumo de Frutos por Quatro Espécies de Pica-Pau (Picidae: Aves) em Remanescentes da Floresta Estacional Semidecidual do Sul do Brasil. Arquivos de Ciências Veterinárias e Zoologia da UNIPAR, 5(2). (enlace)
- Narosky, T., & Chébez, J.C. (2002). Guía para la Identificación de las Aves de Iguazú. (1º Ed.). Vazquez Mazzini Editores; 69 (112)
- Narosky, T., & Yzurieta, D. (2010). Aves de Argentina y Uruguay. Guía de identificación (16.a Ed.). Vázquez Mazzini Editores; 216 (479)
- Pacheco, J.F. & Parrini, R. (2000). Aves do Estado do Rio de Janeiro: região meridional do vale do rio Paraíba do Sul – retificação de limites e complementação dos registros inéditos mais antigos. Atualidades Orn.. 95: 12-13. (enlace)
- Parker, T.A. & Goerck, J.M. (1997). The importance of national parks and biological reserves to bird conservation in the Atlantic Forest region of Brazil. Pp. 527–541 in: Remsen (1997). (enlace)
- Partridge, W.H. (1954). Estudio preliminar sobre una colección de aves de Misiones. Rev. Mus. Arg. Cs. Nat. Zool. 3: 85-153.
- Rocca MA , Sazima M & Sazima I. (2006) Woody woodpecker enjoys soft drinks: the blond-crested woodpecker seeks nectar and pollinates canopy plants in south-eastern Brazil. Biota Neotropica Vol6 (Nº2) (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Carpintero amarillento (Celeus flavescens, Gmelin 1788); Recuperado de https://www.xeno-canto.org/species/Celeus-flavescens el 12/10/2020.
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J., & Calo, J. (1996). Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina (1º Ed.). L.O.L.A. (Literature of Latin America); 38
- Short, L.L. (1975:250) A zoogeographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History 154: 165–352. (enlace)
- Short, L.L. (1972). Relationships among the four species of superspecies Celeus elegans (Aves, Picidae). Amer. Mus. Novit.. 2487: 1-26. (enlace)
- Short, L.L. (1982) Woodpeckers of the world. Delaware Museum of Natural History, Greenville, Delaware. (enlace)
- Sick, H. (1997). Ornitologia brasileira. Editorial Nova Fronteira, Rio de Janeiro; 514
- Silveira, L.F. (1998). The birds of Serra da Canastra National Park and adjacent areas, Minas Gerais, Brazil. Cotinga, 10: 55–63. (enlace)
- Soares, E.S. & dos Anjos, L. (1999). Efeito da fragmentação florestal sobre aves escaladoras de tronco e galho na região de Londrina, norte do estado do Paraná, Brasil. Orn. Neotropical. 10(1): 61–68. (enlace)
- Stager, K.E. (1961). The Machris Brazilian expedition. Ornithology: Non-Passerines. Contrib. Sci. Los Angeles Co. Mus.. 41: 1–27. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A. & Moskovits, D.K. (1996). Neotropical Birds, Ecology and Conservation. University of Chicago Press, Chicago & London; 198.
- Straneck, R. (1990) Canto de las aves de Misiones I. (1º Ed.). L.O.L.A. (Literature of Latin America); (20)
- Winkler, H. and D. A. Christie (2020). Blond-crested Woodpecker (Celeus flavescens), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, SA. https://doi.org/10.2173/bow.blcwoo4.01
-
Carpintero Copete Amarillo | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOREs una especie poco conocida. El tamaño de su población global no ha sido cuantificado, pero se cree que su número está disminuyendo como resultado de la destrucción y fragmentación continua de su hábitat natural. Se describe como “Bastante común” (Stotz et al., 1996:198)
Son útiles para la conservación de la naturaleza pues se alimentan de insectos nocivos para la madera. Son sensibles a los insecticidas, por lo que su presencia puede servir como indicador de área verde intacta.
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable ).López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1 ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas ).Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable ).Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza ).Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Carpintero Copete Amarillo | Distribución
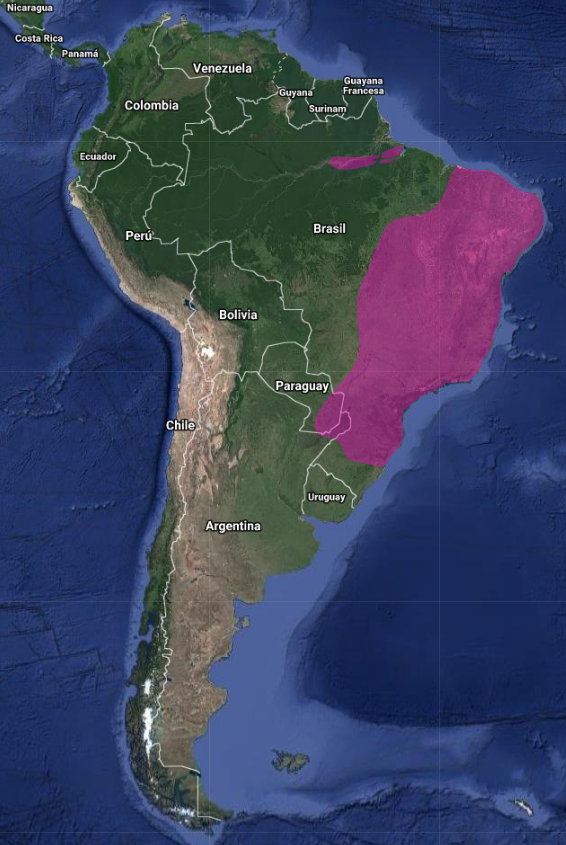
InfoNatura: Animals and Ecosystems of Latin America 2007 Se distribuye desde bajo Rio Amazonas (orilla sur) y Rio Tocantins, Pará, y sur de Marañón a través del este de Brasil hacia el borde este de Mato Grosso, este de Paraguay, y Rio Grande do Sul en Brasil, y Misiones al noreste de Argentina. (Short, 1975:250 y 1982:403); (Sick, 1997:514); (Winkler & Christie 2020)
Brasil, Estado Sao Paulo, “Parque Estadual Intervales”, en mata atlántica donde es residente, común tanto en bosque primario como de 2º crecimiento (Aleixo & Galetti, 1997:252); (dos Anjos, 2001:24) lo registra como abundante en su estudio realizado en Mata Atlántica en “Parque Estadual Mata dos Godoy, (Estado de Paraná); en la cuenca inferior del Rio Tibagi, “Parque Estadual Mata dos Godoy, (Estado de Paraná), donde lo registra como común en en borde de bosque, bosque y matorrales, tanto en suelo, y estratos bjos, medios y dosel (dos Anjos et al., 1997:167); en bosques de zonas escarpadas desde la cuenca alta del Rio Jacuí hasta cerca de Tôrres (Rio Grande do Sul) (Belton, 1984:592); registrado en invierno, en remanente de Mata Atlántica en la desembocadura del Rio Três Forquilhas y en invierno y verano en tierras altas de Planalto (300-750 msnm), ambos en el Estado de Rio Grande do Sul (Bencke & Kindel, 1999:103); Estado de Tocantins, Fazenda Javáes (Municipio de Pium) (10º 3’ 53.20’’S 49º 47’ 42.50’’O) (Leite & Marcelino, 2010:18); (Mickich, 2002:180) en Parque Estatal de Vila Rica do Espirito Santo (Estado de Paraná); Parque Nacional Itatiaia, (700 msnm), en el límite entre los Estados de Río de Janeiro y Minas Gerais, material de la colección de aves del Museo del Parque (Pacheco & Parrini, 2000); Bastante común en Sooretama Biological Reserve (Estado Espirito Santo), (18º 53’S 39º 55’O) y Parque Nacional Iguazú (Estado de Paraná), (25º 04’S 39º 55’O) (Parker & Goerck, 1997:535); Parque Nacional Serra da Canastra (Minas Gerais), (20º 15’S 46º 37’O), bastante común (Silveira, 1998:62); Municipio de Londrina, (Estado de Paraná), (23º 27’S 51º 15’O), en Parque Estatal Mata dos Godoy, Fazenda Doralice, Parque Municipal Artur Thomas y Mata do Iapar donde lo registran frecuentando todos los estratos (inferior a dosel) casi en la misma proporción (Soares & dos Anjos, 1999:64); común en bosque de galería de Chapada dos Veadeiros, (Estado de Goias), (14º 05’S 47º 40’O), y bosque primario de Serra Dourada, (Estado de Goias), (16º 05’ 27’’S 50º 16’ 43’’O) (Stager, 1961:25).
Paraguay, Brooks et al, 1993:73 y 120), lo registran ocasionalmente Ea. La Golondrina, Caazapá, (23º 33’S 55º 30’O), Ea. San Antonio, Alto Paraná, (25º 18’S 55º 20’O), Ea. Itabó, Canindeyú, (24º 27’S 54º 38’O), Ea. La Golondrina, Caaguazú y Canindeyú, (24º 35’S 55º 22’O), Reserva Natural del Bosque Mbaracuyá, Canindeyú, (Cuenca superior del Rio Jejuí), Puesto de Guardia Jejuí-mi, (24º 07’S 55º 32’O), Puesto guardia Lagunita, (24º 07’S 55º 26’O). En Angras dos Reis y Paraty (Estado Rio Janeiro) (Buzzeti, 2000); Municipio de Sao Paulo (Figueiredo & Lo, 2000:24); registrado como bastante común en Parque Estatal Serra do Mar (Estado Sao Paulo) (Goerck, 1999:246); Raro en Paraguay Central y Alto Paraná, e hipotético en Campos Cerrados (Hayes, 1995:69); Parque Nacional San Rafael (en la cordillera San Rafael en la cuenca superior del Rio Tebicuary), (26º 20’S 55º 32’O) (Madroño et al., 1997:53); Parque Nacional Caaguazú (Dto Caazapá) , en zona occidental del PN (26º 07’S 55º 44’O) en Puesto Apepú (Madroño et al., 1997a:57).
En Argentina:
Misiones:
Citado para la provincia por: (Olrog, 1959:175); (Partridge, 1954); (Navas & Bó, 1988, en De la Peña, 2013:343 y De la Peña & Salvador, 2016:99); (De la Peña, 1999:109); (De la Peña, 2013:343); (De la Peña & Salvador, 2016:99).
En el Parque Nacional Iguazú citado por: (Straneck, 1990:20), en invierno (agosto); (Saibene et al., 1996:38), en Parque Nacional “Iguazú”, frecuente de observar, residente y nidificante; (Narosky & Chébez, 2002:69), en Parque Nacional Iguazú, en estrato medio de selvas primarias y secundarias; (Bodrati et al., 2012:72), lo registra en la Posada Puerto Bemberg situada a orillas del río Paraná casi en el extremo noroeste de la provincia de Misiones (25º 55’S, 54º 37’O), en el sudoeste del departamento Iguazú. Residente y frecuente de observar.
(Chébez, 1996:139), en Departamentos de Iguazú (26º01’14’’S 54º36’55’’O), Guaraní (27º17’55’’S 54º11’55’’O), 25 de Mayo (27º34’03’’S 54º41’03’’O), Gral Belgrano (26º15’S 53º39’O) y Eldorado (26º24’04’’S 54º37’07’’O).
Según S.I.B. (Administración de Parques Nacionales), observado (sin validar) en Reserva Natural Estricta San Antonio (Dto. Gral Belgrano-Misiones-) y Parque Nacional Mburucuyá (Dto. Mburucuyá-Corrientes-)
Observaciones: De la Peña, 1975 en Cataratas del Iguazú, en De la Peña, 2013:343)
Hábitat: Bosque húmedo, también sabana, Selva paranaense y caatinga (Barnett & Pearman, 2001:52); encontrado en el borde del bosque, bosque primario, de galería y en huertos. Tierras Bajas hasta los 1.200 msnm. (Winkler & Christie, 2020); (Stotz et al, 1996:198). Rara vez se lo ve posado y expuesto en el campo abierto.