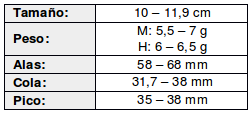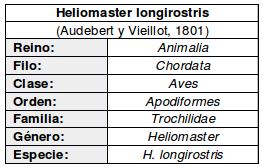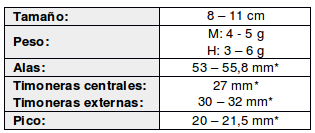
De amplia distribución tanto altitudinal como geográfica, con registros desde el nivel del mar hasta tan altos como de 1200 msnm en el Estado de Guerrero en México, 1300-1500 msnm en la vertiente del Pacífico de Guatemala (Griscom, 1932) y 1300 msnm en Venezuela (Skutch, 1972), aunque localmente hasta 2.500 msnm (Stotz et al., 1996)
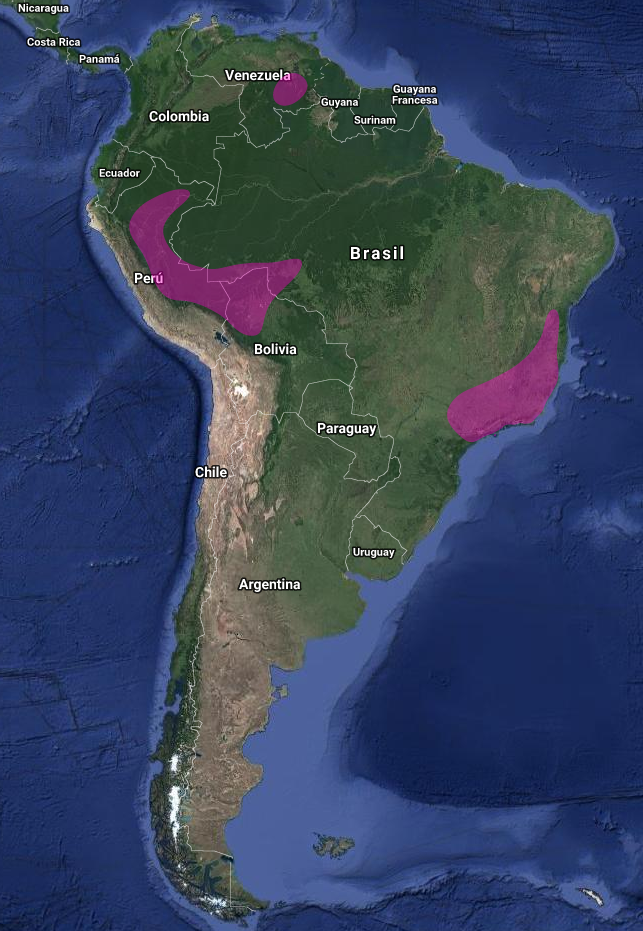
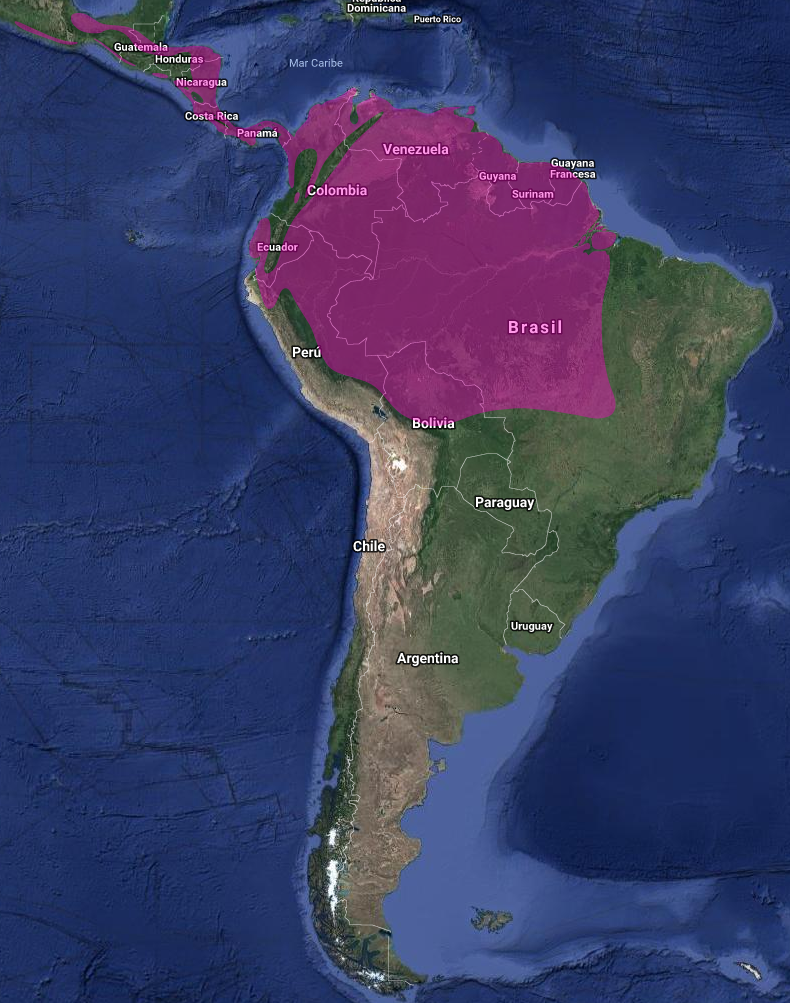
América: Argentina (ocasional), Belice; Bolivia (Bond & Meyer de Schauensee, 1943; Schmitt & Schmitt, 1997), Brasil (Costa Straube & Bornschein, 1995; Willis & Oniki, 1993); Colombia (Salaman & Mazariegos, 1998); Ecuador (Berg, 1994; Buitrón-Jurado, 2011); El Salvador – amenazado, documentado en tierras bajas (Komar, 1998), Costa Rica (Slud, 1964); Perú (Zimmer, 1953), Trinidad y Guatemala (Friedmann, Griscom & Moore, 1950; Griscom, 1932); Guayana francesa; Guayana (Braun, Finch, Robbins & Schmid, 2007); Honduras – raro, encontrado por debajo de los 750 msnm en el bosque húmedo lluvioso de la vertiente caribeña (Monroe, 1968); México (Binford, 1989; Friedmann et al., 1950; Navarro, Peterson & Escalante, 1992; Phillips, 1996); Nicaragua; Panamá (Strauch, 1977; Wetmore, 1968; Willis & Eisenmann, 1979); Paraguay (rara, accidental); Surinam; Tobago (Junge & Mees, 1958) y Venezuela (Skutch, 1972)
En Argentina: Barnett & Pearman (2001) la incluyen como «especie hipotética» para la fauna del país comentando que las fotos que sostenían la evidencia de dos registros en Santa Fe (De la Peña, 1999) no muestran caracteres definitivos de la especie y no pueden ser identificadas con seguridad.
De la Peña (2016) concluye la polémica con una Aclaración sobre la cita de esta especie en Santa Fe. «En noviembre de 1976 se halló nidificando en Esperanza, dpto. Las Colonias, Santa Fe un picaflor cuya hembra tenía una visible mancha oscura en la garganta. En esa oportunidad fue consultado el Dr. Ch. Olrog, quien lo toma, al parecer como Heliomaster squamosus (Olrog, 1979). Con posterioridad la foto fue enviada a un Museo de Estados Unidos y se lo identifica como Heliomaster longirostris. Luego de este nido se localizaron dos más con hembras con una mancha en la garganta. En este caso fue consultado el Dr. Karl Schuchmann, (de Alemania) el que determina que algunas hembras muy adultas de Heliomaster furcifer tienen una mancha en la garganta. Por este motivo se descarta la presencia de la especie en la provincia de Santa Fe».
Salta: Moschione, Spitznagel & González, (2012) la incluyen en la «Lista de aves de Salta» como residente estival, nidificante y común en la región del chaco y yungas de la provincia.
Formosa: registro no documentado en el este de la provincia en las afueras de Villa General Güemes, Dto Patiño, el 20 de enero de 1988 (Moschione, 1996, citado en: (Barnett & Pearman, 2001:118) y (Contreras, Agnolin, Davies, Godoy, Giacchino & Ríos, 2014: 338)
Misiones: presencia puntual en los bebederos artificiales del Jardín de los Picaflores, por ahora su presencia en el área sería accidental. (Chébez, Castillo & Güller, 2004; De la Peña, 2013); Saibene et al. (1996) no lo incluye en el «Inventario de las aves del Parque Nacional Iguazú» al igual que Chébez (1996) en «Fauna Misionera».
Chaco: existirían registros visuales de la especie en el oeste de la provincia (F Moschione, com. pers. citado en Chébez et al., 2004:2)
Ecorregiones: Selva Paranaense
Hábitat: Bosque subtropical siempre verde y de hoja caduca. Desde la vertiente árida del Pacífico, del golfo caribeño, tierras bajas del hocó, costa ecuatorial del Pacífico, norte y sur de la amazonia (Stotz et al., 1996)
Prefiere el dosel del bosque, especialmente en los claros o a lo largo de los bordes, bosques abiertos, arboledas aisladas y árboles en pastizales y claros, bosques de galería en campo abierto, segunda vegetación y vegetación semiabierta. Evita el interior sombrío del bosque. Tierras bajas y estribaciones, cerrados, campos abiertos, sabanas y zonas bajas con matorrales en emplazamientos húmedos; localmente a 1400–2500 msnm. (Stotz et al., 1996; Contreras et al., 2014)