- Administración de Parques Nacionales. Sistema de Información de Biodiversidad. Argentina. (s.f.) Ficha: Cathartes aura. Recuperado el 19/01/2021 de https://sib.gob.ar/especies/cathartes-aura
- Alabarce, E.A., C. Laredo, R. Vides & M. Lucero (1990) Análisis de la estructura de una comunidad de aves en la localidad de Las Juntas, provincia de Catamarca. Estudio preliminar. Acta Zool. Lilloana, 39: 45-52. (enlace)
- Allard, H.A. (1934). Voice of the Turkey Vulture (Cathartes aura septentrionalis). Auk 51:514-515. (enlace)
- American Ornithologists’ Union (1983) Check-list of North American birds. Sixth edition. American Ornithologists’ Union, Lawrence, Kansas. (enlace)
- Antelo, C.M. (1999) Análisis del impacto de las plantaciones de Pinus elliottii sobre la avifauna de Yungas (Tucumán, Argentina) (Doctoral dissertation, Tesis de Maestría. Programa de Postgrado en Manejo de Vida Silvestre. Fac. de Cs. Ex., Fís. y Nat. Universidad Nacional de Córdoba).
- Antelo, C.M., Brandán, Z.J., Navarro, C.I. & Marigliano, N.L. (2006) Avifauna de un sector de bosque en Las Tipas (Tucumán, Argentina). Acta Zoológica Lilloana, 50(1-2), 41-46.
- Antelo, C.M. & Fernández, Z.J.B. (2013). Las aves no passeriformes de Tucumàn, Argentina. Miscelanea 132. Fundación Miguel Lillo, Argentina. (enlace)
- Applegate, R.D. (1990) Can vultures smell? Turkey Vulture caught in cage trap. North American Bird Bander 15:141-142. (enlace)
- Arad, Z. & M. H. Bernstein (1988) Temperature regulation in Turkey Vultures. Condor 90:913-919. (enlace)
- Arad, Z., U. Midtgard & M.H. Bernstein (1989) Thermoregulation in Turkey Vultures: Vascular anatomy, arteriovenous heat exchange, and behavior. Condor 91:505-514. (enlace)
- Aráoz, R., Ortiz, D. & Capllonch, P. (2016) Biometrics and body masses of some birds of prey of Argentina. Rev. Bras. Orn. 24(4): 344–348. (enlace)
- Athanas, N., & Greenfield, P.J. (2016) Birds of western Ecuador: A photographic guide. Princeton University Press.
- Atkinson, E.C., L.J. Goodrich & K.L. Bildstein (1996) A temporal field guide to autumn raptor migration at Hawk Mountain Sanctuary, Pennsylvania. Pennsylvania Birds 10:134-137. (enlace)
- Avery, M.L., Humphrey, J.S., Daughtery, T.S., Fischer, J.W., Milleson, M.P., Tillman, E.A., Bruce, W.E. & Walter, W.D. (2011) Vulture flight behavior and implications for aircraft safety. Journal of Wildlife Management. 75(7): 1581-1587. (enlace)
- Avise, J.C., W.S. Nelson & C.G. Sibley (1994) DNA sequence support for a close phylogenetic relationship between some storks and New World vultures. Proceedings of the National Academy of Sciences of the United States of America 91:5173-5177. (enlace)
- Azpiroz, A., M. Mattalia, B. López-Lanús & L.L. Sosa (2013) Caracterización ornitológia y productiva del campo “Gral Ávalos” Monte Caseros, Corrientes, informe técnico de Aves Argentinas/AOP: diciembre 2010. En pp. 351-373: G.D. Marino, F. Miñarro, M.E. Zaccagnini & B. López-Lanús (eds.) Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina.Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- Babarskas, M., J.O. Veiga & F.C. Filiberto (1995) Inventario de Aves del Parque Nacional El Rey, Salta, Argentina. Monografía Especial L. O. L. A. No 6, 44 Págs. Buenos Aires.
- Bagg, A.M. & H.M. Parker (1951) The Turkey Vulture in New England and eastern Canada up to 1950. Auk 68:315-333. (enlace)
- Bailey, A.M. & E.G. Wright (1931) Birds of southern Louisiana. Wilson Bulletin 43:190-219. (enlace)
- Baliño. J. (1984) Aves del Parque Nacional El Palmar, lista sistemática y otras contribuciones a su conocimiento. Rev. Mus. Arg. Cs. Nat. Zool. 13: 499-511.
- Bang, B.G. & S. Cobb (1968) The size of the olfactory bulb in 108 species of birds. Auk 85:55-61. (enlace)
- Bang, B.G. (1972) The nasal organs of the Black and Turkey vultures: a comparative study of the Cathartid species Coragyps atratus atratus and Cathartes aura septentrionalis (with notes on Cathartes aura falklandica, Pseudogyps bengalensis and Neophron percnopterus). J. Morphology. 115: 153–184. (enlace)
- Barnes, R., Bartrina, L., Butchart, S.H.M., Clay, R.P., Esquivel, E.Z., Etcheverry, N.I., Lowen, J.C. & Vincent, J. (1993) Birds Surveys and Conservation in the Paraguayan Atlantic Forest. Project CANOPY ‘92: Final Report.
- Barnett, J.M., & Pearman, M. (2001). Annotated checklist of the birds of Argentina. Lynx Edicions. 164 pp.
- Belton, W. (1985) Birds of Rio Grande do Sul, Brazil. Part 1, Rheidae through Furnariidae. Bulletin of the AMNH; v. 178, article 4. (enlace)
- Bendire, C.E. (1892) Life histories of North American birds with special reference to their breeding habits and eggs. U.S. National Museum Special Bulletin 1. (enlace)
- Bettinelli, M.D., & Chebez, J.C. (1986). Notas sobre aves de la meseta de Somuncurá, Río Negro, Argentina. Hornero 012 (04): 230-234. (enlace)
- Bildstein, K. (2017) Raptors. Comstock Publishing Associates, a division of Cornell University Press. Ithaca and London
- BirdLife International (2021) Species factsheet: Cathartes aura. Downloaded from http://www.birdlife.org on 19/01/2021
- Blake, E.R. (1977) Manual of Neotropical birds. Volume 1. University of Chicago Press, Chicago, lllinois. 724 pp.
- Blendinger, P.G. & M. E. Alvarez (2002) Ensamble de aves de los bañados de Carilauquen (Laguna Llancanello, Mendoza, Argentina) consideraciones para su conservación. Hornero 17: 71-83. (enlace)
- Blendinger, P.G., P. Capllonch & M.E. Alvarez (2004) Abundance and distribution of raptors in the Sierra de San Javier Biological Park, Northwestern Argentina. Ornitología Neotropical. 15: 501-512. (enlace)
- Bodrati, A., Cockle, K., Segovia, J.M., Roesler, I., Areta, J. I., & Jordan, E. (2010) La avifauna del Parque Provincial Cruce Caballero, Provincia de Misiones, Argentina. Cotinga, 32, 41-64. (enlace)
- Bonkewitzz , A.N. (1990) Fauna de vertebrados de la laguna Guatraché. Universidad Nacional del Sur. Dpto. de Biología. Bahía Blanca, 103 pp
- Brandán, Z.J., & Navarro, C.I. (2009) Lista actualizada de las aves de la provincia de Tucumán. Fundación Miguel Lillo, 12-55. (enlace)
- Bremer, E. & P. Bremer (1987) En los alrededores de Punta Rasa. Nuestras Aves 12: 21.
- Brown, L. H. & D. Amadon (1968) Eagles, Hawks, and Falcons of the World. McGraw-Hill, New York, NY, USA. 945 pp.
- Brown, W.H. (1976) Winter population trends in Black and Turkey Vultures. American Birds 30:909-912. (enlace)
- Bruno, F., D. Acevedo, J.L. Maceda & M.I. Mero (2007) Reserva Natural Municipal Chadilauquen. Aves. Municipalidad de Embajador Martini. La Pampa (enlace)
- Buckley, N. J. (1996) Food finding and the influence of information, local enhancement, and communal roosting on foraging success of North American vultures. Auk 113:473-488. (enlace)
- Budin, E. (1931) Lista y notas sobre aves del N.O. argentino (Prov. de Jujuy). Hornero 004 (04): 401-411 (enlace)
- Buhnerkempe, J.E. & R.L. Westemeier (1984) Nest sites of Turkey Vultures in buildings in southern Illinois. Wilson Bulletin 96:495-496. (enlace)
- Bullock, D.S. (1956) Vultures as disseminators of anthrax. Auk 73:283-284. (enlace)
- Bunn, A.G., W. Klem & K.L. Bildstein (1995) Time of day effects on the numbers and behavior of non-breeding raptors seen on roadside surveys in Pennsylvania. Journal of Field Ornithology 66:544-552. (enlace)
- Burgos, F.G., Baldo, J.L., & Cornell, F.M. (2009) Lista de las Aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. SS de Jujuy. (enlace)
- Burleigh, T.D. (1938) Mexican Turkey Vultures in southern Florida. Auk 55:520-521. (enlace)
- Bussjaeger, L.J., C.C. Carpenter, H.L. Cleveland & D.L. Marcellini (1967) Turkey vulture migration in Veracruz, Mexico. Condor 69:425-426. (enlace)
- Campbell, R.W., N.K. Dawe, I. McTaggart-Cowan, J.M. Cooper, G.W. Kaiser & M.C.E. McNall (1990) The Birds of British Columbia, Volume 2. Diurnal Birds of Prey Through Woodpeckers. Royal British Columbia Museum, Victoria, BC, Canadá. 636 pp.
- Camperi, A.R. (1992) Estudio de una colección de aves de la provincia de Entre Ríos. Hornero 013 (03): 225-229 (enlace)
- Camperi, A., Darrieu, C., Grilli, P., & Burgos, F. (2012) Avifauna de la provincia de Jujuy, Argentina: lista de especies (no Passeriformes). Acta zoológica lilloana, 82-140. (enlace)
- Canevari, M., Canevari, P., Carrizo, G., Harris, G., Rodríguez Mata, J. & Straneck, R. (1991) Nueva guía de las aves argentinas. Tomo 2. Fundación ACINDAR, 497 pp.
- Capllonch, P. (1988) El anillado de aves en la Argentina. Resúmenes VII RAO: 36-37. Corrientes.
- Capllonch, P., Lobo, R., Ortiz, D. & Ovejero, R. (2005) La avifauna de la selva de galería en el noreste de Corrientes, Argentina: Biodiversidad, Patrones de Distribución y Migración. Miscelánea, 14, 484. (enlace)
- Capllonch, P. (2007) Guía de Aves de Tafí del Valle. Megaprint Eds, Tucumán, Argentina (enlace)
- Capllonch, P., Ortiz, D. & Ferro, I. (2011) Notas sobre la avifauna de las Cumbres Calchaquíes, Tucumán, Argentina. Acta zoológica lilloana, 50-63. (enlace)
- Capmourteres, V., Bauni, V., Meluso, J. M., Bogan, S., & Homberg, M. (2015) Aves de la reserva Campo San Juan, Misiones: descripción e implicancias para su conservación. Nótulas faunísitcas. Segunda Serie, 171, 1-14. (enlace)
- Carma, M.I. (2009) Relevamiento de aves de la provincia de Catamarca. Consejo Federal de Inversiones. (enlace)
- Casas, A.E. (1992) La avifauna de las lagunas Cari Laufquen Chica y Cari Laufquen Grande, departamento 25 de Mayo, Río Negro. Hornero 013(03): 248-252 (enlace)
- Castellanos, A. (1931) Aves del valle de los Reartes (Córdoba). Hornero 004 (04) : 361-391 (enlace)
- Castellanos, A. (1937) Observaciones de algunas aves de Tierra del Fuego e Isla de los Estados. Hornero 006 (03) : 382-394 (enlace)
- Cebolla Badie, M. (2000) El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación. Suplemento Antropológico, Vol XXXV, N.º 2: 9-188 (enlace)
- Chapman, F.M. (1926) The distribution of the bird life in Ecuador. Bulletin of the American Museum of Natural History, 55: 1-784. (enlace)
- Chatellenaz, M.L. (2005) Aves del Valle del Río Paraná en la provincia del Chaco, Argentina: riqueza, historia natural y conservación. Miscelánea, 14, 528. (enlace)
- Chatellenaz, M.L., P.D. Cano, C. Saibene & H.A. Ball (2010) Inventario de las aves del Parque Nacional Mburucuyá (Provincia de Corrientes, Argentina). Acta Zool. Lilloana 54: 139-150. (enlace)
- Chébez, J.C. & C. Bertonatti (1994) La avifauna de la isla de los Estados, islas de año Nuevo y mar circundante. (Tierra del Fuego, Argentina). Monografía N.º 1. L.O. L.A. 57 pp.
- Chébez, J.C. (1996) Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía Nº 5. L. O. L. A. Buenos Aires; 320 pp.
- Chébez, J.C., Rey, N.R., Babarskas, M., & Di Giacomo, A.G. (1998) Las Aves de los Parques Nacionales de la Argentina. Administración de Parques Nacionales y Asociación Ornitológica del Plata, Buenos Aires, Argentina.
- Chebez, J.C. (2006) Guía de las Reservas Naturales de la Argentina. Zona Centro. Ed. Albatros, Buenos Aires, 288 pp
- Chehébar, C., & Ramilo, E. (1992) Fauna del Parque Nacional Nahuel Huapí. Administracion de Parques Nacionales y Asociación Amigos del Museo de la Patagonia “Francisco Pascasio Moreno”, San Carlos de Bariloche, 38 pp
- Christie, M.I., E.J. Ramilo & M.D. Bettinelli (2004) Aves del noroeste patagónico. Atlas y guía. L. O. L. A. pp. 328.
- Clapp, R.B., M.K. Klimkiewicz & J.H. Kennard (1982) Longevity records of North American birds: Gaviidae through Alcidae. Journal of Field Ornithology 53: 81–208. (enlace)
- Clark, R.G. & Ohmart, R.D. (1985) Spread winged posture of Turkey Vultures; single or multiple function? Condor. 87: 350-355. (enlace)
- Clark, R.R. (1986) Aves de Tierra del Fuego y Cabo de Hornos. Guía de campo. L.O. L.A. Bs. As.
- Clark, W.S. & Schmitt, N.J. (2017) Raptors of Mexico and Central America. Princeton University Press.
- Cleveland, N.J., S. Edie, G.D. Grieef, G.E. Holland & R.F. Koes (1988) Birder’s guide to southeastern Manitoba. 2nd ed, Eco Series no. 1. Winnipeg: Manitoba Nat. Soc.
- Coconier, E.G. (ed.) 2007. Las aves silvestres de Acambuco, provincia de Salta, Argentina. Relevamiento de un AICA prioritaria de la selva Pedemontana. Temas de Naturaleza y Conservación 6: 1-127. Aves Argentinas/AOP, Buenos Aires (enlace)
- Coleman, J.S. (1985) Home range, habitat use, behavior and morphology of the Gettysburg vultures. Master’s Thesis, Virginia Polytechnic Institute and State Univ., Blacksburg, VA. (enlace)
- Coleman, J.S., J.D. Fraser & C.A. Pringle (1985) Salt eating by Black and Turkey Vultures. Condor 87:291-292. (enlace)
- Coleman, J.S. & J.D. Fraser (1986) Predation on Black and Turkey vultures. Wilson Bulletin 98:600-601. (enlace)
- Coleman, J.S. & Fraser, J.D. (1987) Food habits of Black and Turkey vultures in Pennsylvania and Maryland. Journal of Wildlife Management. 51: 733–739. (enlace)
- Coleman, J.S. & J. D. Fraser (1989a) Age estimation and growth of Black and Turkey Vultures. Journal of Field Ornithology 60:197-208. (enlace)
- Coleman, J.S. & J.D. Fraser (1989b) Habitat use and home ranges of Black and Turkey Vultures. Journal of Wildlife Management 53:782-792. (enlace)
- Coles, V. (1944) Nesting of the Turkey Vulture in Ohio caves. Auk 61:219-227. (enlace)
- Contreras, J. (1977) La avifauna del Valle del Río Collón Curá, Provincia de Neuquén. IDIA, Suplemento, 34, 250-270.
- Contreras, J.R. (1979) Lista faunística preliminar de los vertebrados de la Reserva Ecológica de Ñacuñan, Cuaderno Técnico (IADIZA) 1: 39-47.
- Contreras, J.R. & A. Fernández (1980) Ecología de la avifauna de la laguna del Viborón, departamento Maipú, provincia de Mendoza. Rev. Mus. Hist. Nat. de San Rafael (Mendoza) VIII (1): 3-14.
- Contreras, J.R. (1987) Lista preliminar de la avifauna de la provincia de Formosa, República Argentina. Historia Natural VII (4): 33-52
- Contreras, J.R., L.M. Berry, A.O. Contreras, C.C. Bertonatti & E.E. Utges (1990) Atlas ornitogeográfico de la provincia del Chaco. República Argentina. I. No passeriformes. Cuad.Téc. Félix de Azara No 1. 164 pág. Corrientes.
- Contreras, J.R., F. Agnolin, Y.E. Davies, I. Godoy, A. Giacchino & E. Ríos (2014) Atlas ornitogeográfico de la provincia de Formosa, República Argentina. 1O Ed. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara. 450 p.
- Crafts, Jr., R.C. (1968) Turkey vultures found to feed on coconut. Wilson Bulletin 80:327-328. (enlace)
- Curti, M.G., Polanco, H.J., Aparicio, J.G., Hayes, T.I. & Latta, S.C. (2014) First record of Turkey Vultures (Cathartes aura) nesting on Hispaniola. Journal of Caribbean Ornithology. 27: 22–24. (enlace)
- Cuthbert, C.W., J.I. Horton, M.W. McCowan, B.G. Robinson & N.G. Short (1990) Birder’s guide to southwestern Manitoba. Brandon, Manitoba: Brandon Nat. Hist. Soc.
- Daciuk, J. (1975) La Fauna Silvestre de las Islas Malvinas. Anales de la Sociedad Cie ntífica Argentina , T. CXC IX, Entregas IV -VI. Buenos Aires
- Darrieu, C.A. & A.R. Camperi (2001) Nueva lista de las aves de la provincia de Buenos Aires. Cobiobo No 3-Probiota No 2. Sec. de Política Ambiental. UNLP. Buenos Aires (enlace)
- Darrieu, C.A., A.R. Camperi & S. Imberti (2008) Avifauna (non Passeriformes) of Santa Cruz province, Patagonia (Argentina): annotated list of species. Revista del Museo Argentino de Ciencias Naturales 10(1):111–145. (enlace)
- Darrieu, C.A., A.R. Camperi, J.J. Maceda & F. Bruno (2011) Avifauna de la provincia de La Pampa, Argentina: lista de especies (no passeriformes) Acta Zoologica Lilloana: 55: 64 – 108. (enlace)
- Darrieu, C.A., Camperi, A.R., Piloni, G., & Bogado, N. (2013) Lista actualizada de aves de la provincia de Buenos Aires. Vazquez Mazzini Editores. (enlace)
- Darrow, H.N. (1983) Late fall movements of Turkey Vultures and hawks in the Florida keys. Florida Field Naturalist 11:35-39. (enlace)
- Davis, D.E. (1941) Notes on Cuban birds. Wilson Bulletin 53:37-40. (enlace)
- Davis, D. (1979) Morning and evening roosts of Turkey Vultures at Malheur Refuge, Oregon. Western Birds. 10: 125-130. (enlace)
- De la Peña, M.R. (1999) Aves argentinas. Lista y distribución. L.O.L.A. (Literature of Latina America). Buenos Aires. 244 pp.
- De la Peña, M.R. (2006) Lista y distribución de las aves de Santa Fe y Entre Ríos. Monografía N.º 15: L.O.L.A. (Literature of Latin America), Buenos Aires; 138 pp.
- De la Peña, M.R., F.C., Laene Silva, R., Capuccio, G. & Bonín, L.M. (2009) Aves del Río Uruguay, Guía Ilustrada de Especies del Bajo Uruguay y el Embalse de Salto Grande. Comisión Administradora del Río Uruguay. CARU. 247 pp. (enlace)
- De la Peña, M.R. & R.F. Tittarelli (2011) Guía de aves de La Pampa. Santa Rosa. Gobierno de La Pampa.
- De la Peña, M.R. (2011a) Atlas ornitogeográfico de la provincia de Santa Fe. Serie Naturaleza y Conservación No 4. Pág. 1-500.
- De la Peña, M.R. (2012) Distribución y citas de aves de Entre Ríos. Serie Naturaleza y Conservación No 6. Pág. 1-206. (enlace)
- De la Peña, M.R. (2013) Nidos y Reproducción de las Aves Argentinas. Nidos y reproducción de las aves argentinas. Ediciones Biológica. Serie Naturaleza, Conservación y Sociedad N° 8. Santa Fe, Argentina. 590 pp. (enlace)
- De la Peña, M.R. (2015) Aves argentinas (1º Ed.) Santa Fe; Ediciones U.N.L. C.A.B.A.: EUDEBA; 496 pp.
- De la Peña, M.R. & Salvador, S. (2016) Aves argentinas: descripción, comportamiento, reproducción y distribución. Ciconiidae a Heliornithidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Año 2016 | Vol. 19 | N° 2 | Pág. 1-437 | ISSN 0325-3856
- De la Peña, M. R. & Bodrati, A. (2019) Aves Argentinas: Descripción, Comportamiento, Reproducción y Distribución (ACTUALIZACIÓN) TOMO 4 Cathartidae, Pandionidae, Accipitridae, Aramidae, Rallidae, Heliornithidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) Año 2019 | N° 4 | Pág. 1-246| ISSN 0325-3856
- De Lucca, E., Bertini, M. & Quaglia, A. (2012). Nidificación Agrupada del Gavilán ceniciento (Circus cinereus) en Médanos Costeros del Noreste Patagónico, Argentina. Nótulas Faunísticas; Segunda Serie, 107: 1-10
- De Schauensee, R.M. & W.H. Phelps (1978) A Guide to the Birds of Venezuela. Princeton University Press, Princeton, NJ, USA. (enlace)
- Defusco, R.P. (1993) Modeling bird hazards to aircraft: a GIS application study. Photogr. Eng. Remote Sensing 59:1481-1487. (enlace)
- Di Giacomo, A.G. (2005) Aves de la Reserva El Bagual. En Di Giacomo, A. G. y S. F. Krapovickas (Eds.). Historia natural y paisaje de la Reserva El Bagual, provincia de Formosa, Argentina. Inventario de la fauna de vertebrados y de la flora vascular de un área del Chaco Húmedo. Temas de Naturaleza y Conservación 4: 201-465. Aves Argentinas/AOP. Buenos Aires. (enlace)
- Doiny Cabré, C. & R. Lejarraga (2007) Aves de Sierra de la Ventana. Bahía Blanca.
- Downes, C.M. & B.T. Collins (1996) The Canadian Breeding Bird Survey, 1966-1994. Canadian Wildlife Service Program Notes 210. (enlace)
- Dwyer, J.F. & S.G. Cokwell (2011) Social hierarchy of scavenging raptor son the Falkland Islands, Malvinas. Journal of Raptor Research, 45: 229-235. (enlace)
- Earnshaw, A. & Earnshaw, N. (2000) Lista de aves observadas en el safari NOA. (enlace)
- Echevarria, A.L., Marigliano, N.L., & Chani, J.M. (1998) Composición y variaciones anuales de la diversidad de aves de una localidad de Bosque Chaqueño Serrano (Ticucho, El Cadillal, Tucumán, Argentina). Acta Zoológica Lilloana, 44(1), 207-217. (enlace)
- Echevarría, A.L. & J.M. Chani (1999) Lista de aves del embalse El Cadillal, provincia de Tucumán. Acta Zoológica Lilloana 45 (1): 141-145. (enlace)
- Echevarría, A.L. & J.M. Chani (2000) Estructura de las comunidades de aves acuáticas del embalse El Cadillal, Tucumán, Argentina. Acta Zoológica Lilloana 45 (2): 219-232 (enlace)
- Echevarría, A.L. & J.M. Chani (2006) Aves migratorias, la importancia del embalse El Cadillal, (Tucumán, Argentina) como sitio de tránsito e invernada. Acta Zoológica Lilloana 50 (1-2): 97-108. (enlace)
- Echevarria, A., Marano, C. & Fanjul, E. (2008). Comunidades de aves del embalse Escaba y sus alrededores, Tucumán. Resumen de XII Reunión Argentina de Ornitología, 5 al 8 de marzo 2008, San Martín de los Andes, Neuquén, Argentina. (enlace) https://www.fcnym.unlp.edu.ar/uploads/docs/rao_2008.pdf
- Echevarria, A.L., Marano, C.F., Chani, J.M. & Cocimano, M.C. (2008) Comunidad de aves del Embalse La Angostura, Tafí del Valle, Tucumán, Argentina. (enlace)
- Erritzoe, J., Kampp, K., Winker, K. & Frith, C. B. (2007) The Ornithologyst’s Dictionary. Lynx Edicions, Barcelona; 290 pp.
- Fandiño, B. & A. Pautasso (2011) Avifauna del AVP La Salamandra, pp: 62-105. En: Pautasso, A.A. La fauna y su conservación en los Bajos Submeridionales. Ediciones Biológica. Serie Naturaleza, Conservación y Sociedad N° 5. Santa Fe, Argentina. 278 pp. (enlace)
- Fernández, Z.J.B., & Antelo, C.M. (2009) Composición y variaciones estacionales de la avifauna en un ambiente antropizado (San Pablo, Tucumán, Argentina). Acta zoológica lilloana, 98-107. (enlace)
- Fiora, A. (1933) El peso de las aves. Hornero 005 (02): 174-188 (enlace)
- Fiora, A. (1939) Distribución geográfica de las especies de aves capturadas en la provincia de Jujuy y zonas limítrofes. Physis, 16: 271-289.
- Fiori, S.M. & S M. Zalba (1999) Plan de Manejo de la Reserva Provincial Auca Mahuida, Neuquén. GEKKO-Grupo de estudios en Conservación y Manejo. Departamento de biología, Bioquímica y Farmacia, Universidad Nacional del Sur-Bahía Blanca, 1-260 p. (enlace)
- Fisher, H.I. (1943) The pterylosis of the king vulture. Condor 45:69-73. (enlace)
- Fitch, H.S., F. Swensen & D.F. Tillotson (1946) Behavior and food habits of the Red-tailed Hawk. Condor 48:205–217. (enlace)
- Fowler, L. E. (1979). Hatching success and nest predation in the green sea turtle, Chelonia mydas, at Tortuguero, Costa Rica. Ecology, 60(5), 946-955. (enlace)
- Fraga, R.M. (2001) The avifauna of Estancia San Juan Poriahú, Iberá marshes, Argentina: check-list and some netural history notes. Cotinga 16: 81-86. (enlace)
- Friedmann, H. (1950) The Birds of North and Middle America. Part XI. Cathartidae to Falconidae. U.S. National Museum Bulletin no. 50. Smithsonian Institution, Washington, DC, USA. (enlace)
- Gaby, S.R.P. (1982) Age-specific resource utilization by wintering migrant Turkey Vultures (Cathartes aura) in south Florida. Phd Thesis, Univ. of Miami, Miami, FL.
- Gauthier, J., & Y. Aubry (1996). Les Oiseaux Nicheurs du Québec: Atlas des Oiseaux Nicheurs du Québec Meridional. Environnment Canada, Région du Québec: Association Québécoise des groupes d’ornithologues, Sociétié Québécoise de protection des oiseaux, Service Canadien de la Faune, Quebec, Canada. (enlace)
- Gelaín, M.A. (2007) Reserva Municipal Isla Huemul. Departamento Bariloche, Río Negro, Argentina. Relevamiento ornitológico. I. Xolmis No 2: 26-28.
- Gelain, M.A. & J. Tolosa (2011) Aves de la provincia de Río Negro. Lista sistemática. Xolmis CRO 6: 1-37.
- Gelain, M.A. (2012) Aves: Provincia de Río Negro, Argentina. Aves de Carri-Laufquen y adyacencias. II. Lista comentada. Xolmis CRO 14: 1-35.
- Giacomelli, E. (1923) Catálogo sistemático de las aves útiles y nocivas de la provincia de La Rioja. Hornero 003 (01): 066-084 (enlace)
- Giacomo, A.G.; Giacomo, A.S.; López Lanús, B.M.; Caradonna, A. (1995) Nuevos registros de aves en el Noroeste Argentino. Hornero 014 (01y02): 067-068 (enlace)
- Giai, A.G. (1950) Notas de viajes. Hornero 009 (02): 121-164 (enlace)
- Gibson, D.D. & Kessel, B. (1992) Seventy-four new avian taxa documented in Alaska, 1976–1991. 94(2): 454–467. (enlace)
- Giraudo, A.R., Baldo, J.L., & Abramson, R.R. (1993) Aves observadas en el sudoeste, centro, y este de Misiones (República Argentina), con la mención de especies nuevas o poco conocidas para la provincia. Not. Faun, 49, 1-13. (enlace)
- Giraudo, A.R., Bortoluzzi, A. & Arzamendia, V. (2006) Vertebrados tetrápodos de la Reserva y Sitio Ramsar “Esteros del Iberá”(Corrientes, Argentina): Análisis de su composición y nuevos registros para especies amenazadas. Natura Neotropicalis, 37(1-2), 1-20. (enlace)
- Glading, B. & C.H. Glading (1970) An instance of a captive Turkey Vulture killing prey. Condor 72:244-245. (enlace)
- Gómez, V.E. (2006) Aves del parque general San Martín (Mendoza). Distribución y características. Multequina, (15), 81-95. (enlace)
- Gorgoglione, C.E. (2005) Guía de campo para la identificación de las aves del Neuquén. Edición del autor. 3o Edición. Junín de los Andes. 279 pp.
- Gorleri F. & Di Giácomo A.G. (2011) Lista sistemática de las aves de la Reserva de Biosfera Laguna de Oca del Río Paraguay, Formosa. Aves argentinas (enlace)
- Graber, R.R. & J.W. Graber (1963) A comparative study of bird populations in Illinois, 1906-1909 and 1956-1958. Illinois Natural History Survey Bulletin 28:383-528. (enlace)
- Griffiths, C.S. (1994) Monophyly of the Falconiformes based on syringeal morphology. Auk 111 (4):787-805. (enlace)
- Hamilton Jr., W.J. (1941) Turkey buzzards killing young pigs. Auk, 58 (2): 254 (enlace)
- Handford, P. (1983) Breves notas sobre las aves del Valle de Tafí, provincia de Tucumán. Neotrópica, 29(81), 97-105.
- Hartert, E. & S. Venturi (1909) Notes sur les oiseaux de la République Argentine. Novit. Zool. 16: 159-267. (enlace)
- Hatch, D.E. (1970) Energy conserving and heat dissipating mechanisms of the Turkey Vulture. Auk 87:111-124. (enlace)
- Hayes, F. E. (1994) Status, distribution and biogeography of the birds of Paraguay. Monographs in Field Ornithology Nº1. American Birding Association. 224 pp. (enlace)
- Heath, J.E. (1962) Temperature fluctuation in the Turkey Vulture. Condor 64:234-235. (enlace)
- Hedlin, E.M., Houston, C.S., McLoughlin, P.D., Bechard, M.J., Stoffel, M.J., Barber, D.R. & Bildstein, K.L. (2013) Winter ranges of migratory Turkey Vultures in Venezuela. Journal of Raptor Research. 47(2): 145-152. (enlace)
- Heintzelman, D.S. & R. MacClay (1974) Turkey Vultures thermal soaring in opaque clouds. Auk 91:849. (enlace)
- Hellmayr, C.E. & B. Conover (1949). Catalogue of birds of the Americas and the adjacent islands. Vol. 13, Part I, No. 4: Cathartidae-Acciptridae-Pandionidae-Falconidae. Chicago: Zool. Series, Field Mus. Nat. Hist. (enlace)
- Heredia, G. & M. Funes (1987) Informe técnico sobre el Parque provincial Tromen-Los Barros y Reserva Provincial Lagunas de Epu Lauquen. Subsecretaría de la Producción y Recursos Naturales de la Provincia del Neuquén. Infome Inédito.
- Heredia, J. (2006) Aves de las Sierras de Córdoba. Guía de campo. 50 p. La Falda. Córdoba.
- Hertel, F. (1994) Diversity in body size and feeding morphology within past and present vulture assemblages. Ecology 75:1074-1084. (enlace)
- Hicks, D.L., Jr. Rogers, D.T. & G.I. Child (1966) Autumnal hawk migration through Panama. Bird-Banding 37:121-123. (enlace)
- Hilty, S.L., Tudor, G. & Gwynne, J.A. (2003) Birds of Venezuela. Princeton University Press.
- Hiraldo, F., M. Delibes & J. A. Donazar (1991) Comparison of diets of Turkey Vultures in three regions of northern Mexico. Journal of Field Ornithology 62:319-324. (enlace)
- Houston, D.C. (1986) Scavenging efficiency of Turkey Vultures in tropical forest. Condor 88:318-323. (enlace)
- Houston, D.C. (1988) Competition for food between Neotropical vultures in forest. Ibis 130:402-417. (enlace)
- Houston, C.S., McLoughlin, P.D., Mandel, J.T., Bechard, M.J., Stoffel, M.J., Barber, D.R. & Bildstein, K.L. (2011). Breeding home ranges of migratory Turkey Vultures near their northern limit. Wilson Journal of Ornithology. 123(3): 472-478. (enlace)
- Igl, L.D. & Peterson, S.L. (2010) Repeated use of an abandoned vehicle by nesting Turkey Vultures (Cathartes aura). Journal of Raptor Research. 44(1): 73-75. (enlace)
- Imberti, S. (2005) Aves de Los Glaciares. Inventario Ornitológico del Parque Nacional Los Glaciares, Santa Cruz, Patagonia, Argentina. Aves Argentinas y Administración de Parques Nacionales. 80 pp. (enlace)
- Jackson, J.A., I.D. Prather, R.N. Conner & S. P. Gaby (1978) Fishing behavior of Black and Turkey vultures. Wilson Bulletin 90:141-143. (enlace)
- Johnsgard, P. A. (1979) Birds of the Great Plains: Breeding Species and their Distribution. University of Nebraska Press, Lincoln, NE, USA. (enlace)
- Jones, H.L. & Vallely, A.C. (2001) Annotated Checklist of th Birds of Belize. Lynx Edicions. Barcelona; 71 pp.
- Kelly, N.E., Spaarks, D.W., De Vault, T. Y Rhodes, O.E. (2007) Diet of black and turkey vultures in a forested landscape. The Wilson Journal of Ornithology 119(2):267-270. (enlace)
- Kelly, T.R., P.H. Bloom, S.G. Torres, Y.Z. Hernandez, R.H. Poppenga, W.M. Boyce & C.K. Johnson (2011) Impact of the California lead ammunition ban on reducing lead exposure in Golden Eagles and Turkey Vultures. PLOS One 6(4): e17656. (enlace)
- Kempton, R.M. (1927) Notes on the home life of the Turkey Vulture. Wilson Bulletin 39:142-145. (enlace)
- Kerlinger, P. (1985) Water-crossing behavior of raptors during migration. Wilson Bulletin 97:109-113. (enlace)
- Kerlinger, P. & S.A. Gauthreaux (1985) Flight behavior of raptors during spring migration in south Texas studied with radar and visual observations. Journal of Field Ornithology 56:394-402. (enlace)
- Kiff, L.F., D.B. Peakall, M.L. Morrison & S.R. Wilbur (1983) Eggshell thickness and DDE residue levels in vulture eggs. In Vulture biology and management., edited by S. R. Wilbur and J. A. Jackson, 440-458. Berkeley: Univ. of California Press. (enlace)
- Kiff, L.F. (2000) The current status of North American vultures. Raptors at risk (2000): 175-189. (enlace)
- Kirk, D.A. (1988) Ecological separation of small Cathartid vultures in South America. Phd Thesis, Univ. of Glasgow, Glasgow, Scotland. (enlace)
- Kirk, D.A. & A.G. Gosler (1994) Body condition varies with migration and competition in migrant and resident South American vultures. Auk 111:931-942. (enlace)
- Kirk, D.A. & D.C. Houston (1995) Social dominance in migrant and resident vultures at carcasses: Evidence for a despotic distribution? Behavioral Ecology and Sociobiology 36:323-332. (enlace)
- Kirk, D.A. & J.E. . Currall (1994) Habitat associations of migrant and resident vultures in central Venezuela. Journal of Avian Biology 25:327-337. (enlace)
- Kirk, D.A., M.D. Evenden & P. Mineau (1996) Past and current attempts to evaluate the role of birds as predators of insect pests in temperate agriculture. Current Ornithology 13:175-264. (enlace)
- Kirk, D.A. & C. Hyslop (1998) Population status and recent trends in Canadian raptors; A review. Biological Conservation 83: 91–118. (enlace)
- Kirk, D.A. & M.J. Mossman (2020) Turkey Vulture (Cathartes aura), version 1.0. In Birds of the World (A. F. Poole and F. B. Gill, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.turvul.01
- Klimaitis, J.F. & F.N. Moschione (1986) Cartilla sistemática de las aves de la Reserva Integral de Selva Subtropical Marginal de Punta Lara y sus alrededores (Provincia de Buenos Aires).
- Klimaitis, J.F. & F. N. Moschione (1987) Aves de la Reserva Integral de Selva Marginal de Punta Lara y sus alrededores. Minist. Eco. Prov. Bs. Aires.
- Koester, F. (1982) Observations on migratory Turkey Vultures and Lesser Yellow-headed Vultures in northern Colombia. Auk 99:372-375. (enlace)
- Kovacs, C.J. (2006). Manual ilustrado de las aves de la Patagonia: Antártida Argentina e Islas del Atlántico Sur. Museo Ornitológico Patagónico. 368 pp. El Bolsón.
- Krauczuk, E.R. (2005) Aves do Inta-Campo Anexo ao Zaiman, e do Campus da Universidade Nacional de Misiones, Posadas, Misiones, Argentina. Atualidades Ornitológicas No 126: 1-22. (enlace)
- Krauczuk, E.R. (2008) Riqueza específica, abundancia y ambientes de las aves de Corpus Christi, San Ignacio, Misiones, Argentina. Lundiana: International Journal of Biodiversity, 9(1), 29-39. (enlace)
- Laubmann, A. (1930) Vögel en Wissenschaftliche Ergebnisse der Deutschen Gran Chaco-Expedition. Verlag von Strecker und Schröder, Stuttgart.
- Lemon, W.C. (1991) Foraging behavior of a guild of Neotropical vultures. Wilson Bulletin 103:698-702. (enlace)
- Lepage, D. (2003). Avibase-La base de datos World Bird; Jote Cabeza colorada (Cathartes aura) (Linnaeus, 1758). Recuperado de https://avibase.bsc-eoc.org/species.jsp?avibaseid=36B3872DAFE1EC1C el 19/01/2021.
- Ligon, J.D. (1967) Relationships of the Cathartid vultures. no. 651, Univ. of Michigan: Occas. Pap. Mus. Zool. (enlace)
- Linsdale, J.M. (1931) Facts concerning the use of thallium in California to poison rodents-the destructiveness to game birds, song birds, and other valuable wildlife. Condor 33:92-106. (enlace)
- Loftin, H. (1963) Notes on autumn bird migrants in Panama. Caribbean Journal of Science 3:63-68. (enlace)
- Loftin, H. & E.L. Tyson (1965) Stylized behavior in the Turkey Vulture’s courtship dance. Wilson Bulletin 77:193. (enlace)
- López-Lanús, B. (1997) Inventario de las aves del Parque Nacional “Río Pilcomayo” Formosa, Argentina. Monografía Especial L.O.L.A. No 4, 76 págs. Bs.As.
- López-Lanús, B., A.S. Di Giacomo, A. Azpiroz, P. Haynes, A. Galimberti, A. Keyel, A. Ocampo, R. Güller, R. Moller Jensen, M. Mattalia, H. Cardoso, C. Giarduz, G. Papini & A. G. Di Giacomo (2013) Inventario focal de fauna de las estancias La Higuera, María Concepción, La Serena y Virocay en el sitio piloto Aguapey: Corrientes, Argentina. En pp. 179-223/277-293/307-319/331-347/490,494-506: G.D. Marino, F. Miñarro, M.E. Zaccagnini & B. López-Lanús (eds.) Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- López-Lanús, B., A. Galimberti, C. Giarduz, H. Luna, M. Manassero, A.A. Pautasso, M. P. Ducommun, A.A.G. Saigo, P. Petracci, G.A. Marteleur & M.R. de la Peña (2013a) Inventario focal de fauna de las estancias El Estero, La Norma, El Matrero y La Elena en el sitio piloto San Javier: Santa Fe, Argentina. En pp. 135-169/277-306/331-347/507,511-513: G.D. Marino, F. Miñarro, M.E. Zaccagnini & B. López-Lanús (eds.) Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- López-Lanús, B., D. Unterkofler, U. Ornstein, V. del Sastre, R. Moller Jensen & P. Herrara (2013b) Diversidad y estado de conservación de las aves de los Bajos Submeridioles (AICA SF03): informe de Aves Argentinas/AOP para la Fundación Vida Silvestre Argentina; junio de 2009. En pp. 375-417: G.D. Marino, F. Miñarro, M.E. Zaccagnini & B. López-Lanús (eds.) Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- Lucero, F. (2013) Listado de las aves observadas en la Reserva Natural Municipal Articulada: Laguna de Guanacache, Laguna del Toro y Bañados del Carau, provincia de San Juan, y Laguna Seca y los Bañados del Tulumaya, provincia de Mendoza, Argentina. Nótulas Faunísticas (segunda serie), 137, 1-16. (enlace)
- Llanos, F.A., M. Failla, G.J. García, P.M. Giovine, M. Carbajal, P.M. González, D. Paz Barreto, P. Quillfeldt & J.F. Masello (2011) Birds from the andangered Monte, the Steppes and Coastal biomes of the province of Río Negro, northern Patagonia, Argentina. Check List. Vol. 7. (enlace)
- Maceda, J.J. & Kin, M.S. (2001a) Lista de las aves de la Facultad de Agronomía de Santa Rosa (La Pampa) y sus alrededores. Revista de la Facultad de Agronomía, 12: 21-30. (enlace)
- Maceda, J.J., Riesco, H., & DoIsan, M. (2001b) Lista de las aves de la reserva Parque Luro, La Pampa. Semiárida, 12(2), 47-59. (enlace)
- Maceda, J.J., J.H. Sarasola & M.E.M. Pessino (2003) Presas consumidas por el Águila coronada (Harpyhaliaetus coronatus) en el límite sur de su rango de distribución en Argentina. Neot.14(3): 419-422. (enlace)
- Malizia, L.R., Blendinger, P.G., Álvarez, M.E., Rivera, L.O., Politi, N., & Nicolossi, G. (2005) Bird communities in Andean premontane forests of Northwestern Argentina. Ornitologia Neotropical 16 (2):231-252 (enlace)
- Mallon, J.M., Swing, K., & Mosquera, D. (2013) Neotropical vulture scavenging succession at a capybara carcass in eastern Ecuador. Ornitol Neotrop, 24, 475-480. (enlace)
- Mandel, J.T., Bildstein, K.L., Bohrer, G. & Winkler, D.W. (2008) Movement ecology of migration in Turkey Vultures. Proceedings of the National Academy of Sciences USA 105(49): 19102-19107. (enlace)
- Manrique, J.C., Ortiz, S.G., Villavicencio, H.J. & Blanco, V. (2019) Estructura y abundancia de un ensamble de aves del Parque Provincial Presidente Sarmiento, San Juan Multequina, vol. 28, pp. 29-45, 2019 (enlace)
- Marateo, G., Povedano, H. & Alonso, J. (2009) Inventario de las aves del Parque Nacional El Palmar, Argentina. Cotinga, 31(1), 47-60. (enlace)
- Marelli, C.A. (1933) Aves observadas en el sur de la provincia de Buenos Aires. Hornero 5: 193-199. (enlace)
- Marone, L. (1992) Estatus de residencia y categorización trófica de las especies de aves en la Reserva de la Biosfera de Ñacuñán, Mendoza. Hornero, 13(3), 207-210. (enlace)
- Martínez, M.M., C.A. Darrieu & G.E. Soave (1997) The avifauna of Laguna Llancanelo (Mendoza, Argentina), a South American Wetland of internacional importance. Freshwater Forum.Volumen 9: 35-45. (enlace)
- Martínez Gamba, R. (2014) Lista de aves del Parque Natural Municipal Monte Seguín, Provincia de Misiones, Argentina. Nótulas Faunísticas. Segunda Serie. 163: 1-10. (enlace)
- Maslowski, K. (1934) An aerial nest of the Turkey Vulture. Auk 51:229-230. (enlace)
- Matarasso, H.F. (2007) Checklist. Aves del Neuquén. (enlace)
- McHargue, L.A. (1977) Nesting of Turkey and Black vultures in Panama. Wilson Bulletin 89:328-329. (enlace)
- Mehner, J.F. (1951) Turkey Vultures attacking Great Blue Heron. Wilson Bulletin 64:242. (enlace)
- Miatello, R., J. Baldo, M. Ordano, C. Rosacher & L. Biancucci (1999) Avifauna del Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala. Córdoba. Argentina. Secretaría de Agricultura, Ganadería y Recursos Renovables. Córdoba. Pp. 193.
- Miller, L. (1942) Succession in the cathartine dynasty. Condor 44:212-213. (enlace)
- Miskimen, M. (1957) Absence of syrinx in the Turkey Vulture (Cathartes aura). Auk 74:104-105. (enlace)
- Monroe, B.L., Jr. (1968) A distributional survey of the birds of Honduras. Ornithological Monographs 7. American Ornithologists’ Union, Washington, DC, USA. (enlace)
- Morris, H. (1912) Carrion feeders as disseminators of anthrax or charbon. State Univ. Agric. Exper. Sta. Bull. 136:1-16. (enlace)
- Moroni, M. & Salvador, S.A. (2014) Nido del Jote Cabeza Roja (Cathartes aura) en la Provincia de Chubut, Argentina. Nuestras aves 59:51-52 (enlace)
- Moschione, F. & Bishels, L. (2004) Listado de las aves del parque Provincial loro hablador, Provincia del Chaco. Informe técnico proyecto Elé/DFS.
- Moschione, F.N., & Segovia, J. (2005) Listado de las aves de la Reserva Natural Las Lancitas, Santa Bárbara, Jujuy. Informe técnico Proyecto Elé/DFS, Secretaría de Ambiente y Desarrollo Sustentable de la Nación.
- Moschione, F., O. Spitznagel & M. González (2012) Lista de Aves de Salta (Birds. Checklist). Ministerio de Cultura y Turismo. Salta. (enlace)
- Mossman, M.J. (1976) Turkey Vultures in the Baraboo Hills, Sauk County, Wisconsin. Passenger Pigeon 38:93-99. (enlace)
- Mossman, M.J. & L.M. Hartman (1992) Turkey Vulture nest records from Wisconsin. Passenger Pigeon 54:31-41. (enlace)
- Mote, W.R. (1969) Turkey Vultures land on vessel in fog. Auk 86:766-767. (enlace)
- Mueller, H.C. (1972) Zone-tailed Hawk and Turkey Vulture: mimicry or aerodynamics? Condor 74:221-222. (enlace)
- Mueller, H.C. (1976) Reactions of quail to flying vultures. Condor 78:120-121. (enlace)
- Mueller, H.C. & D.D. Berger (1967) Turkey Vultures attack living prey. Auk 84:430-431. (enlace)
- Narosky, T. & A. Martelli (1995) Una nueva visita al este de Formosa. Nuestras Aves 31: 28-29.
- Narosky, T. y A. G. Di Giacomo (1993) Las aves de la provincia de Buenos Aires, distribución y estatus. Asoc. Orn. del Plata. Vazquez Mazzini Editores, L.O.L.A., Buenos Aires
- Narosky, T., & Chebez, J.C. (2002) Guía para la identificación de las aves de Iguazú. Buenos Aires: Vázquez Mazzini. 128 pp.
- Narosky, T. & Yzurieta, D. (2010) Aves de Argentina y Uruguay: Guía de identificación (16º Ed.) Buenos Aires: Vázquez Mazzini Editores. 423 pp.
- Navarro, C.I., Brandán, Z.J., Antelo, C.M. & Marigliano, N.L. (2000) Avifauna invernal en una localidad del Bosque Chaqueño Serrano (Las Tipas, Tucumán, Argentina). Acta Zoológica Lilloana, 45(2), 233-240.
- Navarro, C.I. & Marigliano, N.L. (2006). Avifauna otoño-invernal en un sector de bosque Chaqueño Serrano (Trancas, Tucumán, Argentina). Acta Zoológica Lilloana, 50 (1-2), 55-60. (enlace)
- Navarro, C.I., Brandán, Z.J. & Marigliano, N.L. (2007) Lista comentada de las aves de un fragmento de la Reserva Provincial La Florida, Tucumán, Argentina. Acta zoológica lilloana, 51(2), 142-150. (enlace)
- Navarro, C.I., & Antelo, C.M. (2014) Comunidades de aves presentes en un área residencial suburbana y en un área ex-urbana en el Departamento Tafí Viejo (Tucumán, Argentina). Acta zoológica lilloana, 133-146. (enlace)
- Nellar Ramonella, M.M. (1993) Aves de la provincia de San Luis. Lista y distribución. Ed. Mus. Priv. Cienc. Nat. e Inv. Ornit. “G. E. Hudson”. San Luis. 98 pp.
- Nores, M., D. Yzurieta & R. Miatello (1983) Lista y distribución de las aves de Córdoba, Argentina. Boletín de la Academia Nacional de Ciencias de Córdoba. 56: 1-114.
- Nores, M., D. Yzurieta & S.A. Salvador (1991) Lista y distribución de las aves de Santiago del Estero, Argentina. Bol. Acad. Nac. Cs.Córdoba, 59: 157-196. (enlace)
- Nores, M. (1996) Avifauna de la provincia de Córdoba. Fauna 1: 255-337.
- Olivera, L.R. (2015) Reflejos en las aguas del Moconá. Naturaleza e Historia del Parque Provincial Moconá, su entorno y su gente. (1º Ed.) C.A.B.A. Fundación de Historia Natural Félix de Azara. 184 pp.
- Olrog, C.C. (1948) Observaciones sobre la avifauna de Tierra del Fuego y Chile. Acta Zool. Lilloana 5: 437-531. Tucumán.
- Olrog, C.C. (1959) Las Aves Argentinas. Una Guía de campo. Universidad Nacional de Tucumán. Instituto “Miguel Lillo”. Tucumán. Argentina. 343 pp.
- Olrog, C.C. (1979) Alarmante escasez de rapaces en el sur argentino. Hornero 012 (01): 082-084 (enlace)
- Olrog, C.C. (1979a) Nueva lista de la avifauna argentina. Opera Lilloana (XXVII): 324 pp.Tucumán. (enlace)
- Ordano, M. (1996) Estudio de una comunidad de aves altoserrana (Córdoba, Argentina) durante un ciclo anual. Rev. Asc. Cienc. Nat. Litoral 27 (2): 83-94. (enlace)
- Ortiz-Crespo, F.I. & Agnew, P. (1992) The birds of La Plata Island, Ecuador. Bull. Brit. Orn. Club. 112(2): 66–73. (enlace)
- Ortiz, G. & Murúa, F. (1994) Aves de ambientes acuáticos de la provincia de San Juan (Argentina) I. Multequina, núm. 3, 1994, pp. 125-131 (enlace)
- Ortiz, D. & Capllonch, P. (2007) Guía de los rapaces de la provincia de Tucumán. Tucumán, Argentina.
- Ortiz, D., Aráoz, R. & Alderete, C. (2011) Lista sistemática de las aves de la Reserva Experimental Horco Molle, provincia de Tucumán, Argentina. Nótulas Faunísticas, Segunda Serie, 62, 1-5. (enlace)
- Ortiz, D. & R. Aráoz (2014) Aves de la Sierra de San Javier. Universidad Nacional de Tucumán.
- Otley, H., Munro, G., Clausen, A. & Ingham, B. (2008) Falklands Islands State of the environment report.
- Owre, O.T. & P.O. Northington (1961) Indication of the sense of smell in the Turkey Vulture, Cathartes aura (Linnaeus), from feeding tests. American Midland Naturalist 66:200-205. (enlace)
- Pagano, L.G. & E. Mérida (2009) Aves del Parque Costero del Sur. Pp. 200–244, en: Athor J. (de) Parque Costero del Sur. Naturaleza, conservación y patrimonio cultural. Fundación de Historia Natural Félix de Azara, Buenos Aires, Argentina. (enlace)
- Pagano, L. G. & S. A. Salvador (2017) Datos de pesos de aves argentinas. Parte 4. Historia Natural 7:21–43. (enlace)
- Parmalee, P.W. (1954) The vultures: their movements, economic status, and control in Texas. Auk 71:443-453. (enlace)
- Partridge, W.H. (1953) Observaciones sobre aves de las provincias de Córdoba y San Luis. Hornero 010 (01): 033-073 (enlace)
- Paterson, R.L. (1984) High incidence of plant material and small mammals in the autumn diet of Turkey Vultures in Virginia. Wilson Bulletin 96:467-469. (enlace)
- Paz Barreto, D. (1997) Aves de la Provincia de Río Negro. II Localidades confirmadas. Consejo de Ecología y Medio Ambiente, Delegación Bariloche. 1-24. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Aura gallipavo · Cathartes aura · (Linnaeus, 1758); Recuperado el 19/01/2021 de https://www.xeno-canto.org/species/Cathartes-aura
- Pemberton, J.R. (1925) Voice of the Turkey Vulture. Condor 27:38. (enlace)
- Pereyra, J. A. (1950) Avifauna argentina (contribución a la ornitología). Hornero 009 (02) : 178-241 (enlace)
- Pérez, C.H.F. & P. Petracci (1998) Notas sobre la avifauna de la cuenca media y superior del Río Negro, Provincia de Río Negro, Argentina. X RAO: 38
- Peters, H.S. (1933) External parasites collected from banded birds. Bird-Banding 4:68-75. (enlace)
- Peters, H.S. (1936) A list of external parasites from birds of the eastern part of the United States. Bird-Banding 7: 9–27. (enlace)
- Piacentini, H., D. Paz Barreto & A. Wucusich (2003) Registro de Fauna zona de Reserva Cinco Chañares págs. 369-386, en Bajo del Gualicho, una planicie patagónica bajo el nivel del mar-Realidad y leyenda. Coord. R. F. Massera y J. C. Guarido. Secretaría de Estado de Acción Social de Río Negro 2003, págs. 1-416 (enlace)
- Pikula, J., Hajkova, P., Bandouchova, H., Bednarova, I., Adam, V., Beklova, M., … & Kizek, R. (2013) Lead toxicosis of captive vultures: case description and responses to chelation therapy. BMC Veterinary Research, 9(1), 1-10. (enlace)
- Pinto, O. (1965) Dos frutos da Palmera Elaeis guineensis na dieta de Cathartes aura ruficollis. Hornero 10: 276-277. (enlace)
- Platt, S.G. & Rainwater, T.R. (2009) Noteworthy observations of foraging Turkey Vultures. Wilson Journal of Ornithology. 121(4): 839-841. (enlace)
- Platt, S.G., Charruau, P. & Rainwater, T.R. (2014) Scavenging of crocodile eggs by vultures (Cathartes aura and Coragyps atratus) in Quintana Roo, Mexico. Bulletin of the Texas Ornithological Society 47(1–2): 37-40. (enlace)
- Prather, I.D., R.N. Conner & C.S. Adkisson (1976) Unusually large vulture roost in Virginia. Wilson Bulletin 88:667-668. (enlace)
- Prince, P.A. & Croxall, J.P. (1983) Birds of South Georgia: new records and re-evaluation of status. BAS Bulletins, 59, 15-27. (enlace)
- Prior, K.A. (1990) Turkey Vulture food habits in southern Ontario. Wilson Bulletin. 102(4): 706-710. (enlace)
- Prior, K.A. & P.J. Weatherhead (1991) Competition at the carcass – opportunities for social foraging by Turkey Vultures in southern Ontario. Canadian Journal of Zoology 69 (6):1550-1556. (enlace)
- Pruscini, F., Morelli, F., Perna, P., Mazzeo, R., Cavitolo, P., Bertellotti, M., … & Santolini, R. (2016). Roadside Raptor surveys in Valdes Peninsula (Patagonia, Argentina). El Hornero, 31(01), 007-011. (enlace)
- Pugnali, G., Ferrari, C., Rimoldi, C., Tagtachián, S., Pagano, L., Chiale, M.C. & Vitale, S. (2016) Lista de Aves de la Reserva Ecológica Costanera Sur. Bird Checklist (enlace)
- Purdue, J.R., C.C. Carpenter, D.L. Marcellini & R.F. Clarke (1972) Spring migration of Swainson’s Hawk and Turkey Vulture through Veracruz, Mexico. Wilson Bulletin 84:92-93. (enlace)
- Raffaele, H.A. (1989). A Guide to the Birds of Puerto Rico and the Virgin Islands. Princeton University Press, Princeton, NJ, USA. 254 pp.
- Raffaele, H.A., Wiley, J., Garrido, O.H., Keith, A., & Raffaele, J. (2003) Birds of the West indies. Princeton University Press. Princeton University Press, Princeton, NJ, USA.
- Raffaele, H.A., & Wiley, J. (2014) Wildlife of the Caribbean. Princeton University Press. Princeton University Press, Princeton, NJ, USA.
- Ramilo, E.J., Chehébar, C.E., & Mazzucchelli, S. (1993) Plan General de Manejo Parque Nacional Laguna Blanca Buenos. Aires: Administración de Parques Nacionales. (1993 y 2017)
- Rapp, Jr., W.F. (1943) Turkey vulture feeding habits. Auk 60:95. (enlace)
- Rea, A.M. (1983) Once a River: Bird Life and Habitat Changes on the Middle Gila. University of Arizona Press, Tucson, AZ, USA.
- Rea, A.M. (1973). Turkey vultures casting pellets. Auk 90:209-210. (enlace)
- Riba-Hernández, L., M. Akresh, D.A. Martínez & W. Hernández (2012) A nocturnal flight record of Swainson’s Hawks (Buteo swainsoni) and Turkey Vultures (Cathartes aura) during fall migration in Costa Rica. Journal of Raptor Research 46: 234-235. (enlace)
- Ridgely, R.S. & Gwynne Jr., J.A. (1989) A Guide to the Birds of Panamá, with Costa Rica, Nicaragua, and Honduras (2º Ed.) Princenton University Press. Princeton, NJ, USA. 534 pp.
- Rodriguez Estrella, R. (1994) Group size and flight altitude of Turkey Vultures in two habitats in Mexico. Wilson Bulletin 106:749-752. (enlace)
- Roesler, I., & Agostini, M.G. (2012) Inventario de los vertebrados de la Reserva Natural Punta Lara, Provincia de Buenos Aires, Argentina. (enlace)
- Roda, M.A. & C.F. Danti (2015) Nuevos registros de aves para Saladillo, provincia de Buenos Aires. Nuestras Aves 60:32-38. (enlace)
- Roig, V.G. (1965). Elenco sistemático de los mamíferos y aves de la provincia de Mendoza y notas sobre su distribución geográfica. Boletín de Estudios geográficos, (49). (enlace)
- Ruelas Inzunza, E., Goodrich, L.J. & Hoffman, S.W. (2010) North American population estimates of waterbirds, vultures and hawks from migration counts in Veracruz, Mexico. Bird Conservation International. 20(2): 124-133. (enlace)
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J., & Calo, J. (1996) Inventario de las aves del Parque Nacional “Iguazú”, Misiones, Argentina. Monografía, (9); 68 pp.
- Salvador, S. A. (1990) Nidificación de rapaces argentinos (Falconiformes y Strigiformes). Nuestras Aves 23:28–29
- Salvador, S.A, Salvador, L.A., Ferrari, C. & Vitale, S. (2016) Listado de Aves de la Provincia de Córdoba. Bird Checklist.
- Salvador, S.A., Salvador, L.A. & Ferrari, C. (2017) Aves de la Provincia de Córdoba, Argentina. Distribución e Historia Natural (1º Ed.), Buenos Aires
- Santana, E.C., G.A. Potter & S.A. Temple (1986) Status and seasonal patterns of abundance of Turkey Vultures in Puerto Rico. Journal of Field Ornithology, 57:235-238. (enlace)
- Sarasola, H., R.A. Sosa & J.J. Maceda (2000) A case of nest predation on Turkey Vulture nesting in Argentina. Raptor Res. 34 (1): 60. (enlace)
- Scherer-Neto, P., & Straube, F.C. (1995) Aves do Paraná: história, lista anotada e bibliografia. Curitiba: Ed. dos autores. (enlace)
- Schiavino, A. (2005) Isla de los Estados, Islas de Año Nuevo e Islotes Adyacentes: pp 463-464; en Di Giácomo, A.G., de Francesco, M. V. & Coconier, E. G. (2007) Áreas importantes para la Conservación de las Aves en la Argentina. Sitios prioritarios para la conservación de la Biodiversidad. Temas de Naturaleza y Conservación. (2007) Parte 2; Aves Argentinas/Asociación Ornitológica del Plata. Buenos Aires. 515 pp. (enlace)
- Schulenberg, T.S., Stotz, D.F., Lane, D.F., O’Neill, J.P., & Parker III, T.A. & Brack Egg, A. (2010) Birds of Peru: revised and updated edition. Princeton University Press. Princeton, NJ, USA.
- Scott, W.E.D. (1892) Observations on the birds of Jamaica, West Indies. Auk 9:369-375. (enlace)
- Semenchuk, G.P. (1992). The Atlas of Breeding Birds of Alberta. Federation of Alberta Naturalists, Edmonton, AB, Canada.
- Semenchuk, G.P. (2007). The Atlas of Breeding Birds of Alberta: a second look. Federation of Alberta Naturalists, Edmonton, AB, Canada.
- Sferco, G.D.& Nores, M. (2003) Lista comentada de las aves de la Reserva Natural Chancaní, Córdoba, Argentina. Hornero 018 (01): 021-029 (enlace)
- Short, L.L. (1971). Aves nuevas o poco comunes de Corrientes. Rev. Mus. Argent. Cienc. Nat.“Bernardino Rivadavia” Inst. Nac. Invest. Cienc. Nat. Zool, 9, 283-309. (enlace)
- Sick, H. (1997) Ornitologia Brasileira. Ediciones Nova Fronteira, Rio de Janeiro, Brasil
- Siegenthaler, G. (1984) Avifauna de la Laguna Don Tomás y espejos de agua contiguos, Santa Rosa, La Pampa. V Reunión Argentina de Ornitología, Libro de Resúmenes.
- Siegenthaler, G., Fiorucci, E., Tiranti, S., Borraz, P., Urioste, M. & García, A. (1990) Informe de avance del plan de relevamiento de los vertebrados de la provincia de La Pampa. Agro Pampeano, Ministerio de Asuntos Agrarios de La Pampa, 18: 38-49
- Siegenthaler, G.B. (coordinador) (2004) Relevamiento de vertebrados de la provincia de La Pampa. En: Inventario integrado de los recursos naturales de la provincia de La Pampa. INTA, UNLPam. Subsecretaría de Cultura de La Pampa, CD – multimedia.
- Slud, P. (1964) The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History 128: 1–430. (enlace)
- Smith, N.G. (1980) Hawk and vulture migrations in the neotropics. In Migrant birds in the neotropics: ecology, behavior, distribution, and conservation., edited by A. Keast and E. S. Morton, 51-65. Washington, D.C: Smithsonian Inst. Press. (enlace)
- Smith, N.G. (1985) Dynamics of the transisthmian migration of raptors between Central and South America. In Conservation studies in raptors., edited by I. Newton and R. D. Chancellor, 271-290. ICBP Tech. Publ. no. 5. (enlace)
- Smith, S.A. & R.A. Paselk (1986) Olfactory sensitivity of the Turkey Vulture (Cathartes aura) to three carrion-associated odorants. Auk 103:586-592. (enlace)
- Smith, A.R. (1996) Atlas of Saskatchewan Birds. Saskatchewan Natural History Society Special Publications 22, Regina, SK, Canada. (enlace)
- Snyder, N.F.R. & J.W. Wiley (1976) Sexual size dimorphism in hawks and owls of North America. Ornithological Monographs 20. (enlace)
- Sosa, H.J. (1999) Descripción del evento reproductivo del Flamenco austral (Phoenicopterus chilensis) en Laguna Llancanelo, Malargüe, Mendoza. Multequina 8: 87-99. (enlace)
- Souza Petersen, E., Petry, M.V. & Krüger-Garcia, L. (2011) Utilização de diferentes hábitats por aves de rapina no sul do Brasil. Revista Brasileira de Ornitologia. 19(3): 376-384. (enlace)
- Stager, K.E. (1964) The role of olfaction in food location by the Turkey Vulture (Cathartes aura). Los Angeles County Mus. Contrib. Sci. No 81:1-63. (enlace)
- Steullet, A.B. & E.A. Deautier (1935) Catálogo sistemático de las aves de la República Argentina. Obra del Centenario del Museo de La Plata. Univ. Nac. de La Plata. Tomo 1 (1o entrega): 1-256.
- Stewart, P.A. (1977) Migratory movements and mortality rate of Turkey Vultures. Bird-Banding 48:122-124. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker III, T.A., & Moskovits, D.K. (1996) Neotropical birds: ecology and conservation. University of Chicago Press.
- Stresemann, E. & D. Amadon (1979). Order Falconiformes. In Check-list of the Birds of the World (E. Mayr and G. W. Cottrell, Editors). Museum of Comparative Zoology, Cambridge, MA, USA. pp. 271–425. (enlace)
- Sweeney, T.M. (1984) Black and Turkey Vulture roost dynamics, marking, morphology and nesting in Virginia. Master’s Thesis, Virginia Polytechnic Inst. and State Univ., Blacksburg, VA. (enlace)
- Sweeney, T.M. & J.D. Fraser (1986) Vulture roost dynamics and monitoring techniques in southwest Virginia. Wildlife Society Bulletin 14:49-54. (enlace)
- Tabor, S.P. & C.T. McAllister (1988) Nocturnal flight by Turkey Vultures (Cathartes aura) in southcentral Texas. Journal of Raptor Research 22:91. (enlace)
- Taylor, D.M. (1986) Turkey Vulture decline at a traditional roost. Great Basin Naturalist 48:305-306. (enlace)
- Tejerina, P., Turnes, M. J. & Tiranti, S. L. (2006) Aves. En: F. Salomone y N. Gouts (eds), Los Vertebrados de las Áreas Protegidas de la Provincia de La Pampa. Ed. Santa Rosa, La Pampa, Argentina
- Temple, S.A. (1969) A case of Turkey Vulture piracy on Great Blue Herons. Wilson Bulletin 81:94. (enlace)
- Tenney, M.K. (1986) A life history study of Turkey Vultures along the root river valley in Fillmore County, Minnesota. Master’s Thesis, St. Cloud Street Univ., St. Cloud, MN. (enlace)
- Thomaides, C., R. Valdez, W.H. Reid & R.J. Raitt (1989) Food habits of Turkey Vultures in West Texas. Journal of Raptor Research 23:42-44. (enlace)
- Thompson, W.L., R.H. Yahner & G.L. Storm (1990) Winter use and habitat characteristics of vulture communal roosts. Journal of Wildlife Management 54:77-83. (enlace)
- Travaini, A., Rodriguez, A., Ceballos, O., Donazar, J. A., & Hiraldo, F. (1995) Roadside raptor surveys in central Argentina. El Hornero, 14 (01 y 02), 064-066. (enlace)
- Tyler, W.M. (1937) «Cathartes aura septentrionalis, Wied. Turkey vulture.» In Life histories of North American birds of prey, edited by A. C. Bent, 12-28. U.S. Natl. Mus. Bull. 167. (enlace)
- Valelly, A.C. & Dyer, D. (2018) Birds of Central America: Belize, Guatemala, Honduras, El Salvador, Nicaragua, Costa Rica, and Panama. Princeton University Press. Princeton, NJ, USA.
- Van Tyne, J. & M.B. Trautman (1945) Migration records from Yucatan. Wilson Bulletin 57:203-204. (enlace)
- Vera, A.S. (2002) Lista de aves de San Miguel de Tucumán y Yerba Buena. Acta zoológica lilloana, 46 (1), 131-135. (enlace)
- Vides Almonacid, R. (1992) Estudio comparativo de las taxocenosis de aves de los bosques montanos de la Sierra de San Javier, Tucumán: bases para su manejo y conservación. Trabajo de Tesis Doctoral no publicada. Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán. 347 pp.
- Vogel, Jr., H.H. (1950) Observations on social behavior in Turkey Vultures. Auk 67:210-216. (enlace)
- Wace, R. (1921) Lista de aves de las Islas Falkland. Hornero 002 (03): 194-204 (enlace)
- Wallace, M.P. & S.A. Temple (1987) Competitive interactions within and between species in a guild of avian scavengers. Auk 104:290-295. (enlace)
- Wallace, M.P., P.G. Parker & S.A. Temple (1980) An evaluation of patagial markers for cathartid vultures. Journal of Field Ornithology 51:309-314. (enlace)
- Wells, J.V., Wells Ch.A. & Dean, R. (2017) Birds of Aruba, Bonaire, and Curacao: A Site and Field Guide. Cornell University Press;
- Wetmore, A. (1926) Observations on the birds of Argentina, Paraguay, Uruguay and Chile. United States Nat. Mus. Bull. 133: 1-448 (enlace)
- Wetmore, A. (1964). A revision of the American vultures of the genus Cathartes. Smithson. Misc. Coll; 146 (6). (enlace)
- Wink, M. (1995) Phylogeny of Old and New World vultures (Aves: Accipitridae and Cathartidae) inferred from nucleotide sequences of the mitochondrial cytochrome b Zeitschrift fuer Naturforschung 50c:868-882. (enlace)
- Woods, R. W. (1988) Guide to the birds of the Falkland Islands. Anthony Nelson, Oswestry.
- Work, T.H. & A.J. Wool (1942) The nest life of the Turkey Vulture. Condor 44:149-159. (enlace)
- Wotzkow, C. & J.W. Wiley (1988) Turkey vulture surveys in Cuba. Journal of Raptor Research 22:3-7. (enlace)
- Wright, A.L., R.H. Yahner & G.L. Storm (1986) Roost-tree characteristics and abundance of wintering vultures at a communal roost in south central Pennsylvania. Raptor Research 20:102-107. (enlace)
- Yahner, R.H., G.L. Storm & A.L. Wright (1986) Winter diets of vultures in southcentral Pennsylvania. Wilson Bulletin 98:157-160. (enlace)
- Yzurieta, D. (1995) Manual de reconocimiento y evaluación ecológica de las aves de Córdoba. Argüello, Argentina: Mterio. de Agricult., Ganadería y Rec. Renovables. 438 pp.
-
-
Jote cabeza colorada | Conservación
Esta especie tiene un rango extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). La tendencia de la población parece estable, por esto esta especie no alcanza los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población es extremadamente grande, por lo tanto esta especie no se aproxima a los umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como de “preocupación menor” (Stotz, 1996:142)
En Argentina:
CARPFS-NA: No amenazada según CARPF (Consejo Asesor Regional Patagónico de la Fauna Silvestre) Recalificación del estado de conservación de la Fauna Silvestre 1ra. edición
AvA-SADS-NA: No amenazada según AvA SAyDS 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable) López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina 1 ed. AOP: Buenos Aires, Argentina
Res 348 SA-NA: No Amenazada según SAyDS Res 348 (Secretaría de Ambiente y Desarrollo Sustentable) Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina 2010.
-
Jote cabeza colorada | Distribución
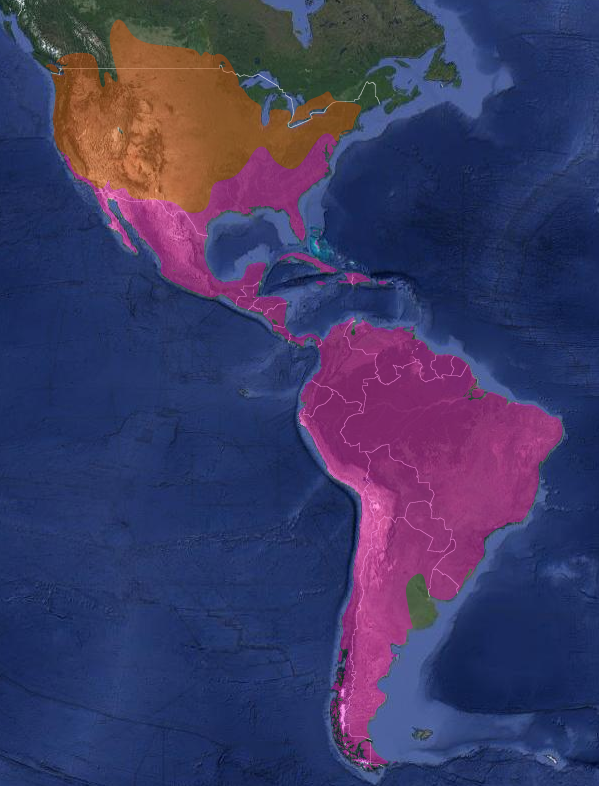
InfoNatura: Animals and Ecosystems of Latin America 2007 
Se distribuye desde Canadá (donde nidifica desde el sur de Columbia Británica, sur de Prairies – en el oeste de Canadá, incluyendo la porción canadiense de las grandes praderas y las provincias de Alberta, Saskatchewan, y Manitoba-, sur de Ontario y norte de Nueva Inglaterra) hacia el sur, hasta México, América Central y Sudamérica hasta Tierra del Fuego e Islas Malvinas. Pasa el invierno desde centro de California, sur de Arizona y Nuevo México, Texas, y sur de Nueva Jersey (Stotz, 1996:142); (Raffaele, 1989). En Centroamérica nidifica también en la mayoría de las islas, como Isla Margarita (Venezuela), Trinidad, Bahamas, Cuba e Isla de Pinos, Jamaica, República Dominicana y Puerto Rico (Raffaele, 1989).
En Argentina: (De la Peña, 1999:37); (De la Peña, 2015:139); (De la Peña & Salvador, 2016:152); (Barnett & Pearman, 2001:30); (Olrog, 1959:74)
- Cathartes aura ruficollis (von Spix, 1824), en las provincias de: Formosa, Chaco, Corrientes, Misiones, Entre Ríos y Santa Fe. (Enlaces a citaciones y coordenadas)
- Cathartes aura jota (Molina, 1782), Jujuy, Salta, Tucumán, Santiago del Estero, Catamarca, La Rioja, San Juan, Mendoza, Córdoba, San Luis, La Pampa, y sur de Buenos Aires, Neuquén, Río Negro, Chubut, Santa Cruz, Tierra del Fuego, Isla de los Estados e Islas del Atlántico Sur. Nidifica en las Islas Malvinas (Carma, 2009:97) (Enlaces a citaciones y coordenadas)
HÁBITAT
Según el autor (Kiff, 2000:176), en Norteamérica su hábitat preferido para alimentarse incluye cultivos (Graber & Graber, 1963:464) y bosques, aunque para nidificar prefiere áreas forestadas, aisladas de los humanos y tal vez de los depredadores (Coleman & Fraser, 1989b:34).
Para el descanso comunitario, prefiere árboles grandes alejados del ser humano, preferiblemente en zonas altas (colinas, montañas) que le proporcionen corrientes de aire ascendente para volar, especialmente en el norte de EEUU, donde las térmicas pueden ser débiles e impredecibles (Coleman & Fraser, 1989b:16); (Mossman & Hartman, 1992:39); observado también a orillas de carreteras en Pennsylvania (Bunn et al., 1995:544)
En Puerto Rico, más frecuente en bosque seco subtropical y menos común en bosque subtropical y bosque húmedo (Santana et al., 1986b:236)
Desde el nivel de mar hasta los 4.300 msnm (Kiff, 2000:176); (Stotz, 1996:142)MIGRACION
Las poblaciones del este de EEUU en su mayor parte pasan el invierno al sur del país, mientras que las del oeste migran hacia el sur, a Centroamérica hasta Paraguay (Brown & Amadon, 1968); (Kiff, 2000:176); (Brown, 1976:911); (Purdue et al, 1972:92); (Smith, 1985:273); (Van Tyne & Trautman, 1945:203); Esto demuestra que muestran diferencias en su migración, algunos individuos migran grandes distancias, otros cortas o permanecen sedentarios (Kirk, 1988:3)
Los autores (Bussjaeger et al., 1967:425), observaron durante los meses de marzo y abril grandes bandadas migrantes de C. aura sobre Veracruz, al igual que Ruelas-Inzunza et al. (2010:124); bandadas similares fueron avistadas durante el otoño en Panamá por Loftin, (1963:64); Cayos de Florida, (Darrow, 1983:36) en el mes de noviembre. Muchas veces migran en bandadas mixtas inmensas (C. atratus, C.aura y unos pocos buteos (Hicks et al., 1966:123) y Costa Rica (Riba- Hernández et al., 2012:234)
El vuelo del C. Aura involucra en su mayoría las corrientes térmicas (Bohrer et al. 2012). Cuando migran no es frecuente que desciendan a tierra en América Central, excepto en las malas condiciones de vuelo.
Se privan de alimento durante mucho tiempo en las migraciones de largas distancias (Bildstein 2006), y en promedio requieren hasta 40 días para recuperar la pérdida de masa corporal cuando llegan a Venezuela (Kirk and Gosler, 1994:941); (Hedlin et al., 2013:149)
En las zonas con población estable durante todo el año, el uso del hábitat puede variar, por ej. pasan más tiempo en zonas sin carreteras, o aumentan el uso de zonas urbanas (Gaby, 1982); y los residentes pueden cambiar su hábitat habitual en respuesta al flujo de migrantes.
En los llanos de Venezuela, los migrantes invernales de C. a. meridionalis prefieren hábitats abiertos o semi-abiertos (sabanas, zona de matorrales, humedales abiertos) más que bosques en galería y semi-deciduos, mientras que el residente C. ruficollis restringe su área de alimentación durante este periodo, mayoritariamente a los bosques en galería y aparentemente se mueven hacia zonas más abiertas cuando los migrantes se van (Kirk & Currall, 1994:332); (Kirk, 1988:10); (Kirk, & Houston, 1995:323) -
Jote cabeza colorada | Comportamiento
Pasa la mayor parte del día buscando carroña, volando a alturas moderadas. Localizan la carroña con el olfato y la vista (Applegate, 1990:141), (Bang & Cobb, 1968:58); según Bang (1972:153), el bulbo olfatorio es más grande cuando se compara con los hemisferios cerebrales del C. atratus. Se los ha registrado, de forma aislada, cazando peces y animales vivos, generalmente por estar enfermos o discapacitados. Los estudios demuestran que comen carroña de presas más pequeñas que el C. atratus.
Se posa en árboles muertos, sin follaje, o en estructuras artificiales como torres de agua (Clark & Schmitt, 2017:92-93). Suelen hacerlo en grandes grupos, aunque durante el día buscan alimentos de forma independiente.
Pasa la noche en grupos comunitarios (pudiendo agruparse varios cientos de buitres para pasar la noche), a veces incluso con Jotes Cabeza Negra (Coragyps atratus) (Davis, 1979:124); (Buhnerkempe & Westemeier, 1984:496; (Clark & Schmitt, 2017:92-93)
A pesar de que anida en cuevas, no entra en ellas para descansar, excepto durante la época de reproducción. Durante la noche, reduce su temperatura corporal cerca de 6 grados centígrados hasta 34º C, volviéndose ligeramente hipotérmico. (Hatch, 1970:111); (Heath, 1962:234)
Frecuentemente posa con las alas extendidas. Se cree que esta postura cumple con múltiples funciones: secar las alas, calentar el cuerpo y combatir bacterias, sobre todo después de noches lluviosas o húmedas (Clark & Ohmart, 1985:353). El mismo comportamiento es observado en otros buitres americanos, buitres del Viejo Mundo, y cigüeñas. A menudo defeca sobre sus propias patas como medio para disipar el calor tras la evaporación del líquido contenido en las heces y la orina, un proceso conocido como urohidrosis (Hatch, 1970:111) De esta forma enfría los vasos sanguíneos que pasan por las patas y pies y causa manchas blancas por el ácido úrico que cubre las piernas. Cuando se encuentran expuestos a alta temperatura ambiente, controlan su temperatura extendiendo el cuello, desplegando las alas y mediante la urohidrosis (Arad & Bernstein, 1988:917); Arad et al. (1989:505), demostraron la extensa vascularización de la piel en la cabeza implume, cuello, nuca y pies; significa que los C. aura tienen un muy bien desarrollado sistema arterio-venoso intercambiador de calor en la cabeza, alas y patas (Arad et al., 1989:514)
Requiere de un gran esfuerzo para alzar el vuelo, batiendo sus alas mientras salta. El vuelo activo es lento, con aleteos profundos (cuando inclinan las alas hacia abajo, algunas veces tocan las puntas de las alas (Clark & Schmitt, 2017:92-93); (Mueller, 1972:221). Se elevan y planean con las alas en “V” (diedro). Las alas largas y anchas, y sus colas relativamente cortas están bien adaptadas para el vuelo planeado sobre la horizontal, balanceándose frecuentemente de un lado a otro (De la Peña & Salvador, 2016:151); (Narosky & Yzurieta, 2010:90); es un ejemplo de vuelo estático, aprovechando térmicas para mantener su altitud, a veces durante horas, sin necesidad de batir sus alas. Se desplaza en el suelo, con saltos torpes y muy desgarbados.
El C. aura tiene pocos depredadores naturales. Pueden caer presa de águilas reales, águilas, y búhos cornudos. Los huevos y polluelos pueden caer presa de mamíferos tales como mapaches y zorros. Su principal forma de defensa es regurgitar carne semi-digerida, una sustancia maloliente que irrita los ojos, con la que logra disuadir a la mayoría de las criaturas con intenciones de asaltar un nido de buitres. Un buitre también puede verse obligado a regurgitar una comida semi-digerida para deshacerse rápidamente del peso en su buche y poder tomar vuelo con el fin de huir de un depredador potencial. (Forbush, 1927: 91); (Vogel, 1959:213). No defienden su territorio.
VOCALIZACIONESComo la mayoría de los buitres, carecen de complejidad en las vocalizaciones. Producen gruñidos y silbidos principalmente para disuadir a los depredadores.
Pemberton (1925:38) las describe así, “Emiten una voz distintiva nasal, un quejido de tono bajo, suave y repetido a intervalos de 3 segundos y que semeja a los quejidos de los cachorritos”; el autor hace notar que no abren el pico cuando emiten sonidos.
Según Allard (1934:515), antes de emprender vuelo emiten varias notas peculiares, comenzando con un corto, «tschuck, tschuck», repetido varias veces y seguido una nota quejosa que repite 2 á 3 veces. A continuación despegan y vuelan.
ALIMENTACIÓNBusca alimento utilizando su sentido del olfato, un sentido compartido con los demás buitres del género Cathartes, pero poco común en el mundo de las aves. Localiza carroña al detectar el olor del etilmercaptano, un gas producido al inicio de la descomposición en los animales muertos. El lóbulo olfativo de su cerebro, responsable del procesamiento de los olores, es particularmente grande en comparación con otros animales. Se sabe que el Cathartes aura posee un sistema olfatorio anatómicamente bien desarrollado y fisológicamente funcional. Estudios anatómicos comparativos indican que, el tamaño relativo del bulbo olfatorio del C. aura es ocho veces más grande que el de 108 especies estudiadas por Bang & Cobb (1968:58); (Smith & Paselk, 1986:586)
Los seres humanos también aprovechan del sentido del olfato de los buitres americanos: se inyecta etilmercaptano en los oleoductos, y a continuación los ingenieros en busca de fugas monitorizan los vuelos de los buitres que buscan alimento.
Con su sentido del olfato superior tiene ventajas en la localización de la carroña y suele ser el primero en llegar a ella (Houston, 1986:318); (Houston, 1988:130); (Stager, 1964:3). Sin embargo, a pesar de su superior habilidad para detectar comida, los C. aura tienen pocas oportunidades de consumir los cadáveres de animales que descubren porque, los C. atratus frecuentemente se apropian de la comida. Las diferentes estrategias de alimentación de las dos especies se reflejan perfectamente en la altura a la que vuelan. El C. aura vuela cerca del suelo, donde la percepción olfatoria es más fuerte y sus posibilidades de encontrar cadáveres pequeños es mayor, mientras que el C. atratus busca comida volando más alto u observando los individuos que descienden, como señal para localizar las carcasas (Buckley et al., 1996:485); (Wallace et al.,1987:293); (Lemon, 1991:700).
Los C. aura pueden desgarrar carcasas de pequeño y mediano tamaño, pero no pueden con las de gran tamaño. Si ellos consiguen llegar a las carcasas pequeñas antes que otras especies, pueden obtener alimento sin interactuar con otros especímenes más dominantes que llegan más tarde. Aunque los C. aura individualmente son dominantes sobre un solo C. atratus, son intimidados los grupos de C. atratus, que a menudo suelen ser muy numerosos (50 individuos) (Wallace et al., 1987:293)
Es muy raro que los C. aura compartan la comida entre ellos y son reticentes a comer cerca de otros individuos (< 2m). Alimentarse en grandes grupos parece ser menos eficiente en los C. aura. Parece que defienden áreas a distancias mínimas unos de otros, en los sitios de alimentación. Las distancias individuales podrían ser mantenidas a través del reconocimiento pasivo del estatus social, reivindicando su posición dominante con picoteos amenazantes y más raramente con peleas. Estos actos o demostraciones agresivas pueden interferir con la alimentación del agresor (Prior et al., 1991:1555).
Se alimenta principalmente de una amplia variedad de carroña, desde pequeños mamíferos a herbívoros grandes (Coleman & Fraser, 1987:733); (de la Peña & Salvador, 2016:151); (Di Giacomo, 2005); (Salvador et al., 2017:103); (Hiraldo et al., 1991:321); (Prior, 1990:709), prefiriendo los recién muertos (Lemon, 1991:702), y evitando los cadáveres que han llegado al punto de putrefacción (Owre & Northington,1961:200). Raramente se alimenta de materia vegetal (vegetación de ribera, calabazas u otros cultivos), y de insectos vivos y otros invertebrados (Crafts Jr., 1968:327); (Paterson, 1984:469). (Pinto (1965:276), lo observó alimentándose de frutos de Palmera (Elaeis guineensis)
Se ha observado a los C. aura y C. atratus consumiendo huevos de tortugas verdes (Chelonia mydas) (Fowler, 1979:946) y a los C. aura alimentándose de huevos en colonias de aves marinas (Kirk and Mossman, 2020), de cocodrilo americano (Crocodylus acutus) (Platt et al., 2014:39) y de phoenicopterus chilensis (Sosa, 1999:95)
Es poco común que cace y mate a sus presas (Galding & Glading, 1970:244); (Mueller & Berger, 1967:431). Hamilton (1941:254), comenta que el ataque de Cathartes aura a unas crías de cerdos, cerca de Fort Myers (Florida), pudo haber sido un “caso de error de identificación” (Parmalee, 1954:443). A menudo se le puede observar a lo largo de las carreteras (Rea, 1973:210), alimentándose de los cadáveres de animales atropellados, o cerca del agua, alimentándose de peces varados en bancos a orillas de ríos (Jackson et al, 1978:142); (Platt et al., 2009:840). Al igual que otros buitres, desempeña un papel importante en su ecosistema, librando al ambiente de la carroña que de otro modo podría producir enfermedades.
Los autores (Coleman et al.,1985:291), mientras estudiaban los hábitos alimenticios de los Cathartes, los observaron comiendo sal a 4 km al sur de Gettysburg (Pennsylvania).
REPRODUCCIÓNA menudo, el apareamiento entre los C. aura, es precedido por una especie de danza gregaria: varios individuos se juntan en el suelo de un claro, rodeando a una hembra; realizan movimientos de salto con las alas extendidas en todo el perímetro del círculo; un individuo salta hacia su vecino, el cual a continuación salta y se aproxima a un tercero, etc, mientras, otros buitres posados en árboles cercanos bajan para sumarse a la “danza”, mientras otros “bailarines” se retiran (Loftin & Tyson, 1965:193). También realizan vuelos de cortejo, lanzándose o persiguiéndose entre sí.
No construyen nido. Depositan los huevos en cuevas pequeñas, sobre el piso, bajo vegetación espesa, e incluso en edificios y coches abandonados (Igl & Peterson, 2010:73). Tiene más cuidado en la elección del sitio que en la construcción del mismo (Coles, 1944:222)
El Cathartes aura septentrionalis, por el contrario, tiene una mayor diversificación en la elección de sitios para anidar. Se han encontrado nidos en acantilados, así como, en pantanos, cuevas, laderas abruptas o escondidos en ciénagas saladas. Ubica sus nidos en bosques, arbustos y matorrales, a lo largo de cursos de agua y en estructuras abandonadas (Coles, 1944:219); (Sarasola, 2000:60)
Moroni et al. (2014:51-52), comenta: “El Jote Cabeza Roja nidifica en forma variada en nuestro país: en huecos de árboles (Hartert & Venturi 1909, de la Peña 2005), entre rocas (Sarasola et al. 2000), en el suelo debajo de arbustos (De Lucca et al. 2012), en la base de matas de paja y en ocasiones en cuevas (Woods 1988)”.
Se reproducen una vez al año. El inicio de la temporada reproductiva varía dependiendo de la latitud en que permanece. En el norte del área de distribución se inicia entre principios de marzo hasta junio
Las hembras suelen poner dos huevos (con diferencia de 1 día), aunque la puesta puede variar entre uno y tres huevos. Huevos ovoides, blanquecinos, blancos grisáceos o verdosos con manchas castañas oscuras y pintas grises, más concentradas en el polo mayor. Algunos con pocas pintas y manchas. (Coles, 1944:223); (De la Peña, 2013:87)
La incubación se inicia una vez que está completa la puesta. Ambos padres participan en la incubación, que dura entre 30-40 días (Coles 1944:227). Los periodos de incubación más cortos reportados son de 32 días (Gentry, 1882) y Audubon, 1835); 30 días (Burns, 1937), (Jackson, 1903) y (Kempton, 1927); (Coles, 1944:224).
Crías altriciales, nacen ciegos, desnudos e indefensos. Durante unas 10 u 11 semanas, cuidan de los polluelos y les dan de comer regurgitando. Cuando los adultos están amenazados mientras anidan, pueden regurgitar sobre el intruso, fingir la muerte, o huir del nido. Si los polluelos se ven amenazados en el nido, se defienden silbando y regurgitando. Los polluelos permanecen en el nido durante 9 a 10 semanas. Los grupos familiares permanecen juntos hasta el otoño.
Argentina: Aunque es una especie ampliamente distribuida en el continente americano (Bendire, 1892:163), su rango de reproducción en Argentina no es bien conocido. Se localizaron nidos en Mendoza, Santa Fe, Tucumán, Formosa, Misiones, La Pampa, Córdoba, Neuquén, Río Negro, Chubut, Tierra del Fuego e Islas Malvinas, en los meses, octubre, noviembre y diciembre (De la Peña & Salvador, 2016:151); (De la Peña, 2013:87); (De la Peña & Bodrati, 2019:3-4)
Se citan los registros de nidificación conocidos:
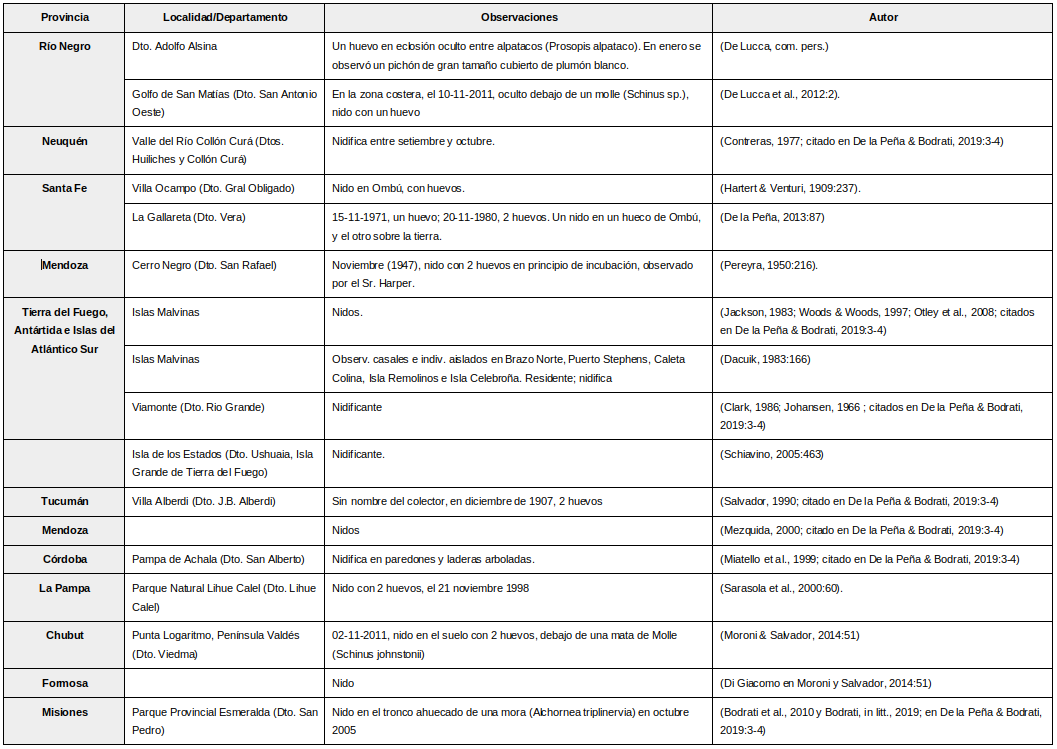
-
Jote cabeza colorada | Descripción

© Hoffman, D.A. Turkey vultur (Cathartes aura). Sonoma County, California. Julio 2018. Algunos derechos reservados 
© Mike Baird. Turkey Vulture (Cathartes aura). Morro Bay, California. Marzo 2008. Algunos derechos reservados. Ambos sexos son idénticos en plumaje y coloración, aunque la hembra es ligeramente más grande (Snyder & Wiley, 1976:57); (Gaby, 1982)
Todas las plumas son marrón oscuro; manto, remeras terciarias y secundarias con los bordes más claros; las plumas oscuras especialmente sobre la nuca y zona superior del lomo con iridiscencias azules, púrpura o verdes. Remeras, timoneras y tapadas parecen plateadas por debajo porque los raquis ventralmente son blanquecinos. Carecen de plumón de talco (Rea, 1983). Las alas son largas. Planea en “V” sobre la horizontal.
La cola es larga, angosta, rectangular, sobresale con relación a las patas cuando vuela o está asentado y a su vez no es sobrepasada por las alas plegadas. (De la Peña & Salvador, 2016:152)
La cabeza es pequeña en proporción al cuerpo. El color de piel de la cabeza y el cuello puede variar de rosado a rojo brillante. Cabeza y cuarto distal del cuello desnudos, con cerdas negruzcas o rojizas brillantes sobre la cera. La piel de la nuca y corona es corrugada transversalmente, permitiendo la extensión del cuello y que el collar de plumas se retraiga durante la alimentación y acicalamiento. Papilas blancas, a menudo concentradas en frente del ojo y a través de la frente.
Las fosas nasales no están separadas por un tabique, sino que están perforadas. Carece de siringe (Miskimen, 1957:104).
El ojo tiene una sola fila incompleta de pestañas en el párpado superior y dos filas en el párpado inferior. Iris beige o marrón hasta marrón oscuro (mucha variación)
Pico relativamente corto, ganchudo, de color marfil.
Las patas son de color rosado, a menudo con manchas blancas por los excrementos. Los dedos delanteros de los pies son largos y tienen pequeñas membranas interdigitales en sus bases. Las garras son planas, relativamente débiles y poco adaptadas a agarrar ya que son relativamente romas (Kirk & Mossman, 2020)
Anualmente pasa por una muda gradual que se inicia a finales del invierno hasta inicios de la primavera y que dura hasta principios del otoño. En los adultos generalmente es completa, finalizando con las 3 primarias internas (Kirk & Mossman, 2020); (Clark & Schmitt, 2017:93)
Las remeras y timoneras mudan a lo largo del año, pero esto se reduce, aparentemente, o se suspende durante la migración (Kirk & Mossman, 2020)
No se sabe exactamente qué edad puede alcanzar. La esperanza de vida máxima registrada en C. auras es de 16 años (Clapp et al., 1982:103). En cautiverio es más elevada, en general 21 años, aunque existe un ejemplar en Minnesota con una edad confirmada de 34 años (Kirk & Mossman, 2020)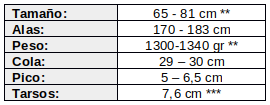
* (Wetmore, 1964:2); ** (de la Peña & Salvador, 2016:150); *** (Aráoz et al., 2016:346) -
Jote cabeza colorada | Taxonomía

* Los Jotes o Buitres americanos integrantes de esta familia son elevados a un orden separado: Cathartiformes. Propuesta aceptada por el SACC (South American Classification Committee) Subespecies y Distribución:
La diferenciación entre las taxonomías de las subespecies está mal definida por diferencias en el tamaño (largo de alas y cola) y la coloración, incluyendo plumaje y piel desnuda de cabeza y cuello. Se reconocen al menos (dependiendo de las diferentes autoridades) 6 subespecies: (Stresemann & Amadon, 1979:275); (Friedmann, 1950:34); (Wetmore, 1964:2); (Brown & Amadon, 1968:173);(Bildstein, 2017:5-6); (Clark, 2017:91)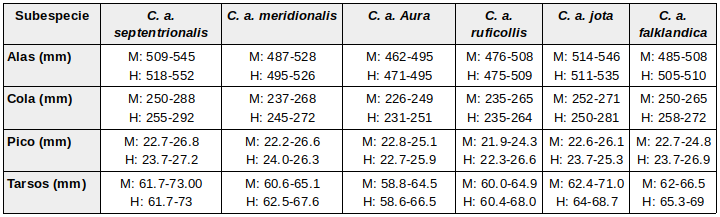
Dimensiones; adaptado de Wetmore (1964:1-18) Fisher (1943:72-73), estudió la “pterylosis” de los cathartidae (distribución de las plumas sobre el cuerpo del ave – Erritzoe et al., 2007:213), demostrando que la pterylosis de cada género tiene ciertas particularidades, que el autor resume en la siguiente tabla:
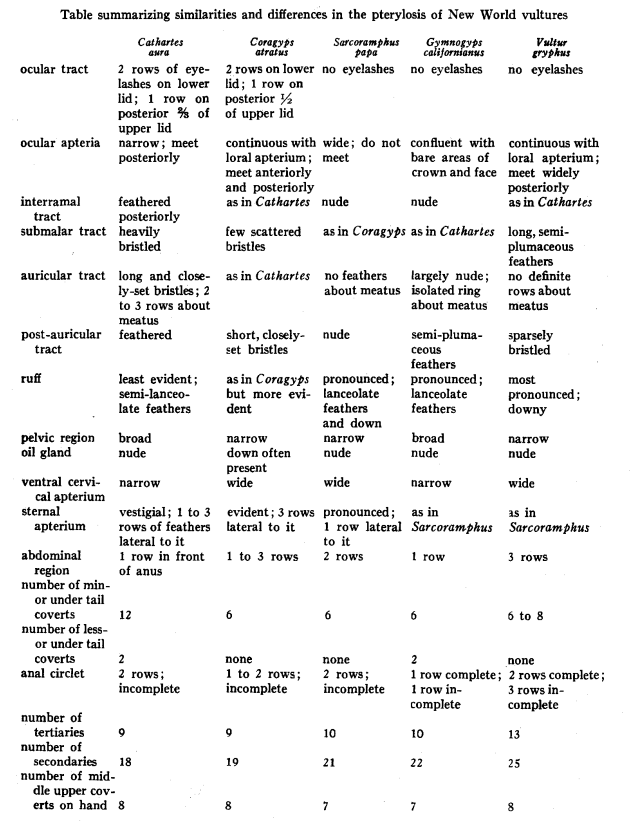

© Snowmanradio. Turkey Vulture (Cathartes aura aura). Jalpan de Serra, Querétaro, México. Agosto 2009. Algunos derechos reservados C. a. aura (Linnaeus, 1758); es la subespecie nominal. Su área de distribución se extiende desde México, América Central, América del Sur y Antillas Mayores y de vez en cuando se superpone al de otras subespecies. Se reproduce en sur de California, sur de Nevada, Arizona, Nuevo México y sur de Texas hasta Costa R y también Antillas Mayores. Durante el invierno hasta sur de México y Panamá. Más pequeño que el meridionalis, alas y cola más cortas aunque las medidas se solapan considerablemente; Rea (1983), midió los huesos de las alas en ejemplares de Arizona y concluye que el meridionalis reemplaza al aura en invierno; la distinción entre estos dos grupos es muchas veces arbitrario y algunos autores agrupan al meridionalis con el aura (Wetmore, 1964:6); (Hellmayr & Conover, 1949:8). Los especímenes identificados como aura por Burleigh, (1938:520) fueron refutados por Wetmore; las medidas de los migrantes del sur de Florida coinciden mejor con septentrionalis, mientras que los residentes son intermedios entre septentrionalis y aura (Gaby, 1982)

© Frank Schulenburg. Turkey vulture (Cathartes aura septentrionalis) at Las Gallinas Wildlife Pond, Marin County, California. Octubre 2017. Algunos derechos reservados. C. a. septentrionalis (Wied-Neuwied, 1839); se distribuye desde el sureste de Canadá hacia el sur por el este de Estados Unidos. Es menos migratoria que C. a. meridionalis y raramente migra más allá del sur de los Estados Unidos (las poblaciones del norte emigran hacia el sur en invierno). Se reproduce en oeste de Norte América a Minnesota, Kansas, Oklahoma, y este de Texas. De gran tamaño y bordes de cubiertas alares más pálidos, anchos y más prominentes que las otras subespecies; remeras secundarias distales también con bordes y puntas castaños más pálidos que las otras subespecies. Papila facial generalmente prominente.

© Frank Schulenburg. (Cathartes aura meridionalis). Tomales Bay, Marin County, California. Diciembre 2014. Algunos derechos reservados C. a. meridionalis (Swann, 1921); C. a. meridionalis, es un sinónimo de C. a. teter (Friedman, 1950:45). Es la subespecie que cubre más distancia durante su migración anual, hasta llegar a América del Sur (Brasil y Paraguay) donde se superpone al área de distribución de C. a. aura. Se reproduce al este de Norte América hacia el sur de Manitoba y sur y centro de Texas. De menor tamaño que el septentrionalis y cola similar; final de las cubiertas alares menores y final y puntas de las remeras secundarias de color marrón. Las cubiertas alares pueden desteñirse al final del verano en las regiones áridas. Papila facial presente en su distribución este y ausente en la porción oeste del rango. Se solapa con septentrionalis a lo largo de una franja desde Michigan hasta Minnesota en el norte hasta este de Texas en el sur. Las medidas y patrón facial de los residentes locales en el sur de Wisconsin son semejantes al septentrionalis, pero el patrón de migración semeja al meridionalis.
.

© Barloventomagico. Oripopo [Turkey Vulture] (Cathartes aura ruficollis)
Lugar: El Paraíso, centro-norte de Venezuela. Junio 2013. Algunos derechos reservadosC. a. ruficollis (Spix, 1824); se distribuye de Panamá hacia el sur hasta Uruguay y Argentina. También se encuentra en la isla de Trinidad. De plumaje más oscuro que las subespecies del norte; bordes marrón oscuro en las cubiertas alares, y a lo largo del vexilo externo de las remeras secundarias que es mucho más restrictivo y aún ausente en las subespecies del norte (Hellmayr & Conover, 1949:8). Líneas transversas verdosas-blanquecinas distintivas en corona posterior y nuca (en vuelo semejante a un collar blanco).

© Bernd Dietrich. Gallinazo Cabeza Roja Austral (Cathartes aura ssp. jota). Ica, Perú. Mayo 2017. Algunos derechos reservados C. a. jota (Molina, 1782); grande (similar el septentrionalis); plumaje negruzco, un poco más marrón y pálido que el ruficollis; bordes de remeras secundarias gris-pálido que a veces se extienden a las cubiertas alares; cabeza roja. Residente en las tierras bajas desde centro y sur de Colombia hasta sur de Argentina, solapándose con ruficollis en el sur de Colombia y noroeste de Paraguay. (Hellmayr & Conover, 1949:10); (Wetmore, 1964:9).

© GRID-Arendal. Turkey vulture (Cathartes aura falklandica). Islas Malvinas. Febrero 2017. Algunos derechos reservados C. a. falklandica (Sharpe, 1873); residente en la costa del Pacífico desde Ecuador y Perú hasta sur de Chile e Islas Malvinas (Blake, 1977); (Hellmayr & Conover, 1949:10); similar, aunque más pequeño que, C. a. jota, pero con los bordes grisáceos de las remeras más extendido. (Wetmore, 1964:10)
Las especies más parecidas son: el Cathartes burrovianus de México y Centro y Sudamérica (posado muestra puntas de las alas que sobrepasan la punta de la cola). En vuelo, tiene las alas proporcionalmente más largas y los adultos cabeza amarilla-azulada; con el C. melambrotus de Sudamérica, semejante al C. burrovianus en el color de la cabeza, aunque es más grande y robusto, cola más larga y ancha, plumaje negro brillante con vuelo más estable (Clark & Schmitt, 2017:93). El Coragyps atratus también es similar al C. Aura, pero ligeramente más pequeño, cabeza gris oscura-negra, cola y alas mucho más cortas con parches blancos en la base de las remeras primarias; vuelo con aleteo más rápido. (Kirk & Mossman, 2020)
-
Jote cabeza colorada (Cathartes aura)

Histoire naturelle des oiseaux de l’Amérique Septentrionale (Vieillot et al,1807) Vol 1: 25 (Vultur aura); Lámina 2bis Etimológicamente Cathartes deriva del griego kathartes “purificador.” El nombre de la especie, aura, posiblemente derive del latín aurum, “dorado,” tal vez por el color de la cabeza de los especimenes de museos (Clark & Schmitt, 2017:93)
NOMBRES COMUNES: Jote cabeza colorada (Argentina y Chile); Urubú de cabeza roja (Brasil); Guala cabecirroja (Colombia); Zopilote cabecirrojo (Costa Rica); Aura o Aura tiñosa (Cuba, República Dominicana y Puerto Rico); Zope (El Salvador); Cute (Honduras); Zopilote, Aura, Aura cabecirroja, Aura común (México); Zopilote cabecirrojo (Nicaragua); Noneca (Panamá); Cuervo cabeza roja (Paraguay, Uruguay); Gallinazo cabeza roja (Perú); Oripopo (Venezuela). El nombre común recomendado por la Sociedad Española de Ornitología es Aura gallipavo
Otros: Acabirai. Acabiray. Acá-piraí. Águila cabeza pelada. Águila de cabeza pelada. Aura. Buitre.Buitre de cabeza colorada. Choia. Choia acavirái. Choya. Come perros. Congo. Congo cabeza colorada. Congo come perros Cuervo. Cuervo cabeza y cuello rojos. Cuervo cuello rojo. Cuervo de cabeza colorada. Cuervo de cabeza roja. Cuervo de cabeza rosada. Cuervo de las Malvinas. Cuervo de cabeza y cuello colorados. Cuervo grande de cabeza rosada. Cuervo real. Faja paja.Gallinazo de cabeza colorada. Irivú. Irivú-ministro. Jote. Jote cabecirrojo. Jote chico. Jote cabeza colorada. Jote de cabeza roja. Jote menor. Jote menor de cabeza colorada. Jote negro. Kote. Lleku. Maru. Oripopo. Pajá-pajá. Pala-pala. Pavo cabeza roja. Sapiné. Tungo. Urubú-pitá. Viuda. Zamuro cabecirrojo. Zopilote (De la Peña & Salvador, 2016:150); (Chébez, 1996:122)EN OTROS IDIOMAS
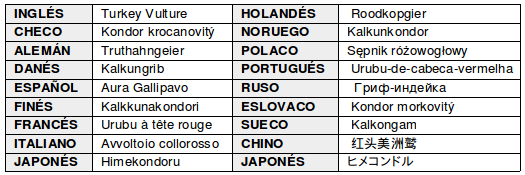
NOTA ANTROPOLÓGICA
Según la Dra. Cebolla Badie (2000:85) en su trabajo de investigación “El conocimiento mbya-guaraní de las aves. Nomenclatura y clasificación”, Uruvu: Jote de cabeza colorada (Cathartes aura): “Es más poderoso que el de cabeza negra. Se usan sus lágrimas o las de cualquiera de las especies de jote, se dice uruvu rechâîkui, es para prevenir techâ rachy (dolor de vista) en recién nacidos, itu’i ramo’i va’e, se saca con un trapo las lágrimas del uruvu que previamente se ha atrapado en una trampa y se le pasa la bebé en los párpados. Si no se pueden obtener las lágrimas se utiliza la grasa del ave. También sirve para prevenir los futuros dolores de muela en los niños. Y se utilizan uruvu ipoâ penguêi, es decir las garras del uruvu, como amuleto para prevenir las enfermedades en los niños, porque el uruvu nunca tiene enfermedades (Rudy de Jejy)”BREVES APUNTES HISTÓRICOS
- Histoire naturelle de la Caroline, la Floride, & les Isles Bahama. Catesby, Mark, Royal Society (Great Britain). London: Printed at the expence of the author, and sold by W. Innys and R. Manby, at the West End of St. Paul’s, by Mr. Hauksbee, at the Royal Society House, and by the author, at Mr. Bacon’s in Hoxton,MDCCXXXI-MDCCXLIII [i.e. 1729-1747]. Vol 1 (1729-1732): 6 (The turkey Buzzard)
- Ornithologie, ou, Méthode contenant la division des oiseaux en ordres, sections, genres, especes & leurs variété. Brisson, Mathurin-Jacques, Martinet, François Nicolas. Parisiis: Ad Ripam Augustinorum, apud Cl. Joannem-Baptistam Bauche, bibliopolam, ad Insigne S. Genovesae, & S. Joannis in Deserto, 1760. Tomo 1 (1760): 468 (Le vautour du Brésil)
- A general synopsis of birds. Latham John, London: Printed for Benj. White, 1781-1785. Vol 1 (1781): 9 (Vultur aura)
- Histoire naturelle. Buffon, Georges Louis Leclerc, comte de, La Cépède, M. Paris: P. Didot l’ainé et Firmin Didot, an VII-XII, 1799-1804. Vol 39: 244 (ouroua). Lámina 187
- Histoire naturelle des oiseaux de l’Amérique Septentrionale : contenant un grand nombre d’espèces décrites ou figurées pour la première fois Vieillot, L. P. Langlois, Pierre Gabriel, printer, Prêtre, Jean Gabriel, ill. Paris: Chez Desray: 1807. Vol 1 (1807): 25 (Vultur aura); Lámina 2bis
- Systematic natural history. Shaw, George, Griffith, Mrs, engraver. Heath, Charles, engraver. Stephens, James Francis. London, Printed for G. Kearsley, 1800-1826. Vol 7, pt 1-2 (1809): 36 (American vulture)
- A general history of birds. Latham, John . Winchester [England]: Printed by Jacob and Johnson (1821-1828); Vol 1: 12-13
- American ornithology, or the natural history of the birds of the United States. Wilson, Alexander, Bonaparte, Charles Lucien, JJ, Constable, A. (Edinburgh), Hurst, Thomas (Londen). Edinburgh: pr. for Constable; 1831.. Vol 1: 3 (Cathartes aura)
- La galerie des oiseaux. Vieillot, L. P. (Louis Pierre); Paris: Carpentier-Méricourt, 1834. Tomo I: pág. 14
- Illustrations of the American ornithology of Alexander Wilson and Charles Lucian Bonaparte. Edimburgh: Frazer & Co.; 1835. Lámina II (Cathartes aura)
- Avium species novae, quas in itinere annis MDCCCXVII-MDCCCXX per Brasiliam. Spix, Johann Baptist von, Martius, Karl Friedrich Philipp von, Schmidt, Matthias, ill. Monachii: Impensis editores, 1838-1839. Pág. 2 (Cathartes aura)
- American ornithology. Wilson, Alexander, Baird, Spencer Fullerton, Bonaparte, Charles Lucian. Philadelphia: Porter & Coates, [1871]. Vol 1-2 (Atlas-c2)(1871): Lámina 75
- Catalogue of the Birds in the British Museum. British Museum (Natural History). Department of Zoology. London,1874-98. Vol 1 (1874): 25 (Œnops aura)
- Biologia Centrali-Americana: zoology, botany and archaeology. Godman, Frederick Du Cane. London: Published for the editors by R. H. Porter, 1879-1915. Aves v.3: 134 (Cathartes aura)
-
Jote cabeza amarilla | Bibliografía
- Administración de Parques Nacionales. S.I.B. Ficha: Cathartes burrovianus. Recuperado el 10/01/2021 de https://sib.gob.ar/especies/cathartes-burrovianus
- Amadon, D. (1977) Notes on the taxonomy of vultures. The Condor, 79(4), 413-416. (enlace)
- ArgentAvis (s.f.) Ficha: Cathartes burrovianus. Recuperado el 19/01/2021 de http://argentavis.com.ar/2012/sitio/especie.php?id=952de
- Azpiroz, A., M. Mattalia, B. López-Lanús & L. L. Sosa. (2013) Caracterización ornitológia y productiva del campo “Gral Ávalos” Monte Caseros, Corrientes, informe técnico de Aves Argentinas/AOP: diciembre 2010. En pp. 351-373: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- Barnett, J.M. & Pearman, M. (2001) Lista Comentada de las Aves Argentinas (1º Ed.). Lynx Edicions. Barcelona.
- Batista-da-Silva J. & Souza A. (2014) Complementary Diet of Cathartes burrovianus (Cathartidae) With Fruit Elaeis guineensis Arecaceae. Journal of Agricultural Science; Vol 6, N 11; pp 58-62 (enlace)
- Beavers, R.A., Delaney, D.J., Leahy, C.W. & Oatman, G.F. (1991) New and noteworthy records from Petén, Guatemala, including Tikal National Park. Bull. Brit. Orn. Club. 111(2): 77–90. (enlace)
- Belton, W. (1984). Birds of Rio Grande do Sul, Brazil. Part 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History 178(4):369–636. (enlace)
- Binford, L.C. (1989) A distributional survey of the birds of the Mexican state of Oaxaca. Ornithological Monographs number 43. (enlace)
- BirdLife International (2021) Species factsheet: Cathartes burrovianus. Downloaded from http://www.birdlife.org on 13/02/2021.
- Birkhead, T., Wimpenny, J. & Montgomerie, B. (2014) Ten Thousand Birds. Published by Princeton University Press. 518 pp.
- Blake, E.R. (1977) Manual of Neotropical birds (Vol. 1). University of Chicago Press.
- Bodrati, A. & A. Pietrek (2000) Relevamiento de los recursos biológicos del Parque Provincial “Pampa del Indio” (Departamento Libertador Gral. San Martín, Chaco). AOP. Inf. Inéd. Buenos Aires.
- Burgos, F. G., Baldo, J. L., & Cornell, F. M. (2009) Lista de las Aves de la Provincia de Jujuy, Argentina. Secretaría de Turismo y Cultura de Jujuy. SS de Jujuy. (enlace)
- Cano, P.D., Del Huerto M del C. & Ball, H.A (2011) Guía de Aves de Mburucuyá, Corrientes, Argentina (1º Ed. Tucumán: Fundación Miguel Lillo; 96 pp. (enlace)
- Capllonch, P., Lobo, R., Ortiz, D., & Ovejero, R. (2005) La avifauna de la selva de galería en el noreste de Corrientes, Argentina: Biodiversidad, Patrones de Distribución y Migración. Miscelánea, 14, 484. (enlace)
- Coconier, E.G. (ed.) (2007) Las aves silvestres de Acambuco, provincia de Salta, Argentina. Relevamiento de un AICA prioritaria de la selva Pedemontana. Temas de Naturaleza y Conservación 6: 1-127. Aves Argentinas/AOP, Buenos Aires. (enlace)
- Colombo, M.A., & Segura, L.N. (2018) Southernmost record of Yellow-headed Vulture, Cathartes burrovianus Cassin, 1845 (Cathartiformes, Cathartidae), in Buenos Aires province, Argentina. Check List, 14(4), 671. (enlace)
- Contreras, J.R. (1981) Lista preliminar de la avifauna correntina. I. No Passeriformes. Historia Natural 2:21-28.
- Contreras, J. (1987) Lista preliminar de la avifauna de la Provincia de Formosa, República Argentina. Historia Natural 7, 33-52.
- Contreras, J.R., Berry, L.M., Contreras, A.O., Bertonatti, C.C. & Utges, E.E. (1990) Atlas Ornitogeográfico de la Provincia del Chaco – República Argentina. Vol. 1. No Passeriformes. Cuadernos Técnicos “Félix de Azara” 1. 164 pág.
- Contreras J.R., Agnolin F., Davies Y.E., Godoy I., Giacchino A. & Ríos E. (2014) Atlas Ornitogeográfico de la Provincia de Formosa, República Argentina: I No-passeriformes. (1º Ed.) Vázquez Mazzini Editores; Fundación de Historia Natural Félix de Azara, C.A.B.A. Argentina; 450 pp. (enlace)
- Chatellenaz, M.L. (2005) Aves del Valle del Río Paraná en la Provincia del Chaco, Argentina: riqueza, historia natural y conservación. Insugeo, Miscelánea 14: 527-550. (enlace)
- Chatellenaz, M.L., Cano, P.D., Saibene, C., & Ball, H.A. (2010) Inventario de las aves del Parque Nacional Mburucuyá (Provincia de Corrientes, Argentina). Acta zoológica lilloana, 139-160. (enlace)
- Chebez, J.C. (1996) Fauna misionera, catálogo sistemático y zoogeográfico de los vertebrados de la provincia de Misiones (Argentina). Monografía No 5. Págs. 320. Ed. L.O.L.A. Bs.Aires
- Chebez, J.C., Rey, N.R., Babarskas, M., & Di Giacomo, A.G. (1998) Las aves de los Parques Nacionales de la Argentina. Administración de Parques Nacionales y Asociación Ornitológica del Plata, Buenos Aires, Argentina.
- Chester, S.R. (2008) A wildlife guide to Chile: continental Chile, Chilean Antarctica, Easter Island, Juan Fernández Archipelago (1º Ed.) Princeton University Press. 392 pp.
- de la Peña, M.R. (1996) Nuevos registros o aves poco citadas para las provincias de Santa Fe y Entre Ríos, Argentina. Hornero 014 (03) : 087-089 (enlace)
- de la Peña, M.R. (1999) Aves argentinas. Lista y distribución. Monografía (18) L.O.L.A (Literature of Latin America), Buenos Aires
- de la Peña, M.R. (2006) Lista y distribución de las aves de Santa Fe y Entre Ríos. Monografía (16) L.O.L.A (Literature of Latin America), Buenos Aires
- de la Peña, M.R. (2015) Aves Argentinas (1º Ed.); Santa Fé. Ediciones UNL; CABA: EUDEBA.Vol.1
- de la Peña M.R., & Salvador S. (2016) Aves Argentinas: Descripción, comportamiento, Reproducción y Distribución. Ciconiidae a Heliornithidae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie), 19 (2):156-159. (enlace)
- del Hoyo, J. (2020) All the Birds of The World. Lynx Ed. Barcelona; 966 pp
- Di Giacomo, A.G. (2005) Aves de la Reserva El Bagual. In Historia Natural y Paisaje de la Reserva El Bagual, Provincia de Formosa, Argentina (A. G. Di Giacomo and S. Krapovickas, Editors). Temas de Naturaleza y Conservación 4. Aves Argentinas, Buenos Aires, Argentina. pp. 201–465. (enlace)
- Dresser, H.E. (1865) Notes on the birds of southern Texas. Ibis 7: 312-330. (enlace)
- EcoRegistros (2015); Ficha: Jote Cabeza Amarilla (Cathartes burrovianus); Recuperado el 10/01/2021 de http://www.ecoregistros.org/ficha/Cathartes-burrovianus&idusuario=1639
- Eitniear, J.C. (1985) Notes on the relative abundance and distribution of the Lesser Yellow-headed Vulture in Mexico and Belize, Central America. Birds of Prey Bulletin 2: 17-20. (enlace)
- Eitniear, J.C. (2015) Developmental stages of the Lesser Yellow-headed Vulture (Cathartes Burrovianus). Bull. Texas Ornith. Soc, 48, 1-2. (enlace)
- Eitniear, J.C., & S.M. McGehee (2017) Lesser Yellow-headed Vulture Mandibular Ecomorphy and Feeding Interactions at an Established Feeding Site in Belize. Texas Journal of Science 69:37-46. (enlace)
- Eitniear, J.C. (2020) Lesser Yellow-headed Vulture (Cathartes burrovianus), version 1.0. In Birds of the World (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.lyhvul1.01
- Enciclopedia Británica (1998) Vol 15; Macropedia: Birds: 1-108
- Ferguson-Lees, J. & D.A. Christie (2001) Raptors of the World. Christopher Helm, London, United Kingdom.
- Fraga, R.M. (2001) The avifauna of Estancia San Juan Poriahú, Iberá Marshes, Argentina: checklist and some natural history notes. Cotinga, 16(2001), 81-86. (enlace)
- Friedmann, H., & F.D. Smith Jr. (1950) A contribution to the ornithology of northeastern Venezuela. Proceedings of the United States National Museum. (enlace)
- Giai, A.G. (1950) Notas de viajes. Por el norte occidental de Santa Fe y por el norte de Misiones. Hornero 9: 121-164. (enlace)
- Ginzburg, R., Moli, J., Brown, A., Acerbi, M., & Corcuera, J. (2005) Ecorregion chaco húmedo: situación ambiental en el Chaco Húmedo. La situación ambiental Argentina, 2005, 103-129. (enlace)
- Giraudo, A.R., J.L. Baldo & R.R. Abramson (1993) Aves observadas en el sudeste, centro y este de Misiones (República Argentina) con la mención de especies nuevas o poco conocidas para la provincia. Nótulas Faunísticas 49: 1-13. (enlace)
- Giraudo, L., Kufner, M., Torres, R., Tamburini, D., Briguera, V. & Gavier, G. (2006) Avifauna del bosque chaqueño oriental de la Provincia de Córdoba, Argentina. Ecología Aplicada, 5(1-2), 127-136. (enlace)
- Giraudo, A. R., Bortoluzzi, A., & Arzamendia, V. (2006a) Vertebrados tetrápodos de la Reserva y Sitio Ramsar “Esteros del Iberá”(Corrientes, Argentina): Análisis de su composición y nuevos registros para especies amenazadas. Natura Neotropicalis, 37(1-2), 1-20. (enlace)
- Global Raptor Information Network (2014) Species account: Lesser Yellow-headed Vulture Cathartes burrovianus. Downloaded from Global Raptor Information Network on 2 September 2014. http://www.globalraptors.org/grin/SpeciesResults.asp?specID=8026
- Gorleri, F., M.C. Gorleri. & M. Murdoch (2011) Aves de la Reserva de Biosfera Laguna Oca, Formosa, Argentina. Universidad Nacional de Formosa/SPU Programa de Voluntariado Universitario. Ideas Gráficas. Formosa. (enlace)
- Graber, R.R. & J.W. Graber (1954) Yellow-headed vulture in Tamaulipas, Mexico. Condor 56: 165-166. (enlace)
- Hartert, E. & S. Venturi (1909) Notes sur les oiseaux de la République Argentine. Novit. Zool. 16: 159-267. (enlace)
- Hatch, D.E. (1970) Energy conserving and heat dissipating mechanisms of the Turkey Vulture. The Auk, 111-124. (enlace)
- Hellmayr, C.E. & B. Conover (1949) Catalogue of birds of the Americas. Part I, number 4. Field Museum of Natural History Zoological Series volume 13, part 1, number 4. (enlace)
- Hilty, S.L., Brown, W.L. & Brown, B. (1986) A guide to the birds of Colombia. Princeton University Press. 996 pp.
- Hilty, S.L. (2003) Birds of Venezuela. Princeton University Press (2º Ed.). 875 pp
- Houston, D.C. (1988) Competition for food between Neotropical vultures in forest. Ibis, 130(4), 402-417. (enlace)
- Hutton, J. & Schimff, S. (2001) Lista de Aves. Parque Nacional Mburucuyá. Delegación Regional Nordeste Argentino, Administración de Parques Nacionales, Puerto Iguazú.
- Kirk, D. (1988) The Ecology of Small Cathartid Vultures. PhD thesis, Glasgow University. (enlace)
- Kirk , D.A., & M.J. Mossman (1998) Turkey Vulture (Cathartes aura). In A. Poole and F. Gill [ EDS .], The birds of North America, No. 339. The Birds of North America, Inc., Philadelphia, PA.
- Koester, F. (1982) Observations on migratory Turkey Vultures and Lesser Yellow-headed Vultures in northern Colombia. Auk 99: 372-375. (enlace)
- Krauczuk, E.R. (2005) Aves do Inta-Campo Anexo ao Zaiman, e do Campus da Universidade Nacional de Misiones, Posadas, Misiones, Argentina. Atualidades Ornitológicas No 126: 1-22. (enlace)
- Krauczuk, E.R. (2008-2009) Riqueza específica, abundancia y ambientes de las aves de Corpus Chriti, San Ignacio, Misiones, Argentina. Lundiana 9 (1): 21-31. (enlace)
- Laubmann, A. (1930) Vögel en Wissenschaftliche Ergebnisse der Deutschen Gran Chaco-Expedition.Verlag von Strecker und Schröder, Stuttgart. 333 pp.
- Lemon, W.C. (1991) Foraging behavior of a guild of Neotropical vultures. Wilson Bull. 103(4): 698–702. (enlace)
- Lepage, D. (2003) Avibase-La base de datos World Bird; Ficha: Aura sabanera (Cathartes burovianus, Cassin, 1845); Recuperado el 19/01/2021 de https://avibase.bsc-eoc.org/species.jsp?avibaseid=4807686BED3992FB
- López-Lanús, B. (1997) Inventario de las aves del Parque Nacional “Río Pilcomayo” Formosa, Argentina. Monografía Especial L.O.L.A. No 4, 76 págs. Bs.As
- López-Lanús, B., A. S. Di Giacomo, A. Azpiroz, P. Haynes, A. Galimberti, A. Keyel, A. Ocampo, R. Güller, R. Moller Jensen, M. Mattalia, H. Cardoso, C. Giarduz, G. Papini & A. G. Di Giacomo (2013a) Inventario focal de fauna de las estancias La Higuera, María Concepción, La Serena y Virocay en el sitio piloto Aguapey: Corrientes, Argentina. En pp. 179-223/277-293/307-319/331-347/490,494-506: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- López-Lanús, B., A. Galimberti, C. Giarduz, H. Luna, M. Manassero, A.A. Pautasso, M.P. Ducommun, A.A.G. Saigo, P. Petracci, G.A. Marteleur & M.R. de la Peña (2013b) Inventario focal de fauna de las estancias El Estero, La Norma, El Matrero y La Elena en el sitio piloto San Javier: Santa Fe, Argentina. En pp. 135-169/277-306/331-347/507,511-513: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- López-Lanús, B., D. Unterkofler, U. Ornstein, V. del Sastre, R. Moller Jensen & P. Herrara (2013c) Diversidad y estado de conservación de las aves de los Bajos Submeridioles (AICA SF03): informe de Aves Argentinas/AOP para la Fundación Vida Silvestre Argentina; junio de 2009. En pp. 375-417: G. D. Marino, F. Miñarro, M. E. Zaccagnini y B. López-Lanús (eds.). Pastizales y sabanas del cono sur de Sudamérica: iniciativas para su conservación en la Argentina. Temas de Naturaleza y Conservación, Monografía de Aves Argentinas No 9. Aves Argentinas/AOP, Fundación Vida Silvestre Argentina e Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. (enlace)
- Marateo, G., Povedano, H., & Alonso, J. (2009) Inventario de las aves del Parque Nacional El Palmar, Argentina. Cotinga, 31(1), 47-60. (enlace)
- McCrary, J.K., Arendt, W.J., Chavarría, L., López, L.J., Somarriba, P.A., Boudrault, P.-O., Cruz, A.L., Muñoz, F.J. & Mackler, D.J. (2009) A contribution to Nicaraguan ornithology, with a focus on the pine–oak ecoregion. Cotinga. 31: 72–78. (enlace)
- Martínez-Sánchez, J.C., Chavarría-Duriaux, L., & Muñoz, F.J. (2014) A Guide to the Birds of Nicaragua-Una Guia de Aves. Westarp Verlagsservicegesellschaft mbh.
- Márquez, C., Bechard, M. Gast, F. & Vanegas, V.H. (2005) Aves rapaces diurnas de Colombia. Instituto de Investigación de Recursos Biológicos «Alexander von Humboldt”. (1º Ed.), Bogotá, Colombia. 394 pp
- Matteucci, S. (2012) Ecorregión Pampa. Ecorregiones y complejos ecosistémicos argentinos, 391-446. (enlace)
- Monroe, B. L. Jr. (1968). A Distributional Survey of the Birds of Honduras. Ornithological Monographs American Ornithologists’ Union, Washington, D.C. 458 pp. (enlace)
- Moschione, F., Spitznagel, O., & González, M. (2012) Lista de Aves de Salta (Birds Checklist). Ministerio de Cultura y Turismo, Salta. (enlace)
- Narosky, S. (1983) Registros nuevos o infrecuentes de aves argentinas. Hornero, 2, 122-126. (enlace)
- Narosky, T. & L.M. Lozzia (1988) Aves de la Reserva El Bagual. Nuestras Aves 15: 7-9.
- Narosky, T. & A. Martelli (1995) Una nueva visita al este de Formosa. Nuestras Aves 31: 28-29. (enlace)
- Narosky, T. & Chébez, J.C. (2002). Aves de Iguazú: guía para la identificación. (1º Ed.). Buenos Aires: Vázquez Mazzini Editores; 128 pp.
- Narosky, T. & A. Martelli (1995) Una nueva visita al este de Formosa. Nuestras Aves 31: 28-29.
- Narosky, T. & Yzurieta (2010) Guía de identificación Aves de Argentina y Uruguay. Buenos Aires: Vázquez Mazzini Editores
- Navas, J.R. & N.A. Bó (1993) Aves nuevas o poco conocidas de Misiones, Argentina. V. (addenda) Rev. Mus. Arg. Cienc. Nat. Zool. 16 (4): 37-50.
- Nores, M., D. Yzurieta & S.A. Salvador (1991) Lista y distribución de las aves de Santiago del Estero, Argentina. Bol. Acad. Nac. Cs. Córdoba, 59: 157-196. (enlace)
- Nores, M. & D. Yzurieta (1995) Nuevas localidades para aves argentinas. Parte VIII. Hornero 14 (1-2):72-73. (enlace)
- Nores, M. (1996) Avifauna de la provincia de Córdoba. Fauna 1: 255-337
- Oliveira, T., Machado, F. C., & Costa, H.C. (2010) Exchanging carrion for fresh meat: the vulture Cathartes burrovianus (Aves, Cathartidae) preys on the snake Xenodon merremii (Serpentes, Dipsadidae) in southeastern Brazil. Biotemas, 23(4), 177-180. (enlace)
- Olivera, L.R. (2015) Reflejos en las aguas del moconá: naturaleza e historia del Parque Provincial Moconá, su entorno y su gente (1º Ed.) CABA: Fundación de Historia Natural Félix de Azara; 184 pp
- Ordano, M., Bortoluzzi, A., Chatellenaz, M., & Biancucci, L. (2008) Respuesta a corto plazo de las aves a la quema y al pastoreo en pastizales del Parque Nacional Mburucuyá, Argentina. Temas de la Biodiversidad del Litoral Fluvial Argentino III, 425. (enlace)
- Pagano, L. G. & S.A. Salvador (2017) Datos de pesos de aves argentinas. Parte 4. Historia Natural 7:21–43. (enlace)
- Parker, T.A., Castillo U., A., Gell-Mann, M. & Rocha O. (1991) Records of new and unusual birds from northern Bolivia. Bull. Brit. Orn. Club. 111(3): 120–138. (enlace)
- Paulini, H., R. Torres, S. Villalba, M. Michelutti & M. Lépez (2015) Presencia del Jote cabeza amarilla (Cathartes burrovianus) en el Chaco seco argentino. Nótulas Faunísticas. Segunda Serie. No 187: 1-5. (enlace)
- Planqué, R., Vellinga, W.P., Pieterse, S., Jongsma J. & de By, R. (Xeno-canto Foundation). Ficha: Aura sabanera · Cathartes burrovianus · Cassin, 1845; Recuperado el 19/01/2021 de https://www.xeno-canto.org/species/Cathartes-burrovianus
- Pujalte, J.C., A.R. Reca, A. Balabusic, P. Canevari, L. Cusato & V.P. Fleming (1995) Unidades ecológicas del Parque Nacional Río Pilcomayo. Anales de Parques nacionales 16: 1-185. (enlace)
- Remsen Jr, J.V., & Ridgely, R.S. (1980) Additions to the avifauna of Bolivia. The Condor, 82(1), 69-75. (enlace)
- Remsen, J.V., Jr., Areta, J., Bonaccorso, E., Claramunt, S., Jaramillo, A., Pacheco, J.F., Ribas, C., Robbins, M.B., Stiles, F.G., Stotz, D.F. & K.J. Zimmer (SAAC) (enlace) Version: 11 February 2020. A classification of the bird species of South America. American Ornithological Society. Species list by country: Argentina. (enlace)https://www.museum.lsu.edu/~Remsen/SACCBaseline01.htm
- Ridgely, R.S. & Gwynne, J.A. (1989) A guide to the birds of Panama: with Costa Rica, Nicaragua, and Honduras. Princeton University Press. 656 pp.
- Saibene, C.A., Castelino, M.A., Rey, N.R., Herrera, J., & Calo, J. (1996) Inventario de las Aves del Parque Nacional “Iguazú”, Misiones, Argentina (1º Ed.). L.O.L.A. (Literature of Latin America).
- Salvador, S.A., Salvador, L.A., Ferrari. C. & Vitale, S. (2016) Listado de Aves de la Provincia de Córdoba, Argentina. Bird Checklist. Córdoba, Argentina (enlace)
- Salvador, S.A., Salvador, L.A. & Ferrari, C. (2017) Aves de la Provincia de Córdoba. Distribución e Historia Natural. (1º Ed.) Buenos Aires, Argentina
- Schmitt, C.G., Schmitt, D.C., & Remsen Jr, J.V. (1997) Birds of the Tambo area, an arid valley in the Bolivian Andes. Ornithological Monographs, 701-716. (enlace)
- Schulenberg, T.S., Stotz, D.F., Lane, D.F., O’Neill, J.P., Parker III, T.A. & Brack Egg, A. (2010) Birds of Peru. Princeton University Press. 664 pp.
- Sick, H. (1997) Ornitologia Brasileira. Editora Nova Fronteira, Rio de janeiro, Brasil. 912 pp
- Slud, P. (1964) The birds of Costa Rica: distribution and ecology. Bulletin of the American Museum of Natural History 128: 1–430. (enlace)
- Seipke, S.H., & Cabanne, G.S. (2002) Rapaces observadas en un área selvática de San Pedro, Misiones, Argentina. Ornitología Neotropical, 13, 273-282. (enlace)
- Stotz, D.F., Fitzpatrick, J.W., Parker, T.A. & Moskovits, D.K. (1996) Neotropical Birds, Ecology and Conservation. University of Chicago Press, Chicago & London. 478 pp.
- South American Classification Committee (enlace)
- Torres, R., & Michelutti, P. (2001) Las aves de ambientes acuáticos del sistema Laguna Mar Chiquita–Bañados del Río Dulce (provincias de Córdoba y Santiago del Estero, Argentina). Boletín de la Academia Nacional de Ciencias, Córdoba, 66, 61-73.
- Vallely A.C. & Dyer, D. (2018) Birds of Central America: Belize, Guatemala, Honduras, El Salvador, Nicaragua, Costa Rica, and Panama. (1º Ed.) Princeton University Press. 584 pp.
- Wetmore, A. (1926) Observations on the birds of Argentina, Paraguay, Uruguay and Chile. United States Nat. Mus. Bull. 133: 1-448. (enlace)
- Wetmore, A. (1950) The identity of the American vulture described as Cathartes burrovianus by Cassin. Journal of the Washington Academy of Science 40: 415-417. (enlace)
- Wetmore, A. (1964) A revision of the American vultures of the genus Cathartes. Smithsonian Miscellaneous Collections 146(6): 1-18. (enlace)
- Winker, K., Oehlenschlager, R.J., Ramos, M.A., Zink, R.M., Rappole, J.H. & Warner, D.W. (1992) Avian distribution and abundance records for the Sierra de los Tuxtlas, Veracruz, Mexico. Wilson Bull.. 104(4): 699–718. (enlace)
- White, E.W. (1882) Notes on birds collected in the Argentine Republic. Proc. Zool. Soc. London, 591-629. (enlace)
- Yzurieta, D. (1995) Manual de reconocimiento y evaluación ecológica de las aves de Córdoba. Ministerio de Agricultura, Ganadería y Recursos Renovables. Córdoba (enlace)
- Yanosky, A.A. (1987) Acerca del nido del Jote de cabeza amarilla Cathartes burrovianus (Aves, Cathartidae). Nótulas faunísticas 5: 1. (enlace)
-
Jote cabeza amarilla | Conservación
ESTADO DE CONSERVACIÓN SEGÚN BIRDLIFE INTERNACIONAL: PREOCUPACIÓN MENOR.BirdLife International (2014) estima la población total en 0.5-4.99 millones de individuos. Este número contrasta con los datos aportados por Ferguson-Lees & Christie (2001) de 100,000 individuos. Eitniear (1985:6), en el censo realizado en el norte de Belice (15 Abril- 6 Mayo de 1982) registró 61 individuos en 10 localizaciones. El grupo más grande era de 34 individuos y se observó en Crooked Tree Lagoon (Eitniear & McGehee, 2017:40). Koester (1982:99), estimaba que alrededor de 2.419 ejemplares de Cathartes (C.aura+C. Burrovianus) migraban hacia el norte de Colombia desde septiembre a mayo.
Esta especie tiene un rango extremadamente grande y por lo tanto no se aproxima a los umbrales de vulnerabilidad bajo criterio de tamaño de la extensión de la población (Extensión < 20.000 km² combinado con una declinación o fluctuación del tamaño de la extensión, extensión/calidad del hábitat, o tamaño de la población y un pequeño número de localizaciones o con fragmentación grave). La tendencia de la población parece estar en aumento, por esto esta especie no alcanza los umbrales de Vulnerabilidad bajo el criterio de tendencia poblacional (disminución > 30% en diez años o en tres generaciones). El tamaño de la población no se ha cuantificado, pero no se cree que se aproxime a los umbrales umbrales de Vulnerabilidad bajo el criterio de tamaño de la población (<10.000 individuos maduros con una disminución continua estimada > del 10% en diez años o en tres generaciones o con una estructura de población específica). Por estas razones, la especie es evaluada como de “preocupación menor” (Stotz 1996)
Efectos de la actividad humana
Esta especie puede servir como un indicador del estado físico general de los ecosistemas de los humedales tropicales. Todos los factores que reducen las áreas de humedales pueden tener un efecto negativo sobre la población y la distribución del Jote Cabeza Amarilla. Estos factores incluyen el drenaje de humedales para la agricultura y el desarrollo, y el cambio climático que altera los patrones de lluvia. Por otra parte estas especies pueden beneficiarse de la deforestación (Schulenberg et al. 2010:82); (Eitniear, 2020)
Cambios históricos en su distribución
El rango histórico no se ha modificado, pero el número de C. burrovianus en el sur de Tamaulipas ha disminuido desde la década de los ‘60 (Graber & Graber, 1954:166); según los autores (Paulini et al., 2015:3), el aumento de registros en el noroeste de Argentina sugieren un aumento aparente de las poblaciones en la ecorregión del chaco seco.
En Argentina:
No Amenazada (NA): según AA y SAyDS, 2008 (Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable ).López-Lanús, B., P. Grilli, E. Coconier, A. Di Giacomo y R. Banchs. Categorización de las aves de la Argentina según su estado de conservación. Informe de Aves Argentinas /AOP y Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. 1º ed. AOP: Buenos Aires, Argentina
No Amenazada (NA): según MADS y AA, 2017 (Ministerio de Ambiente y Desarrollo Sustentable de la Nación y Aves Argentinas ). Categorización de las Aves de la Argentina según su estado de conservación. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas. 146 p. 2017
No Amenazada (NA): según SAyDS, 2010 (Secretaría de Ambiente y Desarrollo Sustentable ).Categorización de aves autóctonas de Argentina. Lista de aves no registradas, endémicas y exóticas de Argentina (Res 348). 2010
Preocupación Menor (LC): según UICN (API) (Unión Internacional para la Conservación de la Naturaleza ). Lista Roja de la UICN publicada en https://www.iucnredlist.org. Actualización en tiempo real -
Jote cabeza amarilla | Distribución
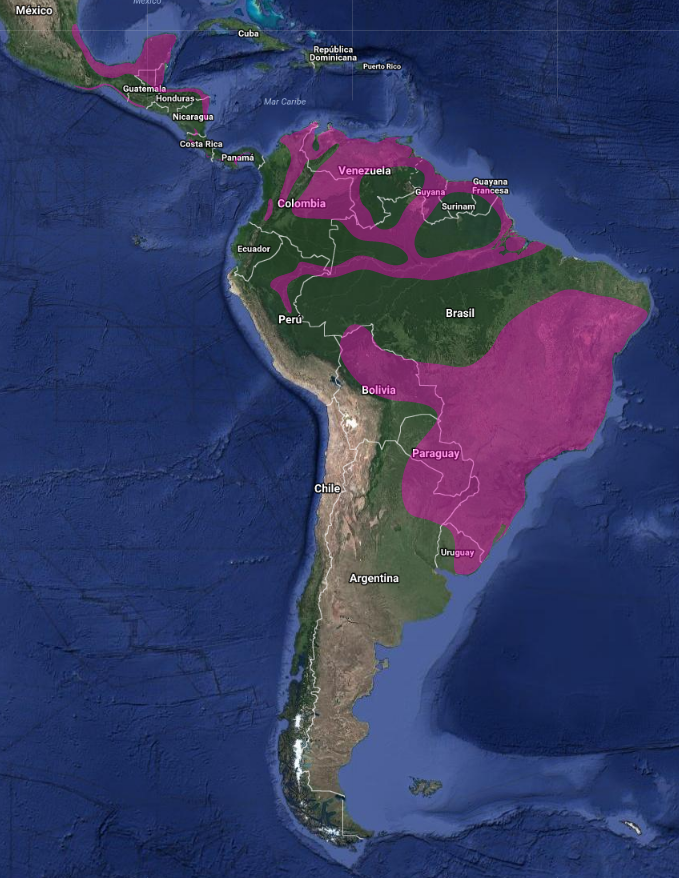
InfoNatura: Animals and Ecosystems of Latin America 2007 Endémico de las Américas.
Es considerado como nativo (residente), aunque puede realizar migraciones de corta distancia en zonas de su área de distribución. Se cree que a veces migra como respuesta a los cambios de nivel del agua. Se han registrado cambios estacionales en el número de las poblaciones en Panamá (Ridgely & Gwynne, 1989) y en Venezuela (Friedmann & Smith, 1950:466), aunque Hilty (2003:224) sugiere que se necesita más documentación sobre las diferencias estacionales de la de población.
Según Koester (1982:373), un C. burrovianus por cada 5-10 C. aura migra a través del norte de Colombia desde septiembre hasta abril. Pareciera que las poblaciones migratorias de C. burrovianus también invernarían en el norte de Colombia (Koester 1982:372).
Dresser (1865:312, 321-322), lo considera posible migrante en el sur de Texas.
El rango histórico no se ha modificado, pero el número de C. burrovianus en el sur de Tamaulipas ha disminuido desde la década de los ‘60 (Greaber & Graber, 1954:165-166). Existen nuevos registros en el centro y noroeste de Argentina que sugieren un aparente aumento de su abundancia en la ecorregión del Chaco seco en Argentina (Paulini et al., 2015:2); (Eitniear, 2020)
Amplia distribución geográfica: Argentina, México (Binford, 1989:86-87); Belice (Eitniear, 1985:7); Bolivia (Remsen & Ridgely, 1980:73); (Schmitt et al., 1987:701); (Parker et al., 1991:122), Brasil (Belton, 1984:431), Chile, Colombia, México (Graber & Graber, 1954:165); (Eitniear, 1985:7); (Wetmore, 1964:12), Costa Rica (Lemon, 1991:698); Nicaragua (Martínez-Sánchez et al., 2014:84); (McCrary et al., 2009:90), Guatemala (Beavers, 1991:80); Panamá, Paraguay, Perú (Schlenberg et al., 2010:82), Surinam, La Guayana Francesa, Guyana, Honduras (Monroe, 1968:151), Uruguay (EcoRegistros, 2015) y Venezuela (Hilty, 2003:224); (de la Peña & Salvador, 2016:158); (Slud, 1964:53); (Stotz et al., 1996:300; Vallely & Dyer, 2018:202); (Eitniear, 1985:6); (Dresser, 1865:322); (Winker et al, 1992:172); (Wetmore, 1964:12); (Vallely & Dyer, 2018:202)
No registrado para Ecuador (Ridgely & Greenfield 2001), ni Chile (Ferguson-Lees & Christie, 2005), aunque Chester (2008:184) cita un registro en Vallenar en la región de Atacama.
Algunos autores consideran 2 subespecies:- Cathartes burrovianus burrovianus (Cassin, 1845) – desde el noroeste de Sudamérica a través de Centroamérica hasta el sureste de Méjico, incluyendo Belice, Costa Rica , El Salvador, Guatemala, la Guayana Francesa, Guyana, Honduras, Méjico, Nicaragua, Panamá, Surinam, Venezuela.
- Cathartes burrovianus urubutinga (Pelzeln, 1861) – desde Sureste de Colombia, Sur de Venezuela y Guayanas, Bolivia, Paraguay y Brasil, hasta Noreste de Argentina y Uruguay (Eitniear, 2020)
En Argentina se distribuye por el noroeste del país: Jujuy, Salta, Formosa, Chaco, Misiones, Corrientes, norte de Santa Fe y Entre Ríos, Santiago del Estero, Tucumán, y noreste de Córdoba (de la Peña, 1999:37); (de la Peña, 2015:140); (de la Peña & Salvador, 2016:158)
Citado en las provincias de:
Buenos Aires
(Colombo & Segura, 2018:671); nuevo registro para la especie en Estancia “Luis Chico” en Punta Piedras (Dto. Punta Indio), dentro del Parque Costero del Sur (Reserva de la Biosfera-MAB-UNESCO), en la ecorregión de pampas, a 35°19ʹ49.75ʹʹS, 57°12ʹ54.54ʹʹ O, obervado por M.A. Colombo & L.N. Segura, el 8 enero de 2018; esta observación es el primer registro publicado en la provincia.
Catamarca
(White, 1882:624); en Sierras de Totoral (julio 1880)
Chaco
(Bodrati & Pietrek, 2000); en Parque Provincial “Pampa del Indio” (Dto. Libertador Gral. San Martín), a 26º16’37’’S, 59º58’04’’O
(Chatellenaz, 2005:539); en el Valle del Río Paraná, entre la confluencia de los ríos Paraná y Paraguay hasta la desembocadura del río Tragadero, cerca de la localidad de Barranqueras (27º29’S, 58º56’O), en palmar-pajonal, residente y nidificante.
(Contreras et al., 1990); citado en «Atlas ornitogeográfico de la provincia del Chaco».
(Hartet & Venturi, 1909:236); Mocoví, Chaco (Charata (Dto. Chacabuco), lugar no identificado.
(Wetmore, 1926:87); observado por primera vez por el autor en Resistencia en julio de 1920; en agosto de 1920 en Riacho Pilagá y Las Palmas
Observaciones: De la Peña (Resistencia, dDto. San Fernando, 12-02-1973)
Córdoba
(Giraudo et al., 2006:129 y 133); escasos registros en la provincia; observada en el bosque chaqueño en primavera y verano (estacional); citado en el sur de Mar Chiquita y en las Salinas Grandes (Torres & Michelutti, 2001)
(Nores, 1996); citado para la provincia.
(Nores e Yzurieta, 1995:72); Dos ejs. observados en las cercanías de Miramar, costa S de la Laguna Mar Chiquita, depto. San Justo, Córdoba, el 16 ene 1991. La especie era conocida del E de Formosa y Chaco, N de Santa Fe, Misiones y Corrientes (Olrog 1979) y de Santiago del Estero
(Paulini et al., 2015:2); en el Chaco seco; hacia el sur y el oeste de la Laguna Mar Chiquita (departamentos Río Seco, Tulumba y Sobremonte) y en las Salinas Grandes (Dto. Tulumba), ambas en la provincia de Córdoba (D. Yzurieta en Nores, 1996; Torres & Michelutti, 2001); enero 2009, Campo de Mare, costa de Mar Chiquita a 14 km al noreste de La Para (Río Primero, a 30º48’32,91”S, 62º52’52,09”O (Torres, Ricardo; Villalba Sabrina; Paulini, Hugo); septiembre 2019, La Para (Río Primero), a 30º51’13,11’S, 63º00’42,23’’O (Michelutti, Matías); noviembre 2010, Totoralejos (Tulumba), a 29°36’6.77″S, 64°51’24.92″O (Roesler, Ignacio)
(Salvador et al., 2016:7); permanente, escaso, en expansión en la provincia; sin datos de nidificación.
(Salvador et al., 2017:103); Escaso, aunque en expansión. Permanente. Registrado en Departamentos de San Justo, Río Seco, Tolumba, Sobremonte y Unión.
(Torres & Michelutti, 2001); citado en Las aves de ambientes acuáticos del sistema Laguna Mar Chiquita – Bañados del Río Dulce (provincias de Córdoba y Santiago del Estero)
(Yzurieta, 1995); citado por el autor en “Manual de reconocimiento y evaluación ecológica de las aves de Córdoba”.
Corrientes
(Azpiroz et al., 2013:309,364,369); en invierno y verano en Ea. Maria Concepción (Dto. Sto Tomé), a 28º 10’25.82’’S 56º 26’ 22.26’’O y La Higuera, a 27º 59’41.83’’S 56º 18’37.32’’O, (Dto San Martín) y en verano en Ea. La Sirena (Dto. San Martín), a 28º 23’42.43’’S, 56º 32’22.82’’O. Raro, se observaron 2 ejemplares sobre bosque ripario del Rio Miriñay, a 29°43’S-57°38’O y pastos contiguos cerca del casco de la sección Cambaí; en humedales, arroyos, cañadas, embalses, etc y pastizales. Establecimiento de campo Gral Avalos, Monte Caseros.
(Cano et al., 2011); Parque Nacional Mburucuyá
(Capllonch et al., 2005:486); en la selva de galería en el noreste de la provincia, en el área de estudio ubicada frente a la Isla de San Mateo, en la ribera oeste del Río Uruguay, a 28º29’S, 55º57’O, 17 Km al norte de Santo Tomé. El muestreo se realizó entre el 14 y el 20 de Septiembre del 2003 y el 14 y 21 de Abril del 2004 en la Estancia La Blanca, a 28°29’S, 55°57’O.
(Chatellenaz et al., 2010:153); en Parque Nacional Mburucuyá situado entre 27º58’S – 28º05’S y 57º59’ – 58º 08’O en el noroeste de la provincia; observado en ambientes de bosque, pajonal, palmar-pajonal; residente
(Contreras, 1981); en su «Lista preliminar de la avifauna correntina».
(Fraga, 2001:80); Estancia San Juan Poriahú, ubicada al norte de los Esteros del Iberá, dentro de la Reserva Provincial del Iberá, Dto. San Miguel, a 27º42’S, 57º11’O); residente con registros de nidificación
(Giraudo et al., 2006a:8); citado para la reserva y sitio ramsar “Esteros del Iberá”
(Hutton & Schimff (2001); Parque Nacional Mburucuyá
(López-Lanús et al., 2013a:297); rara; observados 2 individuos en vuelo, en el mes de agosto, sobre el bosque ripario del Rio Miriñay y pastizales contiguos cerca del casco de la sección Cambaí.
(Narosky, 1983:122); Río Guayquirararó, a 30°18’S, 59°32’O, y una pareja a 60 metros de la frontera con Entre Ríos, provincia donde todavía no ha sido citado.
(Ordano et al., 2008); en pastizales del Parque Nacional Mburucuyá,
Observaciones: De la Peña (Mburucuyá (Dto. Mburucuyá), el 19-09-1979
Chaco
(Bodrati, et al., 2010); Parque Provincial Pampa del Indio (SIB)
(Contreras et al, 1990); citado en «Atlas Ornitogeográfico de la Provincia del Chaco»
Entre Ríos
(De la Peña, 1996:89) y (De la Peña, 2006:31); observados 2 ejemplares en el Arroyo Yacaré, a 30°29’19″S, 59°32’48″O, ruta 22, Dto. La Paz, el 18 de diciembre de 1991.
(Marateo et al., 2009:55); Parque Nacional El Palmar, ocasional, durante todo el año, a 31°50’S, 58°17’O
Formosa
(Chebez et al., 1998); ciatdo en «Las aves de los Parques Nacionales de la Argentina».
(Contreras, 1987); citado en «Lista preliminar de la avifauna de la provincia de Formosa, República Argentina».
(Contreras et al., 2014:104); comenta que esta especie cuenta con numerosos registros que se distribuyen en todo su territorio. Residente; En la zona oriental formoseña es la segunda especie en cuanto a dominancia numérica entre los Cathartidae locales, aunque hacia el oeste es reemplazada progresivamente en ese papel por el por Cathartes aura.
(Di Giacomo, 2005:188); en Reserva El Bagual, Dto Laishi, a 26º10’S, 58º56’O (Chaco húmedo)
(Gorleri & Di Giácomo., 2011:4); en «Aves de la Reserva de Biosfera Laguna Oc», a 26°14′0″ S, 58°10′0″O
(Laubmann, 1930:90); menciona dos ejemplares colectados en Lapango (actual Puerto Pilcomayo), a 25°22’S, 57°39’O, Departamento Pilcomayo, en septiembre de 1925.
(López Lanús, 1997:29); Parque Nacional “Río Pilcomayo”, a 25°08’S,58°15’O ; común, residente, probable nidificante; en isletas de monte, selvas en galería, sabanas con palmares y esteros. Es la especie más observada en todo el parque; en Laguna Blanca, a 25°12’S, 58°00’O, Campo Serventi, a 25°10’45″S, 58°4’31″O, Estero Poí, a -25.05 -58.1833333, Seccional Guardaparque Ricardo Fonzo, Abadie-Cué, a -25.1166667 -58.15 , Lata-Cué , a -24.9612, -58.37594, Paso Pomelo y Paso von Kelson.
(Narosky & Lozzia, 1988); en «Aves de la Reserva El Bagual»
(Narosky & Martelli, 1995:29); en Ea. Clarín, a 25°40’S, 58°00’O
(Pagano & Salvador, 2017:25); en Ea. La Marcela, a 26°17’S, 59°08’O), Dto. Pirané,
(Paulini et al., 2015:2); el autor comenta que existen varios registros en la provincia, pero mayormente concentrados hacia el este; se cita para el oeste provincial, la Reserva Natural Formosa (Chebez
et al., 1998; Contreras et al., 2014). Junio 2006 en Pozo del Mortero, a 24º24’11.97’’S, 61º01’49.09’’O (Blendinger, Pedro); Julio 2009 en Campo de Mario Rodríguez, 30 km al noreste de Las Lomitas por R.P. N°28 (Dto. Patiño), a 24°29’23,42”S, 60°25’12,54”O (Torres, Ricardo; López, Martín); en julio 2009 en Lote 27, 41 km al noroeste de Las Lomitas (Dto. Bermejo), a 24°34’20,78”S, 60°58’41,48”O (Torres, Ricardo; Lépez, Martín).
(Pujalte et al., 1995:95); en Parque Nacional «Río Pilcomayo»
(Wetmore, 1926:87); en agosto de 1920 colectó un ejemplar y avistó otros en el Riacho Pilagá y en kilómetro 182, ambas localidades en el Departamento Pirané.
(Yanosky, 1987:1); observaron 2 nidos, construidos directamente sobre el suelo, a mediados del mes de septiembre (1987) en áreas de pastizal (antiguos cultivos) en la Reserva «El Bagual» (Dto. Laishi) a 26º10’53’’S, 58º36’39’’O. Armados con “paja boba”, con dos huevos y dos entradas. En uno de ellos la puesta fue depradada por la iguana overa (Tupinambis tequixin)
Jujuy
(Burgos et al., 2009:7); en «Lista de las aves de la Provincia de Jujuy, Argentina». En chaco serrano y chaco seco
Misiones
(Chébez, 1996:122); en Dtos de Capital, Candelaria, Apóstoles, L.N. Alem, San Ignacio, Montecarlo, Cainguás e Iguazú
(Olivera, 2015:167); Parque Provincial Moconá (Dto. San Pedro)
(Giraudo et al., 1993:7); en Arroyo Yabotí, Saltos del Moconá y Aristóbulo del Valle (Dto. Cainguás)
(Krauczuk, 2005:14); Inta-Campo Anexo de Zaiman, y Campus de la Universidade Nacional de Misiones; en vuelo y posados en alambradas. Campos y malezales; El área de estudio se localiza en el sector suburbano de la Ciudad de Posadas, a 27°26’S, 55°53’O,
(Krauczuck, 2009:31); registrado en campos de ganadería; los estudios fueron realizados en el municipio de Corpus Christi, parte SO del municipio de Santo Pipó y parte NO del municipio de Gobernador Roca (27º07’56.15”S, 55º 28’1.97”O. El paisaje es ondulado, con remanentes de Selvas Mixtas de Laurel y Guatambú
(Navas & Bó, 1993); en «Aves nuevas o poco conocidas de Misiones, Argentina».
(Saibene et al., 1996:26); rara, visitante ocasional del Parque Nacional Iguazú
(Seipke & Cabanne, 2002:276); en Reserva de Biosfera Yabotí (Dto. San Pedro), a 26°52’S, 53°57’O. Observado al menos una vez en todas las campañas, excepto en Abril 1995 y Septiembre 1998. Vuelos bajos.
Observaciones: De la Peña (Cataratas del Iguazú, Dto. Iguazú, 06-02-1973), aunque Narosky & Chébez (2002) no lo citan para el Parque Nacional Iguazú.
Salta
(Coconier et al., 2007:38); en «Las aves silvestres de Acambuco». Rara-visitante ocasional; un individuo registrado el 7 de julio de 1990 en las inmediaciones del Río Seco. Otros dos individuos observados en vuelo sobre el valle aluvial del Río Seco, a 22º28’58’’S, 63º59’25’’O el 28 de abril de 1991 (F.M.). La especie es frecuente en áreas del chaco salteño distantes unos 40 km al este de Tartagal, donde incluso es más habitual que el Jote Cabeza Colorada (C. aura) (F.M. obs.pers.).
(Moschione et al., 2012:14); en zona de chaco, escaso y residente
(Paulini et al., 2015:2); según el autor, en la provincia de Salta aunque el Cathartes burrovianus no es registrado por Narosky e Yzurieta (2003) y Rodríguez Mata et al. (2006), existe un registro en la Reserva Provincial de Usos Múltiples Acambuco, Dto. General José de San Martín (Coconier, 2007). En la misma publicación, se menciona la presencia de la especie en áreas del Chaco salteño distante a unos 40 km al este de Tartagal, señalándose que en esa zona la misma es más habitual que el Jote Cabeza Colorada (Cathartes aura) (Moschione en Coconier, 2007); Observado en Junio 2006, en Dragones (Dto. Gral. José de San Martín), a 23°15’0.00”S, 63°20’59.99”O (Blendinger, Pedro); septiembre 2019, A 13 km al este de Pichanal (Anta), a 23º20’56,78”S, 64º05’11,71”O (Villalba, Sabrina; Torres, Ricardo); septiembre 2019, Campo Pyrenees, a 31 km al noroeste de Taco Pozo por R.N.N° 16 (Anta), a 25º33’15”S, 63º34’14,99”O (Torres, Ricardo; Lépez, Martín).
Santa Fe
(De la Peña, 2006:31); se distribuye por el noreste de la provincia; escaso, residente. Nidificaría localmente.
(Giai, 1950:162); en el Dto. 9 de julio
(López-Lanús et al., 2013b:309); Ea. «El Estero» en verano y «La Norma» en invierno.
(López-Lanús et al. 2013c:404); rara en bajos meridionales. Ea. «La Sombrilla»
Santiago del Estero
(Nores et al., 1991:164); en Bañado de Figueroa, a 27º20’S, 63º38’O, (Dtos. Figueroa y Alberdi) y Bañado de Añatuya (Dto. Gral Taboada), a 28º32’S, 62º53’O. Permanente y frecuente.
(Paulini et al., 2015:2); en los Bañados de Añatuya (en los departamentos Taboada y Avellaneda) y Figueroa (en los departamentos Figueroa y Alberdi) en la provincia de Santiago del Estero (Nores et al., 1991); abril 2010, Terraplén sobre los Bañados del Río Dulce (Dto. Rivadavia), a 29º54’46,34”S, 62º15’44,77”O (Torres Ricardo).HÁBITAT
Sus hábitats naturales incluyen tierras bajas tropicales o subtropicales, inundadas o que se inundan estacionalmente, como sabanas, pantanos, pastizales, manglares, esteros y ambientes abiertos con árboles dispersos. Puede entrar en los bosques, aunque usualmente sólo se le ve en los bordes de éstos (Márquez et al., 2005:79). De 0 a 2000 msnm (del Hoyo, 2020:266); (Hilty & Brown 1986); (Hilty 2003); (Schulenberg et al., 2010); (Eitniear, 2020).
Ecorregiones: Chaco húmedo, Chaco seco, Espinal, Esteros del Iberá, Selva de Yungas, Selva paranaense (Barnett & Pearman, 2001:30); (Contreras et al., 2014:104) y Pampas (Stotz et al, 1996:142).